Vliv ionizujícího záření na živé organismy - rizika a
využití v medicíně
5.
Biologické účinky ionizujícího záření
Radiační ochrana
5.1. Účinky záření
na látku. Základní veličiny dozimetrie
5.2. Biologické
účinky ionizujícího záření
5.3. Cíle a metody
ochrany před zářením
5.4. Radiační monitorování a osobní
dozimetrie
5.5. Otevřené
radionuklidy. Vnější a vnitřní kontaminace
5.6. Radiační ochrana
na pracovištích s ionizujícím zářením
5.7. Radiační zátěž
při radiační diagnostice a terapii
5.8. Legislativní
zabezpečení radiační ochrany
5.1.
Účinky záření na látku. Základní veličiny dozimetrie
Fyzikálně-chemické
účinky ionizujícího záření
V §1.6 "Ionizující záření" jsme se podrobně zabývali vlastnostmi různých
druhů záření a jeho interakcemi s látkovým prostředím;
bylo to však především z pohledu fyziky záření,
tj. vlivu látkového prostředí na šíření záření, jeho
absorbci, rozptyl či konverzi na jiné druhy záření. Zde se
budeme interakcemi záření zabývat z pohledu vlastní látky
vystavené záření, tj. účinků záření na
fyzikální a chemické vlastnosti látky. Zvláštní pozornost
pak bude věnována účinkům záření na živou tkáň.
Již sám název "ionizující
záření" (viz definici v §1.6) napovídá, že
základním fyzikálním účinkem tohoto záření na každou
látku je ionizace - z původně elektricky
neutrálních atomů jsou vyráženy záporné elektrony, čímž
se tyto atomy mění v kladně nabité ionty. Výsledný vliv
této ionizace na ozařovanou látku rozhodujícím způsobem
závisí na jejím atomovém složení :
Ozáření prvku - žádná
chemická změna
Pokud je ozařovaná látka prvkem
složeným ze stejných atomů, po
skončení ozařování uvolněné elektrony vzápětí rekombinují
s kladnými ionty za vzniku opět těch samých
atomů prvku jako před ozářením. Chemické
změny nejsou žádné, mohou se případně
objevit menší fyzikální změny, např. vznik
atomárního kyslíku a ozonu při ozařování plynného
kyslíku O2, nebo změny krystalické struktury prvků v
pevné fázi :
Představme si např. pokus, kdybychom
ozařovali monokrystal diamantu. Po
chemické stránce je diamant prvek
složený z atomů uhlíku v kubické
krystalové mřížce (tato vysoce
pravidelná krystalová mřížka způsobuje význačné
optické vlatnosti diamantu). Po
skončení ozařování tedy všechny uvolněné
elektrony "naskáčí" zpět do atomů a bude
to opět čistý uhlík. Avšak během ionizace,
kdy jsou z atomů uhlíku vyráženy elektrony, zpravidla
ionizované atomy uhlíku "vyskočí" z vazby v
krystalové mřížce a po rekombinaci se tam již
nevrátí - zůstanou volné ve formě amorfního
uhlíku. Při ozařování velkými radiačními
dávkami by původně čirý krystal diamantu začal tmavnout
- stal by se z něj tzv. "carbonado - černý
mogul" *). Při ještě větších dávkách
(tisíce Gy) by se nakonec krystal diamantu rozpadl
na černý prášek, "saze". Majitel
krásného diamantu by jistě nebyl rád, kdyby si z
tohoto pokusu místo krystalu odnesl hromádku sazí...
*) Tyto tmavé diamanty zvané
"carbonado" se dříve nacházely v západní
Indii, nyní ve střední Africe a Brazílii. Jejich
tmavé zabarvení však není způsobené žádným
zářením, ale fyzikálně-chemickými procesy při
jejich dávné krystalizaci, s příměsí grafitu a
amorfního uhlíku.

Pozn.:
Vysokoenergetické
a velmi intenzivní záření
Toto všechno platí pro "běžné" druhy
záření a, b, g obvyklých energií, kdy dochází k
interakcím na úrovni atomového obalu. Avšak
záření, jehož kvanta mají velmi vysokou
energii (vyšší než cca desítky MeV), nebo
záření neutronové, způsobuje
interakce a změny i v jádrech atomů
ozařovaného materiálu - dochází k fyzikálním (a
indukovaným chemickým) změnám,
včetně transmutace a aktivace
původně neradioaktivních jader.
Neuvažujeme zde též situaci extrémně vysokých
toků záření, kdy absorbovaná energie může
vést k roztavení či vypaření
ozařované látky (to se může stát např. i u
terčíků ozařovaných v urychlovači...).
Ozáření sloučeniny ® chemické změny
Pokud je však ozařovanou látkou sloučenina
tvořená molekulami různých prvků, zvláště
složitá organická látka, ionizace atomů může vést
k řadě chemických změn a reakcí :
1. Ionizované atomy se uvolňují
z chemických vazeb, dochází k disociaci
molekul. Rozklad sloučenin působením
ionizujícího záření se nazývá radiolýza.
2. Atomy a molekuly uvolněné
při radiolýze zpravidla nejsou neutrální, ale
ionizované a mají nespárované elektrony - vznikají vysoce
reaktivní radikály. Ty mohou dále chemicky
reagovat s ostatními molekulami látky. Svými
oxidačními a redukčními účinky mohou štěpit
vnitřní molekulové vazby a měnit chemickou
strukturu molekul - vznikají nové
sloučeniny. Otevře se celá "brána"
nových chemických reakcí.

Po ozáření sloučeniny je tedy část původních
molekul rozložena, naproti tomu se
objevují nové molekuly, které zde
dříve nebyly. Čím složitější je ozařovaná
látka, tím různorodější chemické změny a reakce v
ní nastávají. Nejsložitější chemické látky jsou
obsaženy v živých organismech. Při
ozáření živé tkáně tedy dochází k velmi
různorodým složitým (bio)chemickým reakcím, které
mohou vyústit v biologické změny na
úrovni buněk, orgánů i celých organismů.
Základní
veličiny dozimetrie
Dozimetrie ionizujícího záření je obor radiační
fyziky, který se zabývá účinky záření na látky ve vztahu
k druhům a vlastnostem interakce záření s látkou a k
množství záření, pohlceném v látce (pohlcená energie -
"dávka"). Studovanou látkou je především živá
tkáň, modelová měření dávek a dávkových
příkonů se provádějí ve vodě, vzduchu a speciálních dozimetrických
fantomech. Navazuje na fyzikální mechanismy interakce
záření s látkami, podrobně rozebíranými v §1.6 "Ionizující
záření".
Absorbovaná
radiační dávka
Míra fyzikálně-chemických účinků
záření na látku - jakož i indukovaných účinků
biologických, pokud ozařovanou látkou je živá
tkáň - je úměrná koncentraci iontů
vzniklých v daném objemu látky. A tato koncentrace iontů je
zase úměrná energii, která byla látce v
daném objemu zářením předána.
Tato výchozí dozimetrická veličina, zvaná předaná
či sdělená energie E představuje energii
[J,eV], kterou ionizující záření předalo látce
v určitém objemu. Je obecně daná třemi složkami: E = SEin - SEout + SEnucl. Zde SEin je součet energií
všech ionizujících částic, které do daného objemu
vstoupily, SEout je součet energií všech částic, které daný objem
opustily. SEnucl je součet všech případných změn klidových
energií jader a částic, k nimž došlo v uvažovaném objemu
při event. jaderných přeměnách vyvolaných účinky
záření (v praxi je tato třetí složka většinou nulová, s
výjimkou vysokoenergetického záření cca 10MeV a vyšší).
Tato veličina má jen "školní" význam a v
dozimetrické praxi se nepoužívá...
Základní dozimetrickou
veličinou, která nám charakterizuje fyzikálně-chemické a
posléze i biologické účinky záření na látku, je absorbovaná
radiační dávka :
Absorbovaná
dávka (zkráceně
jen "dávka") D
je energie ionizujícího záření absorbovaná v daném
místě ozařované látky na jednotku hmotnosti. Je tedy
dána poměrem
D = DE / Dm ,
kde DE je střední energie ionizujícího záření
absorbovaná v objemovém elementu látky a Dm je
hmotnost tohoto objemového elementu. Jednotkou
absorbované dávky je 1 J /1kg,
která se nazývá 1Gray [Gy] (dílčí
jednotky pak 1mGy=10-3Gy a 1mGy=10-6Gy).
Tato základní dozimetrická
jednotka tak byla nazvána na počest anglického
radiologa R.H.Graye (1905-1965), který se ve
30.-50.letech intenzívně zabýval interakcemi záření
s látkou a účinky záření na živou tkáň (včetně nádorové tkáně - prozkoumal m.j.
tzv. kyslíkový efekt, zmíněný níže v
§5.2, text pod obr.5.2.2).
Starší jednotkou radiační dávky (v soustavě CGS)
byl 1 rad = 10-2
Gy (rad
= radiation absorbed
dose).
Jelikož převážná část absorbované energie se v
konečném důsledku mění na teplo,
charakterizuje nám absorbovaná dávka i množství
předané tepelné energie - zahřátí
ozařovaného materiálu. Při dávkách používaných v
biologických aplikacích je však toto radiační
zahřívání zanedbatelné.
Dávkový
příkon D´
je dávka obdržená v daném místě ozařovanou látkou
za jednotku času, tedy poměr přírůstku dávky DD za
časový interval Dt :
D´ = DD / Dt .
Jednotka je Gray za sekundu [Gy.s-1], praxi se častěji používají jednotky
[Gy/min.] nebo [mGy/hod.].
Velikost dávky či dávkového
příkonu závisí na intenzitě záření v
ozařovaném místě (je přímo úměrná fluenci
záření), druhu a energii kvant ionizujícího
záření, jakož i na vlastnostech interakce a absorbce
tohoto záření v dané látce. I když radiační dávka je fyzikální
veličina v zásadě použitelná pro různé látky a
materiály, v radiační dozimetrii se
používá především v biologických aplikacích
- stanovuje se hlavně pro měkké tkáně nebo vodu.
A tak je tomu pro všechny níže uvedené dozimetrické
veličiny.
Poznámka:
Veličina radiační dávka se zavádí pro vyjádření
míry obvyklých (zjevných, makroskopických) účinků
záření na látku - tedy absorbovaná energie, která se
projeví fyzikálně-chemickými změnami na úrovni
elektronových obalů, či zvýšením kinetické energie pohybů
atomů a molekul v látce. Ve vzácných případech však může
být energie záření pohlcena atomovým jádrem způsobem,
který se na úrovni atomu přímo neprojeví. Je to především
u neutronového záření, kdy některé neutrony mohou být
pohlceny jádry ozařované látky za vzniku těžšího isotopu.
To se neprojeví na běžných fyzikálně-chemických
vlastnostech látky, ale jen na zvýšení hmotnosti některých
atomů. Je diskutabilní, zda tuto část absorbované energie
máme započítat do radiační dávky. Situace je zde ještě
složitější: jádra která absorbovala neutrony jsou často
radioaktivní (dochází k aktivaci) a při jejich
přeměnách je následně uvolňovaná značná energie,
způsobující radiační zátěž.
Expozice,
kerma, terma
Při hodnocení účinku nepřímo ionizujícího záření na
látku se můžeme ještě setkat s veličinami expozice
a kerma, zvláště ve starší literatuře:
¨ Kerma (zkratka z angl.: kinetic
energy released
in material -
kinetická energie uvolněná v materiálu)
má velmi podobou definici K = DE/Dm a stejnou jednotku [Gy]
jako absorbovaná dávka, přičemž za DE se bere součet
počátečních kinetických energií všech nabitých částic
uvolněných v důsledku interakce částic primárního
ionizujícího záření v uvažovaném objemu látky o hmotnosti
Dm.
Kerma se zavedla proto, že základní definice dávky,
zahrnující jen uvolněné přímo ionizující částice,
nedávala informaci o tom, co se děje v okolí sledovaného
objemu látky, zvláště v případě sekundárního nepřímo
ionizujícího záření. Pro nabité primární částice není
mezi kermou a dávkou rozdíl (pro záření tvořené nabitými
částicemi se kerma ani nedefinuje). I u nepřímo
ionizujícího záření v rovnovážném stavu *), kdy
se sekundárně vznikající záření absorbuje, platí K=D;
pouze v nerovnovážných procesech, v blízkosti povrchu látky
či při vysokých energiích, kdy může část záření
unikat, bude KąD, přičemž rozdíly nebývají v praxi velké. Mezi
dávkou a kermou platí vztah D = K.(1-g), kde g je frakce energie
uvolněných nabitých částic, která se ztrácí při
radiačních procesech v materiálu. Pro záření X a gama o
energii menší než 3MeV hodnoty obou veličin (kermy a dávky)
prakticky splývají, hodnota g činí pouhé zlomky procenta.
*) Elektronová rovnováha
je stav, kdy energie uvolněná primárním zářením v daném
elementárním objemu látky je stejně velká jako energie,
kterou tam předají sekundární elektrony. Tato rovnováha je
narušena při povrchu látky a v okolí rozhraní dvou různých
prostředí. Při proniknutí primárního nepřímo
ionizujícího kvanta (fotonu) do prostředí je uvolněná
energie odnášena sekundárními elektrony a může se
absorbovat ve větší hloubce. Při nízkých energiích
(X-záření) je doběh sekundárních elektronů velmi malý a
energie je absorbována prakticky ihned v místě uvolnění z
interakce primární částice - elektronová rovnováha je
splněna a hodnota dávky je číselně stejná jako kerma. U
vysokoenergetického g-záření odnášejí sekundární elektrony uvolněnou
energii do větší hloubky - dávka vykazuje počáteční
stoupání a teprve ve větší hloubce nastává elektronová
rovnováha a dávka svou hodnotou sleduje kermu.
U nepřímo ionizujícího
záření (fotony g, neutrony) kerma charakterizuje energii předanou
nabitým částicím v látce (elektronům a protonům)
především při první srážce. Kerma závisí pouze na
interakcích primárního záření v materiálu hmotnostního
elementu Dm, zatímco absorbovaná dávka závisí také na sekundárních
částicích, které byly vytvořeny v okolí analyzovaného
objemového elementu a vstoupily do tohoto hmotnostního elemenru
Dm (kdy
byly částečně nebo úplně absorbovány). U kermy je třeba
specifikovat, k jaké látce se vztahuje (např. kerma ve vzduchu
či kerma v tkáni).
Kerma prostřednictvím interakcí s látkovým
prostředím vyjadřuje spíše vlastnosti svazku záření,
zatímco dávka vyjadřuje účinek na ozářené prostředí.
Pokud je kerma uvedena v tomtéž daném látkovém prostředí,
většinou ve vzduchu, může být použita ke kvantifikaci
"vydatnosti" zdrojů záření, kermový příkon
je úměrný fluenci záření.
V novější literatuře se vyskytuje, i když velmi zřídka,
veličina terma:
¨
TERMA (Total
Energy Released
per unit MAss -
celková energie uvolněná v jednotce hmotnosti materiálu) má
prakticky stejnou definici T = DE/Dm a stejnou jednotku [Gy]
jako absorbovaná dávka. Je to násobek hmotnostního
koeficientu zeslabení (m/r) a primární fluence [MeV/cm2] energie záření v daném místě.
Pokud je při interakci svazku záření dosaženo rovnováhy
nabitých částic, není rozdíl mezi veličinami terma
a dávka (resp. jejich vztah je lineární). Avšak na
rozhraní různých látek nebo na okrajích svazku mohou vznikat
rozdíly.
¨
Expozice
je definována jako poměr absolutní hodnoty DQ celkového elektrického
náboje iontů jednoho znaménka, které byly uvolněny při
interakci fotonů (X nebo gama) v hmotnostním elementu vzduchu
o hmotnosti Dm, při úplném zabrzdění všech vzniklých
elektronů a pozitronů: DQ/Dm, vztažený na jednotku hmotnosti tohoto vzduchu.
Jednotkou expozice v soustavě SI je coulomb na kilogram [C.kg-1] *). Do tohoto
celkového elektrického náboje DQ se přitom započítává
pouze náboj iontů uvolněný interakcí primárních fotonů a
interakcí sekundárních elektronů uvolněných z atomů
vzduchu, nezapočítává se další náboj, který může
vzniknout absorbcí brzdného záření emitovaného elektrony
(popř. charakteristického X-záření). Pro vysoké energie
fotonů g (vyšší než 2-3MeV), kdy dodatečnou ionizaci
způsobenou brzdným zářením nelze zanedbat, již veličina
expozice nezachycuje objektivně účinek takového záření.
*) Rentgen R
Dřívější jednotkou expozice v soustavě jednotek CGS
(Centimetr-Gram-Sekunda)
byl rentgen R: Je to takové
množství záření, při kterém se ionizací uvolní 1
elektrostatická jednotka (1esu » 3,3.10-10C) náboje v 1cm3 suchého vzduchu (za normálních podmínek teploty a
tlaku). Převodní vztah je 1R=0,258 C.kg-1.
Z hodnoty expozice nelze zcela objektivně
určit přesnou radiační dávku absorbovanou jinou látkou než
vzduchem, protože absorbovaná radiační dávka závisí na
vlastnostech materiálu a na typu a energii záření. Pro
záření gama a X o běžných energiích desítky až stovky
keV se při expozici 1 Rentgen v lidské tkáni
absorbuje dávka přibližně 0,01 Gray (1 Rad).
Zjednodušeně tedy platí převodní vztah: 1 Rentgen »
10 mSv. V různých radiačních tabulkách se
přepočítávací faktor mezi Rentgeny a Sieverty uvádí v
rozmezí 1 R = (0,0087-0,0096) Sv.
Podobně
jako u radiační dávky, i u kermy a expozice se definuje kermový
příkon a expoziční příkon, jakožto
přírustek kermy či expozice za jednotku času (1sekundu);
místo slova "příkon" se dříve používal výraz
"rychlost".
Obě tyto veličiny, expozice a
kerma, se v dozimetrické praxi již většinou opouštějí,
používají se ještě okrajově při primární etalonáži
svazků záření (např. v radioterapii, radiodiagnostice). V
literatuře z oblasti radiodiagnostiky a radioterapie však ze
setrvačnosti terminologicky často přetrvávají. Pro
monitorování X-záření v rtg diagnostice se používá např.
"vstupní kermový příkon ve vzduchu".
Terminologická poznámka
Slovo "expozice" v našich
materiálech z jaderné a radiační fyziky používáme v jeho
obecném přírodovědném významu: osvětlení - míra
ozáření nějakého objektu či materiálu, osvit
(příp. doba osvitu)
při fotografii nebo jiném radiačním zobrazení. S shora
uvedenou starší opuštěnou dozimetrickou veličinou nemá
téměř nic společného!
Radiační
dávka z radioaktivity
Častými zdroji ionizujícího záření v praxi bývají radionuklidy
(§1.2 "Radioaktivita"). Vzhledem k ozařovanému objektu se radioaktivní
látka může nacházet buď vně - externí
radionuklidový zářič, nebo může být obsažena
přímo uvnitř zkoumaného objektu - vnitřní
distribuce radioaktivity.
Externí
radionuklidový zdroj
Externí radionuklidové zdroje jsou nejčastěji provedeny ve
formě zapouzdřených uzavřených radioaktivních
zářičů. Zdroji záření však mohou být i poblíž
umístěné radioaktivní preparáty v lahvičkách či
zkumavkách, jakož i pacient s aplikovanou aktivitou
pro radionuklidovou diagnostiku nebo terapii. Radioaktivní
zářič emituje své záření (dané druhem radioaktivních
přeměn a aktivitou) v zásadě izotropně do všech
směrů, do plného prostorového úhlu 4p. Se vzdáleností r
od zdroje se záření "zřeďuje", je distribuováno
na myšlené sféře o ploše S=4pr2. Intenzita záření I (fluence
kvant), emitovaného radioaktivním zdrojem, je tedy přímo
úměrná aktivitě preparátu A a nepřímo úměrná
druhé mocnině vzdálenosti r od zdroje (přesně to platí pro bodový zářič, přibližně
za situace, kdy vzdálenost je podstatně větší než rozměry
zdroje) :
I = G . A/4pr2
,
kde G je počet kvant emitovaných radionuklidem na 1 rozpad.

Totéž platí i o fluenci energie, určující
radiační dávku. Množství energie W [J/s], vyzářené
radioaktivním zářičem za jednotku času (1s.), je dáno
součinem aktivity A [Bq] a střední energie <E>
[eV] kvant emitovaných na 1 rozpad: W = G.A. <E> .1,6.10-19 (koeficient 1,6.10-19 je přepočítávací faktor mezi jednotkami energie
[eV] a [J]). Radiační dávka, obdržená
za čas t, v místě ve vzdálenosti r od
radioaktivního zdroje, tedy bude :
D =
G. (A.<E>.1,6.10-19)/(4pr2)
. t ,
což se obvykle vyjadřuje ve zkráceném tvaru D = G . A/r2 . t, s použitím konstanty G= <E>.1,6.10-19/4p (pro daný
radionuklid).
Radiační dávka D od vnějšího
radioaktivního zdroje záření je tedy dána jednoduchým
vztahem *)
D = G .
A/r2 . t
,
kde A je aktivita zářiče, r je vzdálenost od
zářiče, t je doba expozice. Koeficient G je tzv. dávková
konstanta (gama-konstanta), udávající
dávkový příkon [Gy.s-1] ve vzdálenosti 1m od radioaktivního zdroje o
aktivitě 1Bq.
*) Máme zde na mysli fotonové
záření (gama) a bodový (nebo dostatečně malý)
zářič, umístěný ve vakuu (či ve vzduchu), bez stínících
materiálů. Pro záření a a b je problematické tento vztah použít, neboť část
takového záření se absorbuje již v samotném zdroji
a k další absorbci dochází ve vzduchu či jiném prostředí,
ležícím mezi zdrojem a měřeným místem. Neuvažujeme zde
poločas rozpadu radionuklidového zdroje - máme na mysli
situaci, kdy doba expozice t je krátká ve srovnání s
poločasem rozpadu (v opačném případě
by bylo nutno provést časovou integraci, podobně jako je v
následujícím odstavci pro distribuovanou radioaktivitu).
G-konstanta
má základní jednotku [Gy.m2.Bq-1.s-1], v praxi se však používá nejčastěji [mGy.m2.GBq-1.h-1] - dávkový
příkon [mGy/hod] ve vzdálenosti 1m od radioaktivního zdroje o
aktivitě 1GBq. Dávková G konstanta v sobě zahrnuje vlastnosti radionuklidu -
počet emitovaných fotonů na rozpad a jejich energie, ve vztahu
k absorbci v ozařované látce (ve vodě či v měkké tkáni);
má rozdílné individuální hodnoty pro každý radionuklid. V
obvykle používaných jednotkách [mGy.m2/GBq.hod] má dávková gama-konstanta pro některé
nejčastěji používané radionuklidy hodnoty :
| Radionuklid
: |
pozitron.radionuklidy
18F,15O,11C |
60Co |
99mTc |
131I |
137Cs |
192Ir |
226Ra |
241Am |
G-konstanta
:
[mGy.m2.GBq-1.h-1] |
0,138 |
0,308 |
0,016 |
0,052 |
0,077 |
0,109 |
0,201 |
3,8.10-3 |
V praxi je pro stanovení dávky
od radionuklidových zářičů potřeba brát v úvahu efekty absorbce
záření v samotném zdroji či jeho obalu, jakož i v
prostředí mezi zdrojem a měřeným místem - výsledná dávka
bude nižší : I = G . A/4pr2 . e-m.r, kde m je lineární
absorpční koeficient látkového prostředí.
Energie fotonového
záření ® radiační dávka
Energie dopadajících fotonů gama nebo X je určující pro
způsoby interakce s látkou (§1.6, část
"Interakce záření
gama a X") a tím i pro obdrženou radiační dávku, která je
způsobena především absorbovanou energií sekundárních
elektronů. Fotonové záření vyšších energií má
sice nižší absobční koeficient (lineární součinitel
zeslabení), avšak pokud dojde k absobci, je předaná energie -
dávka - vyšší. Celkový trend je: vyšší energie
fotonového záření vede k vyšší radiační dávce.
Týká se to i výsledného radiobiologického účinku.
První vyražené elektrony mohou být vysokoenergetické, avšak
dalšími a dalšími elektronovými interakcemi se rozrůstají
ve spršku nakonec nízkoenergetických elektronů. Tvrdší
záření gama tedy produkuje i větší počet elektronů
nízkých energií, které mají vyšší LET a "více
času" na tvorbu radikálů ® vyšší
radiobiologická účinnost.
Vnitřní distribuce radioaktivity
Do jisté míry protichůdná situace k vnějšímu
"bodovému" uzavřenému radioaktivnímu zářiči je
radioaktivní látka rozptýlená (distribuovaná)
v analyzovaném nebo ozařovaném materiálu, např. v tkáni či
orgánu. Tato situace se (kromě vnitřní
kontaminace - viz níže §5.5, pasáž "Vnitřní
kontaminace")
vyskytuje zejména při diagnostických a terapeutických
aplikacích radioaktivně značených látek - radiofarmak
- do organismu, kde se pak tyto radioaktivní látky vychytávají
v jednotlivých tkáních a orgánech, podle své farmakokinetiky;
je podrobně diskutováno v §4.8 "Radionuklidy a radiofarmaka pro
scintigrafii" a §3.6,
část "Biologicky
cílená radoisotopová terapie otevřenými beta a alfa
radionuklidy").
V takovém případě kvanta ionizujícího
záření okamžitě a bezprostředně interagují
s látkou ihned pro svém vyzáření radioaktivním atomem. Na
radiační dávce se v zásadě podílejí všechna emitovaná
kvanta a částice (s výjimkou neutrin) - elektrony a pozitrony,
Augerovy elektrony, fotony gama a X, alfa částice, příp. i
odražená dceřinná jádra (§1.2,
pasáž "Zpětný odraz jader").
Nabité částice, a či b, mají krátký dolet a
veškerou svou energii odevzdají poblíž místa svého vzniku.
V případě rovnoměrné distribuce radionuklidu v látce s
měrnou (hmotnostní) aktivitou A' [Bq/kg] bude dávkový
příkon D' v [Gy/s] od záření krátkého doletu
D' = A'.
<E> . 1,6.10-19 ,
kde <E> je střední energie emitovaných částic v
[elektronVoltech] na 1 rozpad (koeficient
1,6.10-19
je přepočítávací faktor mezi jednotkami energie [eV] a [J]).
Např. pro nejčastěji používaný
terapeutický radionuklid 131I (pro terapii štítné žlázy) činí dávka z
vychytané aktivity v ložisku hmotnosti g gramů D =
0,109 Gy . g /MBq .h.
Máme-li tedy v daném okrsku látky hmotnosti m
homogenně distribuovanou radioaktivitu s časovým průběhem
A(t) [Bq],
vznikne tím v tomto okrsku za čas T celková radiační
dávka D0-T [Gy] :
D0-T = 0ňTA(t) dt . <E>.
6.10-19/m
, neboli D0-T = AS0-T . <E>
.6.10-19/m ,
kde AS0-T je celková tzv. kumulovaná
aktivita (zavedená v §5.5,
"Vnitřní kontaminace") ve vyšetřovaném objemu v čase 0 - T. Tyto vztahy
jsou důležité zejméma pro stanovení radiačních dávek v
těle a v nádorových lézích při radionuklidové terapii (§3.6, pasáž "Plánování, monitorování a dozimetrie
radionuklidové terapie",
obr.3.6.11).
Za
předpokladu časového poklesu aktivity distribuovaného
radionuklidu podle obvyklého exponenciálního zákona A(t) = A0.e-(ln2/T1/2ef ).t s efektivním poločasem T1/2ef [s]
*), bude podle této závislosti s časem klesat i dávkový
příkon: D'(t) = A0.e-(ln2/T1/2ef ).t.<E>.1,6.10-19. Celková
radiační dávka D [Gy], způsobovaná v
látce distribuovaným radionuklidem, pak bude dána časovým
integrálem od 0 do Ą: D = 0ňĄ[A0.e-(ln2/T1/2ef ).t.<E>.
1,6.10-19]
dt , což dává výsledek :
D = A0. (T1/2ef /ln2)
. <E> . 1,6.10-19 .
*) Efektivní poločas
poklesu T1/2ef aktivity radioaktivní látky je dán fyzikálním poločasem
rozpadu T1/2fyz příslušného radionuklidu a v případě organismu i
biologickým poločasem T1/2biol exkrece radioaktivní látky z dané tkáně: T1/2ef = (T1/2fyz.T1/2biol)/(T1/2fyz + T1/2biol).
Pro kinetiku radionuklidů v tkáních a orgánech bývá
zpravidla dominantní biologický poločas exkrece, který je
většinou podstatně kratší než poločas rozpadu použitého
radionuklidu.
Pokud radioaktivní látka emituje i
vysokoenergetické pronikavé záření gama, které uniká z
analyzovaného objemu s distribuovanou radioaktivitou, jakož i v
případě nerovnoměrné distribuce radioaktivní látky, či
její nepravidelné časové dynamiky, je situace složitější
a radiační dávky se stanovují metodou MIRD (§5.5, část "Vnitřní kontaminace").
Stanovení
radiační dávky z radionuklidů distribuovaných v organismu,
tkáních a orgánech, je důležité jednak pro stanovení radiační
zátěže z diagnostických aplikací radiofarmak při
scintigrafii, hlavně pak při terapeutických
aplikacích otevřených radionuklidů (§3.6, část "Radioisotopová terapie").
Radiobiologická
účinnnost záření. Dávkový ekvivalent, efektivní dávka
Základní dozimetrická veličina
- absorbovaná dávka - v sobě nezahrnuje okamžité lokální
rozložení energie přenesené na
látku, které může výrazně ovlivnit konkrétní procesy
fyzikálních, chemických a zvláště pak biologických
účinků ionizujícího záření. Proto se zavádí další
veličina, která popisuje míru ztrát energie podél dráhy
částice v látce, a tím také míru brzdění částice a hustotu
vytvářených iontů podél dráhy:
Lineární přenos
energie LET (Linear Energy
Transfer)
představuje střední energii lokálně předanou látce
prolétající částicí, vztaženou na jednotkovou
dráhu částice:
L = DE / Dx ,
kde DE je energie odevzdaná elektronům a iontům
nabitou částicí při jejím průchodu po dráze Dx.
Základní jednotkou lineárního přenosu energie by
sice byl 1J/1m [J.m-1], v praxi se však používá keV/mikrometr (1
keVmm-1= 1,602.10-10 J.m-1). Má-li záření krátký dosah (záření
alfa), je absorbovaná energie rozložena podél krátké
dráhy, lineární přenos energie je vysoký, takže
ionty jsou podél dráhy částice rozloženy velmi
hustě. Někdy se zavádí i veličina lineární
ionizace, což je počet iontových párů
vztažený na jednotkovou dráhu částice (např. na
mikrometr délky dráhy).
Čím vyšší je
koncentrace iontů podél dráhy částice, tím menší
je pravděpodobnost jejich opětné rekombinace
předtím, než budou interagovat s okolními molekulami
v ozařované látce - tím výraznější bude chemický
účinek ozáření, pro živou tkáň pak
účinek radiobiologický: vyšší
koncentrace iontů a následně volných radikálů
způsobuje těžší a hůře opravitelná poškození v
DNA (jak bude níže podrobně
diskutováno). Jelikož LET
popisuje lokální distribuci ionizace na mikroskopické
úrovni, je tato veličina důležitá i pro analýzu
radiačních účinků na subcelulární a
molekulární úrovni - v mikrodozimetrii.
Z hlediska biologických
účinků ionizujícího záření na ozařovanou látku
(popsaných níže) se tedy záření dělí podle hustoty
ionizace, kterou v látce při svém průchodu
vyvolává:
¨
Záření řídce ionizující - záření X, gama,
beta. U beta-částic typických energií stovky keV je LET cca
0,2 keV/mikrometr. Při průchodu vodou nebo tkání vytváří
asi 100 iontových párů/1 mikrometr.
¨
Záření hustě ionizující - záření alfa,
neutronové záření, protonové záření *). U alfa částic o
energiích 4-8MeV činí LET v tkáni cca 100keV/mikrometr, ke
konci dráhy v Braggově maximu se může lokálně zvyšovat až
na 300keV/mm. Vytváří až 2000 iontových párů/1 mikrometr
tkáně. Hustě ionizující záření má "více
času" na tvorbu radikálů - vyšší
radiobiologickou účinnost.
*) Toto platí pro nízkoenergetické
záření, do zhruba desítek MeV. Vysokoenergetické (cca
100MeV) protonové záření, jakož i a či těžké ionty, je
však po většinu své dráhy v látkách řídce
ionizující. Teprve na konci dráhy, v oblasti Braggova
píku, je hustota ionizace vysoká - viz obr.1.6.1 v
§1.6 "Ionizující záření".
Jelikož
biologická účinnost různých druhů záření se může
značně lišit (v závislosti právě na hustotě ionizace), pro
účely radiobiologie a radiační ochrany se pro každý druh
záření zavádí tzv. jakostní faktor Q *),
který udává, kolikrát je daný druh záření biologicky
účinnější než záření fotonové - X nebo gama (za základ se bere rentgenové záření o energii
200keV).
*) Nazývaný též "radiační
váhový faktor" wR nebo v
radioterapii "relativní biologická účinnost"
RBE (Relative Biological Effectivenes).
Hodnota tohoto empirického jakostního
faktoru Q závisí na druhu a energii záření.
Pro záření X, gama a beta je jakostní faktor Q=1,
pro neutrony Q » 2-5
(pomalé neutrony s energií do 10keV, nebo zase pro velmi
rychlé neutrony s energií >20MeV), 10-20
(rychlé neutrony 100keV-20MeV), pro protony Q»5,
pro záření alfa je dokonce Q » 20
(stejně jako pro těžká jádra a
štěpné produkty).
Pro objektivnější posouzení účinku záření
se s pomocí jakostního faktoru Q v oblasti radiobiologie a
radiační ochrany zavádí "korigovaná" dávková
veličina, která již zohledňuje i rozdílnou biologickou
účinnost jednotlivých druhů záření:
Dávkový
ekvivalent (ekvivalentní dávka) v uvažované
tkáni je dán součinem absorbované dávky D v daném
místě a jakostního faktoru Q:
H = Q . D .
Jednotkou dávkového ekvivalentu je 1 Sievert
[Sv] *). Dávka 1 Sv jakéhokoli záření má stejné biologické
účinky jako dávka 1 Gy rentgenového nebo gama záření (pro které
je jakostní faktor stanoven 1). Dávkový ekvivalent je biofyzikální
dozimetrická veličina, která kombinuje
fyzikální veličinu radiační dávka s daným
druhem záření a empiricky stanovenou mírou
jeho vlivu na živou tkáň - v porovnání s
fotonovým zářením.
*) Jednotka byla nazvána na
počest švédského radiologa R.M.Sieverta, který v
letech 1920-40 zkoumal vliv ionizujícího záření na
živou tkáň, položil základy radiační ochrany a
léčebného využití záření. Starší jednotku
ekvivalentní dávky byl 1 rem = 10-2 Sv (zkratka rentgen
equivalent man -
ekvivalent biologického poškození lidské tkáně).
Tato jednotka pochází z 50.-60.let, kdy se pro
radiační expozici používala výše zmíněná
jednotka Rentgen. Vztah mezi "R" a
"REM" je rovněž pomocí jakostního faktoru
záření Q.
Stejně jako u
dávky, i zde se zavádí ekvivalentní dávkový
příkon (příkon dávkového ekvivalentu),
jakožto přírustek dávkového ekvivalentu za jednotku
času - jednotka je Sievert za sekundu [Sv.s-1].
K radiačnímu monitorování osob se
používá osobní dávkový ekvivalent
Hp(d),
což je dávkový ekvivalent v daném místě pod
povrchem těla v hloubce d
v měkké tkáni. Získává se přepočtem dávky na
dozimetru pomocí jakostního faktoru Q a absorbce v
tkáni podle energie záření.
Různé tkáně a orgány v těle jsou různě
citlivé k záření a jejich radiační poškození
vede k různě závažným následkům pro celý organismus. Pro
každý orgán a tkáň se na základě statistických analýz
empiricky zavádějí vlastní koeficienty rizika
vzniku poškození zářením. Pomocí těchto koeficientů pak
můžeme stanovit - odhadnout - riziko poškození organismu,
vyplývající z expozice ionizujícím zářením. Pro účely
radiační ochrany se proto zavádí veličina:
- Efektivní dávka Def - součet
vážených středních hodnot ekvivalentních dávek v
tkáních či orgánech lidského těla:
Def = S wT . HT ,
kde HT je ekvivalentní dávka v dané tkáni T, wT je tkáňový
váhový faktor. Sčítá se přes všechny uvažované
tkáně T. Tkáňový (orgánový)
váhový faktor wT vyjadřuje relativní příspěvek daného
orgánu nebo tkáně T k celkové zdravotní
újmě způsobené rovnoměrným ozářením těla; je
normován tak, aby se součet všech váhových faktorů
rovnal 1 (SwT = 1). Hodnoty tkáňových váhových faktorů
jsou uvedeny v příslušných tabulkách, např. (podle doporučení IRCP 103):
| Tkáň (orgán) |
kostní dřeň |
střevo |
plíce |
žaludek |
gonády |
močový
měchýř |
játra |
jícen |
štítná
žláza |
kůže |
kosti |
mozek |
S -ostatní |
| wT
|
0,12 |
0,12 |
0,12 |
0,12 |
0,077 |
0,04 |
0,04 |
0,04 |
0,04 |
0,01 |
0,01 |
0,01 |
0,12 |
Efektivní dávka Def se tedy vypočte
pomocí příspěvků ekvivalentních
orgánových dávek HT všech jednotlivých ozářených tkání: při
sčítání se každá orgánová ekvivalentní dávka HT vynásobí svým
tkáňovým váhovým faktorem wT, který vyjadřuje příspěvek poškození právě
toho konkrétního orgánu nebo tkáně k poškození celého
těla, vyvolaného účinky rovnoměrného celotělového
ozáření. Pomocí efektivní dávkyHE lze tak převést účinky ozáření jakékoli
tkáně, orgánu nebo části těla na srovnatelné účinky,
vzniklé rovnoměrným ozářením celého těla. Výhodou
efektivní dávky je, že umožňuje vyjádřit
radiační zátěž jediným číslem (jednotkou je zase
Sievert [Sv]) i při nerovnoměrném ozáření, či ozáření
jen určitých orgánů, jako kdyby se jednalo o radiační
zátěž při rovnoměrném ozáření. To umožňuje porovnávat
radiační zátěže osob z nejrůznějších zdrojů -
např. z přírodního záření, rentgenových vyšetření, či
z různých druhů radiofarmak v nukleární medicíně. Všechna
tato hodnocení se vztahují na stochastické
účinky záření - a jsou to jen velmi přibližné "kvalifikované
odhady", často hypotetického charakteru,
zvláště v oblasti nízkých dávek kolem 0,1Gy (je diskutováno níže v pasáži "Problematika
velmi nízkých dávek - jsou škodlivé či prospěšné?")...
Efektivní
dávka Def je tedy veličina, která hodnotí míru
zdravotního rizika, které pro člověka plyne ze
záření, kterému byl vystaven. Jedná se o empirickou biofyzikální
veličinu, která není přímo měřitelná
- získává se z naměřené radiační dávky daného druhu
záření započtením biologických účinků tohoto záření a
citlivosti jednotlivých zasažených tkání a orgánů.
Zohledňuje se skutečnost, že různé druhy záření mají
různou biologickou účinnost a že různé tkáně a orgány
jsou různě citlivé, přičemž jejich poškození má různé
zdravotní důsledky pro organismus. Je třeba si však
uvědomit, že koncept efektivní dávky je jen velmi hrubým a
zjednodušeným zprůměrovaným odhadem složitých a
individuálně závislých procesů biologických účinků
záření v organismech. Má charakter "kvalifikovaného
odhadu" radiačních dávek s řadou
neurčitostí a nepřesností řádu desítek %
!
Pravděpodobnost
vzniku biologických stochastických účinků je úměrná absorbované
radiační dávce [mGy] a velikosti
ozářené oblasti [cm3]. V planární rtg diagnostice se toto kvantifikuje
veličinou DAP (Dose Area Product)
[mGy.cm2],
což je součin absorbované dávky D a plochy S
ozářené oblasti: DLP = D . S. V rtg CT diagnostice se to
kvantifikuje veličinou DLP (Dose Lenght
Product) [mGy.cm], což je součin absorbované dávky D
a délky L ozářené oblasti: DLP = D . L. Efektivní
dávka Def [mSv] pro pacienta, vyjadřující účinky záření
na organismus jako celek, se pak vypočítá jako součin: Def = EDAP . DAP, nebo Def = EDLP . DLP , kde
koeficienty EDAP či EDLP v sobě zahrnují zprůměrované tkáňové
(orgánové) váhové faktory wT pro struktury v ozařované oblasti (§5.7 "Radiační zátěž při radiační diagnostice a
terapii").
Pro posouzení dlouhodobých účinků
záření z vnitřní kontaminace radioaktivní látkou – radiotoxicity
- se dále zavádí tzv. dávkový úvazek, což je úhrnná absorbovaná dávka
ionizujícího záření, kterou způsobí v organismu,
v určitém orgánu nebo tkáni, daná radioaktivní látka za
dobu 50 let od jejího příjmu do organismu. Radiotoxicita je
závislá nejen na fyzikálních parametrech radionuklidu
(poločas rozpadu, druh a energie záření), ale i na
chemických vlastnostech kontaminantu, které určují jeho
metabolismus, distribuci do jednotlivých orgánů, biologický poločas, způsob
vylučování (viz níže §5.5, část "Vnitřní
kontaminace") - rezidenční
dobu setrvání radioaktivní
látky v tkáních a orgánech.
Pro hodnocení ozáření vybraných
skupin lidí, či populace, se někdy používá kolektivní ekvivalentní či efektivní dávka, což
je součet příslušných dávek všech jednotlivců v dané
skupině. Tyto údaje mohou sloužit k demografickým
radiohygienickým analýzám a k optimalizaci radiační ochrany.
Fyzikální a
biofyzikální dozimetrické veličiny
Je třeba upozornit na rozdílnou povahu jednotlivých
dozimetrických veličin. Dávka, kerma, expozice, lineární
přenos energie a některé další jsou fyzikální
dozimetrické veličiny,
které mohou být (aspoň v principu) stanoveny na základě
čistě fyzikálních měření. Popisují objektivní
míru fyzikálního (a příp.
indukovaně chemického) působení záření na látky. Lze je
využít nejen v biologických, ale i v různých jiných
technologických aplikacích záření, kde determinují míru
požadovaných (nebo nežádoucích) účinků záření na daný
materiál či proces. Oblast biologických a medicínských
aplikací je dominantní oblastí používání všech dozimetrických
veličin.
Dávkový
ekvivalent a efektivní dávka (a další z nich odvozené
veličiny) jsou však biofyzikální dozimetrické veličiny, určené pro
radiobiologii a radiační ochranu - ze základních fyzikálních veličin
vznikají přepočtem pomocí empirických
fyzikálně-biologických koeficientů - jakostního faktoru Q a tkáňových
váhových faktorů wT. Nejsou přímo měřitelné.
Přibližné hodnoty přepočítávacích koeficientů byly
stanoveny pomocí radiobiologických experimentů a na základě výsledků randomizovaných
klinických studií. Je třeba
dále rozlišovat, které veličiny se vztahují na stochastické
a deterministické radiační účinky.
Metody dozimetrického
stanovení radiačních dávek
Dávky ionizujícího záření se stanovují fyzikálními
metodami podrobně popsanými v Kapitole 2 "Detekce
a spektrometrie ionizujícího záření".
Používají se dozimetry, což jsou jednoduché
radiometry - ionizační komory, GM detektory, scintilační
detektory, filmové dozimetry, termoluminiscenční a OSL
dozimetry - kalibrované v dozimetrických
veličinách: radiační dávka [mGy] či [mSv], dávkový
příkon [mGy/s] či [mSv/s]. Pomocí dozimetrů se provádějí
fyzikální měření (často s použitím fantomů
modelujících tkáňové prostředí a geometrickou konfiguraci
ozáření), monitorování pracovníků a
pacientů (osobní dozimetrie "in
vivo"), radiační monitorování
pracovního a životního prostředí.
Biodozimetrie
Někdy nastávají situace, kdy dojde k radiační expozici
(příp.je podezření na expozici), aniž by příslušné osoby
byly dozimetricky monitorovány - jedná se o ozáření neznámou
dávkou. Když fyzikální dozimetrie chybí, nastupuje
možnost retrospektivního určení dávky
(resp. jejího odhadu) sledováním změn některých
biologických parametrů. Biologická dozimetrie či biodozimetrie
je radiobiologická metoda, která pomáhá určit velikost
absorbované dávky podle druhu a intenzity postradiační
odpovědi organismu (tyto radiobiologické účinky jsou
podrobně rozebírány v následujícím §5.2 "Biologické účinky
ionizujícího záření". Pro
rekonstrukci dávek lze použít biologické parametry jako jsou změny
krevního obrazu, výskyt chromozomových
aberací či mikrojader v krvinkách, pozorování
somatických mutací v krvinkách, poškození DNA nebo mRNA,
vzestup koncentrace proteinu p53, ATM-kináza, ....... Jelikož
adekvátní léčbu je potřeba zahájit již v 1.-2.dnu po
ozáření, je žádoucí použít expresní biochemickou
analýzu (statim), jako je metoda ELISA nebo RT-PCR.
.................
5.2.
Biologické účinky ionizujícího záření
Jak bylo již výše uvedeno,
primárním působením ionizujícího záření na látku je
interakce kvant (elektromagnetických nebo
korpuskulárních) tohoto záření s
elektronovým obalem atomů, ojediněle i s atomovými jádry.
Důsledkem je excitace a ionizace atomů, která
může vést k fyzikálním změnám a k chemickým
reakcím, v případě živé tkáně pak i k biochemickým
změnám. Tyto sekundární účinky pak mohou vést ke
změnám a poškození ozářeného organismu, nebo dokonce k
jeho zániku - smrti. Účinky
záření na živou tkáň a organismy se z biologického a
medicínského hlediska zabývá speciální obor radiobiologie.
Detaily tohoto oboru se zde zabývat nebudeme, leží většinou
mimo rámec našeho fyzikálního pojednání. Zmíníme zde jen
ty poznatky, které jsou důležité z fyzikálního
hlediska, pro aplikace záření v medicíně a biologii
a též z hlediska metod radiační ochrany.
Základními stavebními jednotkami všech
živých tkání jsou buňky. Pro pochopení
biologických účinků ionizujícího záření jsou proto
rozhodující mechanismy působení záření na buněčné
a subcelulární úrovni. A to v návaznosti na
chemické a biochemické účinky ionizujícího záření na molekulární
úrovni. Tyto aspekty si proto rozebereme nejdříve,
následovat bude rozbor radiačních účinků na úrovni
tkání, orgánů a celého organismu.
Pozn.: Tyto
molekulární, buněčné a tkáňové aspekty nelze však vždy
striktně oddělovat, proto se při výkladu budou občas
prolínat.
Buňky
- základní jednotky živých organismů
Všechny živé organismy jsou
tvořeny buňkami *) - drobnými útvary či
"komůrkami" ohraničenými buněčnou stěnou (cytoplasmatická
membrána - lipoproteinová se 2 vrstvami fosfolipidů) a
uvnitř naplněnými viskózním vodním koloidním roztokem
různých chemických látek, především složitých
organických makromolekul. Obor bilogie, studující buňky,
jejich stavbu a funkci, se nazývá cytologie (řec. cytos=dutina).
*) Poprve pozoroval buňky korku již v
r.1665 R.Hooke pomocí jednoduchého mikroskopu, další buňky
pak dokonaleji A.Leeuwenhoek. Název buňka
(lat. cellula; cella=komora)
vznikl z podobnosti s buňkami v plástvích včelího medu. O
vznik nauky o buňkách - cytologie - se
významně zasloužil i J.E.Purkyně. Teprve objev buněk
a postupné poznávání složitých biochemických
reakcí, probíhajících v buňkách na molekulární
úrovni, přeměnilo koncem 19. a ve 20. stol. biologii a
medicínu z popisné empirické nauky (popis druhů,
"počítání okvětních lístků a tyčinek",
vnější projevy nemocí, s mnohými nepodloženými a chybnými
domněnkami) na skutečnou vědu, umožňující
na jednotném exaktním základě pochopit podstatu a
fungování života, za fyziologických i patologických
situací. Výzkum složitých biochemických pochodů na
subcelulární úrovni bude ještě dlouho pokračovat.
V i r y
Na pomezí mezi živými organismy a neživou
přírodou se nacházejí viry (lat. virus =
jed) - vnitrobuněční cizopasníci mikroskopických
rozměrů cca setiny až desetiny mikrometru. Sestávají z
nukleové kyseliny (DNA nebo RNA), obalené proteinovou
schránkou (kapsidem). Viry obsahují sice nukleové
kyseliny nesoucí ve své sekvenci genetickou informaci, avšak
nejsou schopny samostatného růstu a výroby vlastních
bílkovin, rozmnožování, ani získávání a ukládání
živin a energie - k tomu potřebují "hostitelskou"
buňku. Když virus pronikne do buňky, parazituje na ní,
využívá její živiny a může ji zahubit. Nebo může
zkopírovat svoji genetickou informaci do DNA buňky
(prostřednictvím reverzní transkriptázy - viz
níže) a donutit ("přeprogramovat") tak hostitelskou
buňku pracovat ve prospěch viru. U vyšších organismů jsou
virové infekce původci řady onemocnění.
V
průběhu evoluce se však některé biologické druhy
"naučily" využívat původně parazitické genetické
sekvence od virů pro jiné - prospěšné - funkce, které jim
poskytly evoluční výhody.
Proteiny
- základní stavební a funkční látky buněk
V základní náplni buňky, zvané cytoplasma (řec. cytos=dutina, plasma=výtvor), se
"vznášejí" složitější struktury - organely.
Tekutá část cytoplasmy, což je vodní gel velkých i malých
molekul, se nazývá cytosol. Cytoplasma je tvořena
především koloidním roztokem bílkovin neboli
proteinů (řec. protos=první;
jedná se o biologické látky prvotní důležitosti) -
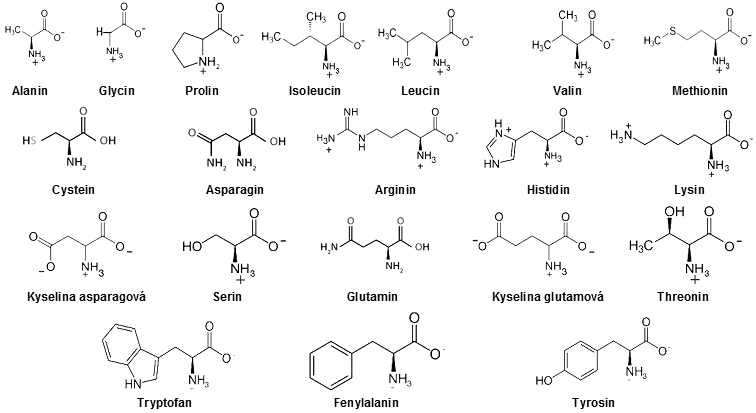
jsou to polypeptidové řetězce lineárních polymerů aminokyselin.
Aminokyseliny jsou molekuly
obsahující karboxylovou skupinu (-COOH) a dusíkatou aminovou
skupinu (-NH2); tyto skupiny a ostatní
atomy (atom vodíku a a postraní řetězec)
jsou navázány na centrálním atomu uklíku.
Aminokyseliny jsou schopny se vzájemně slučovat tzv. peptidovou
vazbou, při které karboxylová skupina jedné
aminokyseliny reaguje s aminovou skupinou druhé aminokyseliny.
Mohou tak vznikat - polymerovat - i značně dlouhé polypepticické
řetězce - proteiny. Z velkého počtu chemicky
existujících aminokyselin se v jich buňkách vyskytuje jen 24
druhů (20 základních, 4 speciální...) :
Karboxylová a aminová skupina, atom vodíku a postraní
řetězec jsou na centrálním (alfa) uhlíku navázány asymetricky
(s výjimkou glycinu) - chirální
asymetrie, což se projevuje schopnosti stáčet rovinu
polarizovaného světla. V závislosti na prostorové orientaci
navázaných skupin na alfa-uhlíku mohou být aminokyseliny levotočivé
"L" nebo pravotočivé
"D" (z lat. Leavus=levý,
Dexter=pravý). Polypeptidické vazby mohou
vznikat jen mezi aminokyselinami stejné chirality, L
či D. V raných fázích prebiotické evoluce náhodně
převážila "levoruká" chiralita aminokyselin a tato
preference se pak evolučně rozšířila na všechny
biochemické procesy. V biochemii tedy figurují pouze levotočivé
alfa-L-aminokyseliny; a přírodní sacharidy jsou zase
D-pravotočivé...
Primární struktura proteinů je dána pořadím
aminokyselin v polypeptidovém řetězci (peptidová
vazba představuje spojení C-N mezi dvěma aminokyselinami,
vedoucí k přítomnosti peptidové skupiny -CONH-).
V proteinech se vyskytuje 20 druhů aminokyselin jak alifatických
(alanin, glycin, leucin, valin, ...), tak aromatických
(s benzénovým jádrem - fenylalanin, tyrosin,
tryptofan, ...), dále kyselých (kys.
asparágová, glutamová), zásaditých (lysin, histidin, arginin), s vázanou sírou
(cystein, methionin) a několik dalších.
Jednotlivé aminokyseliny mají různé biochemické vlastnosti,
takže sekvence aminokyselin v bílkovině
určuje chemické vlastnosti proteinu i jeho prostorovou
strukturu. Lineární polypeptidové řetězce se formují do
prostorové (3D) struktury v důsledku vytváření vodíkových
vazeb mezi skupinami hlavního řetězce proteinu - sekundární
struktura buď pravidelná repetitivní (helikální, ohyb a
skládání vláken), nebo nepravidelná a kompaktní, příp.
složitější spojování různých vláken a sekvencí
(terciální struktura). Některé druhy bílkovin jsou
základními stavebními molekulami buněk,
jiné druhy proteinů svými složitými chemickými reakcemi
vykonávají specifické funkce buněk a tkání
(jak bude níže na řadě míst konkrétně uvedeno). Soubor
proteinů, které jsou v buňce obsažené nebo které dokáže
buňka syntetizovat, vymezuje její schopnost uskutečňovat
různé biochemické reakce - zpracovávání (rozklad a
syntézu) chemických látek, získávání chemické energie,
vytváření stavebních "materiálů" buněk a
dalších částí organismu - určuje tím do značné míry
výsledné vlastnosti buněk a organismů. Systematickým
zkoumáním proteinů - jejich vzniku, struktury, vzájemných
reakcí a funkcí v buňkách a organismech - se zabývá
poměrně nová vědní disciplina zvaná proteomika.
O funkčních vlastnostech některých proteinů je pojednáno
níže v pasáži "Proteiny,
enzymy, kinázy".
Biochemické reakce - základ života
buněk
Chemické reakce probíhající v buňkách jsou řízené a
vysoce organizované, přičemž základní řídící
úlohu hraje složitá molekula DNA (deoxyribonukleová
kyselina, viz níže), která kóduje složení bílkovin -
jejich primární strukturu, pořadí aminokyselin. Buňky mají
schopnost látkové výměny, růstu a vytváření svých
vlastních "kopií" rozdělením jedné buňky ve dvě (o asymetrickém dělení na kmenové a efektorové
buňky viz níže). Nejjednodušší formy života, jednobuněčné
organismy, jsou tvořeny samostatnými buňkami. Vyšší mnohobuněčné
organismy jsou tvořeny společenstvím velkého počtu
buněk, zpravidla diferencovaných, kde různé buňky
vykonávají své různé specifické funkce, koordinované
chemickými regulačními mechanismy a "komunikačními
systémy".
Biochemických reakcí se účastní většinou
značně složité organické molekuly obsahující velký počet
atomů uhlíku, vodíku, kyslíku, dusíku, fosforu a dalších. Molekulová
hmotnost těchto makromolekul se v
biochemii a molekulární biologii vyjadřuje ve speciálních
jednotkách tzv. kilodaltonech (kDa), což je
1000 Daltonů (Da). 1 Dalton odpovídá
1/12 hmotnosti atomu uhlíku, tj. zhruba hmotnosti atomu vodíku,
1Da = 1,66.10-27kg ( J.Dalton byl anglický chemik, žil v letech
1766-1844, významně se zasloužil o poznání zákonitostí
atomů a jejich chemického slučování). Uhlík má tedy
12Da, methan CH4 má hmotnost
16Da, voda má 18Da, glukóza C6H12O6
má 180Da; protein p53 má molekulovou hmotnost 53kDa.
Obtížnost pochopení funkce
živých organismů
Přes veškerý pokrok biochemie a molekulární biologie je
naše porozumění toho, jak fungují živé organismy na molekulární
úrovni, stále značně omezené. Množství,
složitost a vzájemná provázanost biochemických pochodů,
odehrávajících se v živých buňkách, stále vzdoruje našim
možnostem komplexní analýzy a pochopení mechanismů
dynamického chování těchto systémů.
Vedle rozsáhlosti a složitosti se u intracelulárních
systémů uplatňují i stochastické efekty,
způsobené náhodnými pohyby molekul. Některé biochemické
látky jsou totiž v buňkách obsaženy jen ve velmi malých
koncentracích, někdy jen jednotky či desítky molekul. Při
tak malém množství dochází ke srážkám a reakcím těchto
molekul jen poměrně zřídka, a tím se značnými
statistickými fluktuacemi. Takové náhodné (stochastické)
jevy mohou mít nezanedbatelný vliv na dynamiku biochemických
procesů, což se může odrazit i na chování celé buňky.
Prokaryotní
a eukaryotní buňky
Tak složitý fenomén jako je život prošel velmi dlouhým a
komplikovaným vývojem, jehož řadu etap
zatím neznáme (o evoluci žitota viz práci
"Antropický princip aneb kosmický Bůh",
pasáž "Vznik a evoluce
života"). Z
hlediska stavby a vývoje je možno buňky rozdělit na dvě
základní skupiny :
Prokaryotní (řec.
pro=před, karyon=jádro, buňky bez jádra,
"předjaderné"), jejichž DNA cirkulárního
tvaru je obnažena a volně plave v cytoplasmě v útvaru zvaném
nukleotid. Prokaryoty jsou primitivní nejstarší
vývojovou formou buněk, nyní se vyskytují jako bakterie
a sinice. Rozeznáváme dvě skupiny
bakterií: eubakterie, které se vyskytují ve velkém
množství v našem životním prostředí; archebakterie,
žijící v prostředí pro jiné organismy nehostinném (horké
prameny, mořské dno, kyselé či zásadité prostředí).
Rozměry bakterií se pohybují v rozmezí cca 1-10mm. Tyto evolučně velmi staré druhy
buněk tvoří jednobuněčné organismy, nevytvářejí
žádné funkčně diferencované tkáně, mohou se pouze
sdružovat do kolonií.
Eukaryotní (řec.
eu=normální,správný, karyon=jádro - tedy
"pravojaderné"), jejichž DNA (lineární,
spirálového tvaru) je soustředěna především v buněčném jádře,
kde je sdružena s histony v chromosomech, které jsou
vícečetné a obsahují i další chromosomální proteiny.
Enzymy zajišťující respiraci a látkovou výměnu jsou
soustředěny v organelách, kteými jsou zvláště mitochondrie
a lysosomy (viz níže). Tyto buňky mají dále tzv. cytoskelet
- soustavu pružných vláken (tvořených mikrofilamenty
a tenkými dutými trubicemi - mikrotubuly) v
protoplasmě, poskytujících strukturám buněk mechanickou
oporu; zprostředkovávají též intracelulární přesun
složitých molekul mezi jádrem a dalšími organelami (při
dělení buněk pak vytvářejí mitotické vřeténko).
Eukaryotické buňky mají relativně větší rozměry, cca
5-100mm. Vedle jednobuněčných
organismů vytvářejí organizovaná společenství mnohobuněčných
organismů s buňkami funkčně specializovanými do tkání
a orgánů, včetně člověka. V dalším textu budeme
uvažovat pouze buňky eukaryotické, především somatické
buňky začleněné do tkání a orgánů; prokaryotické buňky
budou na několika místech jen krátce zmíněny pro srovnání.
Na obrázku je znázorněno jen velmi zjednodušené schéma
stavby buňky, se zvětšenými výřezy z buněčné stěny
(cytoplasmatické membrány), cykloskeletu (mikrotubulus), jádra
(DNA nesená histonem) a struktury DNA (některé nukleotidy).

Stavba eukaryotické buňky. Ve
zvětšených výřezech jsou schématicky zakresleny detaily
některých struktur.
| Z chemického hlediska je život
velmi složitá soustava molekul, která se umí sama organizovat,
metabolizovat
s využitím chemické vazbové energie, růst,
reprodukovat se
a v delších časových obdobích se i vyvíjet. |
DNA , RNA , proteiny
Veškerý mechanismus organizace života
buněk je založen na spolupracující soustavě nukleových
kyselin DNA (deoxyribonukleová), RNA
(ribonukleová) a proteinů: v DNA je uložena
genetická informace, která se přepisuje do RNA, jež
následně slouží jako matrice pro výrobu proteinů - níže
"Proteosyntéza". Různé druhy proteinů jsou nejen základními
stavebními prvky v buňkách a tkáních, ale jsou i nositeli
funkce buněk a tkání (enzymy).
Nukleové
sloučeniny - etymologie názvů :
Latinsky jádro = nucleus - zde se
jedná o buněčné jádro. Nukleotidy
jsou tedy sloučeniny nacházející se v buněčném jádře. Nukleové
kyseliny jsou pak polymerní sloučeniny
nukleotidů vykazující kyselou chemickou povahu, v praxi
způsobenou navázanou kyselinou fosforečnou. Ribonukleová
kyselina RNA je tvořena řetězci monosacharidu ribózy
vázané přes kyselinu fosforečnou, spolu s dusíkatými
heterocyklickými molekulami cytosinu, uracilu, thyminu, adeninu,
guaninu. Ribóza je 5-uhlíkový cukr pentosa;
název pochází z lat. ribes = meruzalka,
rybíz, či arab. ribas=rebarbora - ve šťávě
těchto rostlin se kromě kyselých složek nachází i cukr ribosa.
V cytoplasmě buněk je velké množství drobných organel
zvaných ribosomy (ribo =
obsahující RNA, some=tělo - tělíska
obsahující RNA). V deoxyribonukleové
kyselině DNA se místo ribosy váže její
derivát deoxyribóza, v níž je jedna
hydroxylová skupina "OH" nahrazena atomem vodíku
"H".
Pozn.
: Tato etymologie
se vztahuje na eukaryotické buňky. Podobné
sloučeniny, i když poněkud jednodušší, se vyskytují i v prokaryotických
buňkách, kde jsou však rozptýleny v cytoplasmě, jádro zde
není.
Deoxyribonukleová
kyselina DNA
- deoxyribonucleic acid (ve
starší české literatuře se občas používala i zkratka DNK); slabou kyselou reakci způsobuje
kyselina fosforečná H3PO4, navázaná v nukleotidech. DNA
je velmi složitá dlouhá makromolekula,
polymer opakujících se sekvencí deoxyribonukleotidů, která
má u eukaryotických buněk tvar dvojité spirály - obr.5.2.2a.
DNA obsahuje cca 100 000 ¸
200 000 000 párů nukleotidů, má molekulovou hmotnost cca 2¸100MDa (megadaltonů) (dolní hranice je pro DNA plastidů, mitochondrií a
prokaryotních buněk, horní hranice pro lidské DNA).
Rozvinutá DNA by měla lineární délku decimetry až metry (u člověka asi 2m..!..); v buňkách je však
velmi kompaktně svinuta v chromosomech délky jen
několika mikrometrů (viz níže).
Z chemického hlediska má DNA polymerní strukturu - je
tvořena řetězcem opakujících se a
vzájemně spojených podobných stavebních jednotek zvaných nukleotidy,
které jsou tvořeny fosfátem H3PO4 (vazebná část kyseliny
fosforečné), deoxyribózou (druh cukru s 5
uhlíky, pentóza - monosacharid 2-deoxy-b-D-ribóza;
odtud název DNA), purinovou a pyrimidinovou bází
(dusíkaté heterocyklické sloučeniny). Nukleotidy se liší
zastoupením 4 různých bazí: adenin A, guanin
(purinová báze) G, cytosin C, thymin
(pyrimidinová báze) T. Tyto čtyři druhy nukleotidů
jsou v DNA uspořádány za sebou v určitém pořadí neboli sekvenci.
Toto jedinečné seskupení nukleotidů v řetězci je podkladem dědičné
informace uložené v DNA - genetického kódu.
Tvoří triplety, z nichž každý kóduje jednu
aminokyselinu. DNA tak obsahuje informaci o struktuře
bílkovin složených z těchto aminokyselin.
Úsek molekuly DNA, který kóduje pořadí
nukleotidů v určité funkční RNA a následně
prostřednictvím mRNA určuje i pořadí aminokyselin v
určitém proteinu se specifickou funkcí,
"vyráběném" buňkou, se nazývá gen
(řec. genos = rod, původ; vloha)
*). Geny tedy předávají
"instrukce" pro tvorbu proteinů - viz níže "Ribonukleová kyselina -
proteosyntéza". Některé geny jsou sice
přepisovány do RNA, avšak nepokračuje to již dále do
proteinů; takto vznikající ribonukleové kyseliny mají
některé regulační funkce. Celkově však u eukaryotních
buněk jen menší část sekvencí DNA kóduje nějaké
(funkční) proteiny. Je to něco přes 20000 genů, což u
člověka představuje jen asi 5% genomu. Většina sekvencí DNA
je jakési "genetické smetí" -
"odpadní" či "zbytečná" DNA (junk
DNA, noncoding DNA), které je reliktem spletité cesty
evoluce (fosilní sekvence -"staré harampádí"). Byly
to často původně "parazitické" geny virového
původu, které se zabudovaly do DNA dávných organismů.
Některé z nich se transformovaly a funkčně zapojily,
většina zůstala nefunkční, jiné mohou potenciálně
ohrožovat organismus (spolupůsobit možná i
při vzniku nádorů..?..). Tato "zbytečná
DNA" se však také v řadě případů přepisuje
do RNA, která je sice (protein)nekódující, ale má regulační
funkce - určuje např. spouštění, zastavení či
intenzitu přepisu kódujících částí DNA. Na odhalování
funkcí jednotlivých genetických sekvencí, včetně
"zbytečných" (junk), je nyní zaměřen
rozsáhlý projekt ENCODE (Encyclopedia
of DNA Code Elements; kromě toho angl. encode=kódovat) zahájený v r.2003.
*) Geny,
genetika
Dědičnost - přenos
některých vlastností živých organismů na potomstvo, mezi
generacemi - byla pozorována odedávna. Někteří biologové
(jako byl J.G.Mendel v 60.letech 19.stol. při několikaletých
pokusech s pěstováním hrachu s různými barvami květů)
empiricky vysledovali některé zákonitosti této dědičnosti,
avšak její skutečná biologická příčina zůstávala
dlouhou dobu neznámá. Teprve rozvoj moklekulární
buněčné biochemie v polovině 20.stol. ukázal, že
podstatou dědičné informace je molekula DNA.
Další strukturní
zvláštností genů u eukaryotických DNA je, že funkčně
kódující sekvence deoxyribonukleotidů - zvané exony
(řec. exo = ven; vnější jednotka),
jsou přerušovány sekvencemi nekódujícími, tzv. introny
(lat. intro = dovnitř; vnitřní
jednotka) bez genetického obsahu, jejichž úloha,
patrně regulační, zatím není zcela objasněna. Krátce po
transkripci do mRNA jsou sekvence intronů
"vystřiženy" (tzv. splicing) a tím
vyloučeny z dalšího procesu genové exprese; následným
spojením kódujících sekvencí (pocházejících z exonů)
vzniká funkční mRNA, umožňující souvislou syntézu
polypeptidových řerězců proteinů při translaci.
Představovat si genetickou informaci pouze
lineárně jako dlouhou řadu nukleotidů - "písmen"
genetického kódu - je zjednodušené a může být
zavádějící; uplatňují se i geometrické dimenze.
Dvoušroubovice DNA je složitě zkroucena a propletena, takže
části DNA, které od sebe dělí dlouhá řada nukleotidů, se
mohou v jádře dostat do těsného sousedství a vzájemně pak
ovlivňovat svou genetickou činnost.
Sekvence nukleotidů DNA jsou při dělení
buňky schopny vytvářet své vlastní přesné kopie,
které tak přenáší genetickou informaci do dalších
generací. Konkrétní forma genu pro učitý znak či vlastnost
organismu se nazývá alela (řec.
allos=jiný), např. gen pro barvu květu. Má-li
daný organismus ve svém genovém páru stejné alely, označuje
se jako homozygot, při rozdílných alelách pak heterozygot.
Struktura DNA
DNA je tvořena dvěma paralelními
řetězci (zvanými též vlákna), spojenými
vodíkovými můstky mezi nukleovými bázemi do jakéhosi
"žebříčku", který se stáčí do dvoušroubovice.
Oba řetězce jsou navzájem komplementární, jejich
baze jsou přesně spárovány vodíkovými můstky. Sekvence
nukleotidů na jednom vlákně je plně určená sekvencí na
druhém vlákně (dvojice "pozitiv-negativ"). Tyto
vodíkové vazby mezi komplementárními bazemi způsobují, že
dvojřetězcová DNA je, navzdory své složitosti, velmi stabilní
makromolekulou. Vzájemně se párují vždy jen dvě
dvojice nukleotidů: C«G, A«T
(Watsonovo-Circkovo párování); tyto páry bazí vytvářejí jakési "stupínky
žebříku" DNA.
Odhalení struktury
DNA
Strukturu molekul DNA nemůžeme přímo pozorovat, vzhledem k
velmi malým příčným rozměrům a kompaktifikaci délkových
rozměrů. Pod mikroskopem pozorujeme jen prakticky
bezstrukturní chromosomy. Sestavení struktury DNA napomohla rengenová
difrakční krystalografie (je podrobněji popsaná v
§3.3, pasáž "Rentgenová difrakční analýza
struktury krystalových mřížek"). Podařilo
se vypěstovat drobné monokrystalky DNA, které
při ozáření X-zářením jej difrakčně odrazily, čímž na
fotografickém médiu vznikly interferenční obrazce,
které umožnily zjistit rozmístění atomů v
molekule. Tým výzkumníků R.Franklinová, R.Gosling, F.Crick a
J.Watson v Laboratoři molekulární biologie MRC v Cambridgi
r.1953 dokončili analýzu struktury DNA a Crick a Watson
vytvořili její model, který velmi úspěšně
dosud vysvětluje všechny buněčně-genetické procesy.
Tato struktura umožňuje replikaci:
ke každému z řetězců je možno utvořit řetězec nový,
zcela totožný s původním. Při replikaci se obě vlákna DNA
od sebe oddalují a na každém z nich se postupně - nukleotid
po nukleotidu - doplňuje nové druhé vlákno. Každá ze dvou
takto nově vzniklých molekul DNA má jeden řetězec z
původní molekuly a druhý nově syntetizovaný. Při
buněčném dělení je tak DNA schopna přesně reprodukovat
samu sebe a přenášet tím genetickou informaci na
další generace buněk. Replikace je velmi přesný proces, do
něhož jsou zabudovány kontrolní a opravné mechanismy.
Pokaždé, když do nově vznikajícího řetězce DNA je
přidáván nový nukleotid, se kontroluje správné spárování
nukleotidu předcházejícího; pokud není párování v
pořádku, reparační enzymy chybný nukleotid okamžitě
odstraní a nahradí správným. Dále probíhá kontrola
správného párování bazí mezi původním řetězcem DNA a
nově syntetizovaným vláknem, přičemž chybně spárovaný
nukleotid na novém vlákně se nahradí správným. Zásluhou
těchto průběžných oprav je výsledná chybovost replikace
pouze ~10-9! Mnohem častěji,
než k chybě při replikaci, dochází k poškození nukleotidů
a genetické sekvence DNA vnějšími vlivy - ionizujícím
zářením a reaktivními chemickými látkami (genotoxické účinky podrobně rozebírané
níže). O dělení
buněk a buněčném cyklu je pojednáno níže v části "Účinek
záření na buňky",
pasáž "Radiační účinky během buněčného cyklu".
Telomery
Obě koncové části DNA eukaryotických buněk jsou opatřeny
tzv. telomery (řec.
telos=konec, meros=část) - okrajovými
"zakončovacími" komplexy opakujících se sekvencí,
které chrání konce chromosomů před
nežádoucími chemickými vazbami *), jakož i před
"falešným" vyhodnocením koncové části jako zlomu
DNA (a nastartování reparačních mechanismů či apoptózy -
viz níže). Telomery mají neměnnou strukturu opakujících se
sekvencí, velmi podobnou u různých biologických druhů. U
lidských a většiny dalších eukaryotických buněk je to
krátká hexanukleotidová sekvence [TTAGGG]n o počtu
až n=2000 opakování.
*) Lze to přirovnat ke kovovému nebo plastovému
vystužujícímu zakončení šňůrek od bot, které je chrání
proti roztřepení.
Na telomerech je navázán
složitý nukleonproteinový komplex se specifickou funkcí.
Jedním z prozkoumaných proteinů tohoto druhu je TRF1 (Telomeric
Repeat-binding Factor 1), který se váže na konce telomer
a zabraňuje telomeráze (viz níže) v její činnosti
dosyntetizovat zkracující se konce telomer. Existuje však
enzym tankyráza, která odstraňuje protein TRF1 a
napomáhá tak telomeráze v její činnosti.
Při
většině běžných replikací však nedochází k úplné
syntéze konců DNA obsahujících telomery - dochází ke zkracování
telomerů. Enzym DNA polymeráza, která replikuje
sekvenci DNA, ji totiž není schopna zkopírovat až úplně na
koncové úseky. Při každém mitotickém dělení buňky se
délka telomerů zkracuje o cca 50-150 bází, což vede k
postupnému snižování ochrany konců DNA; nakonec to vyústí
ve ztrátu mitotické schopnosti buněk. Při přílišném
zkrácení již telomery nechrání dostatečně konce
chromozomů, což buněčné kontrolní mechanismy vyhodnotí a
zastaví buněčný cyklus (takové buňky zůstávají v G1
fázi buněčného cyklu nebo podlehnou apoptóze).
Mitotické zkracování
telomerů u DNA je hlavním mechanismem procesu
"stárnutí" buněk, zvaného senescence *) - viz též níže "Zánik - smrt -
buněk". Zkracování telomerů funguje jako "mitotické
počítadlo" - eukaryotické buňky mohou dosáhnout jen
určité hranice v počtu svých dělení, tzv. Hayflickův
limit (cca 50-80 cyklů); pak již schopnost
dělení ztrácejí, dochází k replikativnímu
stárnutí (senescenci) buněk. Prokaryotické buňky,
které mají kruhově uspořádanou DNA bez telomerů, se však
mohou dělit neomezeně.
*) Stárnutí buněk je patrně multifaktoriální
proces, zahrnující jak nitrobuněčné "programové"
molekulární mechanismy, tak i časově se kumulující
exogenní škodlivé faktory ovlivňující životaschopnost
buněk. Uplatňuje se progresívní poškozování buněk
reaktivními formami kyslíku a dusíku (radikály) v průběhu
metabolismu a života tkání, při stále se snižující
kapacitě antioxidačních mechanismů.
Pozn.: Občas se
vyskytují spekulace o evolučním významu
zkracování telomerů, replikativního stárnutí a zániku
organismů: že tento proces zabraňuje nadměrnému zaplnění
omezeného životního prostoru dlouhožijícími organismy, což
by zpomalovalo evoluci. Tato hypotéza je však poněkud
diskutabilní se dvou důvodů. Jednak replikační zkracování
telomerů je jen jedním z mechanismů senescence, hlavně však
životní prostředí bylo již předtím (a je dosud) zaplněno
obrovským množstvím prokaryotních organismů s kruhově
uspořádanou DNA bez telomerů, kde se tento efekt neuplatňuje;
a přesto evoluce eukaryot úspěšně pokračovala... V
mezidruhovém soutěžení a evoluci eukaryot to však určitý
význam může mít..?..
Existuje však speciální
enzym zvaný telomeráza (je
to komplex složený z RNA a proteinů: RNA matrice slouží jako
předloha pro syntézu sekvencí telomeru u DNA, reverzní
transkriptáza uskutečňuje přepis z RNA do DNA), který je schopen dosyntetizovat
koncové sekvence telomerů a zabránit tak jejich zkracování
při dělení buněk. Pro úspěšné fungování telomerázy je
potřeba enzym tankyráza *), která způsobuje inhibici
proteinu TRF1, navázaného na telomery ("synergické"
působení telomerázy a tankyrázy). Takové buňky jsou pak
schopné neomezeného dělení (immortilizace
- "nesmrtelnost" buněk), což fyziologicky probíhá
pouze v raných stádiích vývoje organismu v dělících se embryonálních
buňkách a potom jen v nediferencovaných kmenových
buňkách; patologicky se uplatňuje u buněk nádorových
(§3.6 "Radioterapie", pasáž "Kancerogeneze").
*) Na telomerech je navázán složitý
nukleonproteinový komplex se specifickou funkcí. Jedním z
prozkoumaných proteinů tohoto druhu je TRF1 (Telomeric
Repeat-binding Factor 1), který se váže na konce telomer
a zabraňuje telomeráze (viz níže) v její činnosti
dosyntetizovat zkracující se konce telomer. Existuje však
enzym tankyráza, která odstraňuje protein TRF1 a
napomáhá tak telomeráze v její činnosti.
Některé nové experimenty však ukazují, že
působení telomerázy není jediným mechanismem obnovy
telomerů DNA. Alternativním způsobem "ošetření"
telomerů může být na telomeráze nezávislá
inter-telomerická homologní rekombinace (viz níže "Reparační procesy"), která může vést k
prodloužení úseků telomer, někdy i na několikanásobek.
Tento způsob se pozoruje u některých rostlin a je možná z
evolučního hlediska starší než telomeráza. Byly pozorovány
i uzavřené struktury, jakési "telomerové smyčky"
na koncích DNA, které se mohou replikovat či prodlužovat (mechanismy jakési "valivé kružnice"). Somatické efektorové buňky,
vykonávající specializovanou činnost v tkáních a orgánech,
ztrácejí schopnost neomezeného dělení a po dosažení
Hayflickova limitu se již dále nedělí.
Pozn.:
K mitotickému zkracování telomerů dochází pouze u
eukaryotických buněk s lineárně uspořádanou DNA, kde
polymeráza není schopna zajistit úplnou replikaci koncových
částí. U prokaryotických buněk (bakterií) s kruhově
uspořádanou DNA bez telomerů se limit v počtu dělení
neuplatňuje.
Chromosomy
V eukaryotických buňkách se
nachází DNA dvou druhů: jaderná a mitochondriální
(ta je zmíněná níže v pasáži o mitochondriích). Jaderná
DNA je lokalizována v buněčném jádře v chromosomech
(řec. chromos = barva, soma = tělo) - specifických
strukturách délky cca 2-5mm, po obarvení (klasickými barvivy
Giemsa-Romanowského, nebo fluorescenčními barvivy)
pozorovaných v optickém mikroskopu. Chromozomy jsou složeny z
bílkovinových nosičů, tzv. histonů (jsou to malé
bazické nukleoproteiny s vysokým obsahem kladně nabitých
aminokyselin, vytvářejících komplexy s DNA), kolem nichž je
"omotána" molekula DNA. Chromozomy v buňkách jsou
uspořádány v sadách, přičemž počet chromozomů v
jedné sadě (tzv. monoploidní číslo x) je za
normálních okolností stejný pro každou buňku v určitém
organismu; u člověka je to x=23 chromozomů. Počet
homologních sad chromozomů v buňce, tzv. ploidie, je
u různých druhů organismů odlišná. U člověka je většina
buněk diploidní (2 sady chromozomů, 23 od matky a 23
od otce), pohlavní buňky jsou však haploidní (jen
jedna sada 23 chromozomů). Vyšší počet chromozomových sad
než 2 se označuje jako polyploidie (triploidie-3,
tetraploidie-4, hexaploidie-6, ...); vyskytuje se často u
rostlin, sehrála pravděpodobně důležitou úlohu při
evoluci. Další anomálií je tzv. aneuploidie, kdy
určitý konkrétní chromozom může být znásoben 3× či 4×,
nebo naopak zredukován - 1×, či zcela ztracen. Anomálie v
počtu či struktuře chromosomů, tzv. chromosomové aberace,
vznikají jako důsledek poruch v mitóze a při poškození DNA
(viz níže).
Ribonukleová kyselina RNA
Další důležitou
"informační" makromolekulou v buňkách je ribonukleová
kyselina RNA. Je poněkud jednodušší než DNA, s
níž je v mnoha ohledech podobná: RNA je též
tvořena cukro-fosfátovým polynukleotidovým řetězcem,
který však místo deoxyribózy obsahuje monosacharid ribózu.
Od DNA se RNA dále odlišuje tím, že místo thymidinu
T se vyskytuje pyrimidinová báze uracyl
U (podobně jako thymin, tvoří uracyl komplementární
pár U-A s adeninem). Ostatní baze adenin, guanin, cytosin, jsou
v obou nukleových kyselinách stejné.
Vznik života. "Svět
RNA"?
Z hlediska genetické informace v nynějších buňkách hraje
RNA "pomocnou" úlohu, i když nezbytnou (viz níže).
Evoluční biologie však dospěla k názoru, že prvotní život
byl pravděpodobně založen na RNA ("svět
RNA"), jejíž první jednodušší molekuly mohly
vznikat spontánně z prebiotických molekul. Prvotní
předchůdci nynějších buněk - protobuňky - byly
patrně jen jakési "chomáčky" molekul ribozy,
zpolymerovaných do krátkých úseků RNA, obalené spolu s
vodou do jednoduché fosfolipidové membrány. Za vhodných
podmínek jsou molekuly RNA schopné vytvářet kopie sebe
samých a tak se "množit". Těmto procesům mohly
napomáhat peptidy ("RNA-peptidový svět").
Vhodné kombinace peptidů mohou vytvářet enzymy, které
katalyzují kopírování RNA.
Replikující se molekuly RNA kódovaly vlastnosti, které se
"geneticky" předávaly vždy následující generaci. Mutace,
k nimž náhodně docházelo při "kopírování",
vedly ke změnám, z nichž ty "pozitivní"
umožňovaly těmto raným buňkám přizpůsobit se lépe okolí
a přírodním výběrem tak navzájem soutěžit (Darwinovská
evoluce). Teprve později se vhodnou kombinací molekul RNA
vyvinula DNA, která se díky své větší
chemické stabilitě ujala role primární genetické
molekuly pro dlouhodobé uchovávání genetické
informace po celý život organismu a pro přenos do
dalších generací. RNA začala fungovat jako "most"
mezi DNA a proteiny (viz níže "Přenos informace -
proteosyntéza"). Obrazně lze říci, že
"žezlo" uchovávání genetické informace předala
RNA své duplicitní "sestře" DNA a pro sebe si
nechala roli "prostředníka" (mRNA). Tak nejdříve
vznikly prokaryotní buňky (bez jádra a bez organel) s
cyklicky uspořádanou DNA; později se vyvinuly složitější eukaryotní
buňky s lineárně uspořádanou DNA ve tvaru dvojité
šroubovnice umístěnou v jádře a s řadou organel plnících
specifické funkce metabolismu buněk.
Z hlediska evoluční biologie jsou
otázky vzniku života, jeho evoluce a dizertifikace
diskutovány v části "Vznik a evoluce života" práce "Antropický princip aneb
kosmický Bůh".
Přenos
informace - proteosyntéza
Základním procesem, při němž se informace obsažená v DNA
převádí do konkrétní struktury nebo funkce, je syntéza
bílkovin neboli proteosyntéza. Tzv. genová
exprese, při níž se v genu DNA uložená informace
převádí a realizuje na konkrétní buněčné struktuře nebo
funkci, probíhá ve dvou etapách. Nejprve nastane transkripce
(přepis, kopie), kdy se vytvoří informační neboli mediátorová
RNA (mRNA - messenger RNA), jejíž vlákno je
kopií sekvence bazí jednoho z vláken dvojšroubovice DNA.
Přepis DNA do RNA je katalyzován enzymem zvaným DNA
dependentní RNA-polymeráza. Jednovláknová lineární
molekula mRNA se po ukončení transkripce oddělí a putuje do
cytoplasmy. Pak proběhne translace (překlad, přepis)
mRNA do proteinu, jehož sekvence aminokyselin je kódována mRNA
jako matricí či templatem; tato druhá etapa - syntéza
proteinů - probíhá v ribosomech (viz
níže "Ribosomy - továrny na proteiny"). Informace se tak překládá z "jazyka"
nukleových kyselin DNA do "řeči" aminokyselin, z
nichž jsou sestaveny proteiny. Vytvořené proteiny mohou být
využity samotnou buňkou, nebo mohou putovat do dalších
buněk, tkání či orgánů.
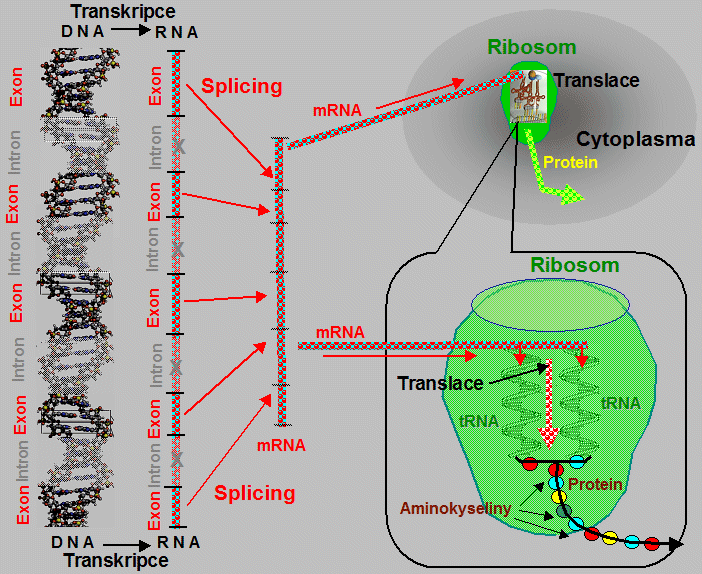 |
Schématický průběh proteosyntézy
v buňkách. |
RNA sestřih - Splicing
Jak bylo uvedeno výše v pasáži o DNA, jen malá část
sekvencí DNA kóduje nějaké (funkční) proteiny. Kódující
úseky exony představují jen malé
"ostrůvky", které jsou obklopeny "mořem"
zbytečných sekvencí intronů - "genetického
smetí" které činí cca 9/10 přítomných sekvencí.
Krátké úseky DNA, které kódují bílkoviny, jsou přerušeny
dlouhými sekvencemi které nic nekódují a před
proteosyntézou by měly být odstraněny. Odstranění
nekódujících úseků nemůže probíhat v DNA (jejíž
struktura musí být zachována jako genetická informace pro
další buněčné generace), ale děje se tak až na úrovni RNA
v procesu zvaném sestřih (splicing)
RNA. Informace obsažená v DNA je nejdříve přepsána do
molekuly prekurzorové mRNA (pre-mRNA),
která je přesnou kopií jednoho vlákna DNA; obsahuje tedy
mnoho nekódujících úseků. Během sestřihu pre-mRNA jsou
hranice mezi kódujícími a nekódujícími úseky rozpoznány
malými jadernými RNA pomocí párování bází. Nekódující
části jsou pak odstraněny a sekvence
kódující proteiny jsou opět spojeny do
výsledné mRNA, která odchází do cytoplasmy
(ribosomů) k proteosyntéze.
Nové výzkumy (projekt ENCODE) ukázaly, že nekódující RNA,
pocházející z "genetického smetí",
"zbytečné DNA", se často uplatňuje při regulaci
exprese kódujících genů.
Procesu translace se účastní tzv. transferová
RNA (tRNA), jejíž funkcí je přenos (transfer)
aminokyselin do ribosomu. Trojice nukleotidů v mRNA, určující
zařazení jedné aminokyseliny v proteinu, se nazývá kodon.
V tRNA mu odpovídá trojice nukletidů vázající se na kodon -
tzv. antikodon, který je specifický pro každý typ
tRNA. Transferová tRNA nese ve své akceptorové části na
jedné straně příslušné aminokyseliny, na druhé straně má
trojici nukleotidů (antikodon), která se může párovat s
kodonem mRNA. Svým molekulárním mechanismem zajišťuje
zařazení správných aminokyselin do proteinu podle dané
sekvence genetického kódu. Při této dvoustupňové proteosyntéze
vzniklé bílkoviny pak realizují příslušnou strukturu či
funkci v buňce nebo organismu. Lze říci, že genetická
informace je v buňce či organismu vyjádřena ve formě
proteinů: genom (soubor dědičné informace)
je transfomován v proteom (soubor všech
bílkovin daného organismu).
Pozn.:
Existuje i obrácený proces, tzv. reverzní
transkripce, při níž molekula
RNA prostřednictvím enzymu reverzní transkriptázy je
schopna uložit svou genovou sekvenci do DNA. Toto nastává při
infekci buněk některými viry, jejichž RNA může
takto vstupovat do DNA eukaryotických buněk a měnit jejich
genetickou sekvenci. Do této kategorie reverzní transkripce
patří svým způsobem i shora zmíněná syntéza telomerů DNA
působením telomerázy.
Po syntéze proteinů v
ribosomech mohou nastávat jejich posttranslační
modifikace - dodatečné chemické úpravy, které mohou
proteinům dodávat nové vlastnosti a regulovat jejich funkce.
Takovou typickou modifikací je fosforylace a defosforylace
(připojení nebo odtržení fosfátové skupiny PO4 k proteinu),
působící jako "přepínač" mezi aktivní a
neaktivní formou daného proteinu.
Většina genů tedy kóduje
nějaký protein a tyto proteiny zajišťují téměř všechny
funkce v organismu. A dále, přes proteiny spolu jednotlivé
geny mohou nepřímo interagovat: jeden gen
produkuje protein, který má (vedle
příp. jiných funkcí) schopnost měnit
např. rychlost transkripce jiného genu. Vznikají tak jakési genové
regulační sítě se značně složitým chováním.
Směr přenosu genetické informace
Genetická informace obsažená v sekvencích nukleotitů v
DNA/RNA a transformovaná do sekvencí aminokyselin v proteinech,
se v buňkách přenáší jen přesně definovanými směry :
1. Přenos - kopírování - z jedné DNA do
druhé DNA. To nastává při replikaci -
dělení - buněk.
2. Přenos z DNA do RNA - transkripce do
mRNA - jako první etapa proteosyntézy.
3. Přenos z mRNA do proteinu - translace
- jako dokončení proteosyntézy.
4. Reverzní transkripce z RNA do DNA, při
které dochází ke vložení (přepisu)v opačném směru.
Pozoruje se u napadení buněk retroviry, které pomocí
reverzní trankriptázy "vpašují" určité úseky
své RNA do DNA napadené buňky, čímž ji donutí vytvářet
proteiny pro svou potřebu. .....
Není
možný zpětný přenos z proteinu do RNA či do DNA,
jakož ani přenos z proteinu do proteinu. Evoluce pro tyto
zpětné přenosy nevytvořila žádné mechanismy. Toto
univerzální pozorování pro veškerý život zde na Zemi se
někdy nazývá "Ústřední dogma molekulární
biologie"..?..
Nemožnost
těchto zpětných přenosů genetických sekvencí je
biomolekulární příčinou, proč se neuplatňuje
dědičnost znaků a změn získaných během
života konkrétního organismu (tuto individuální dědičnost
předpokládal J.B.Lamarck).
Proteiny, enzymy,
kinázy
Bílkoviny - proteiny (řec.
protos=první; biologické látky prvotní
důležitosti) - jsou základním
materiálem života. Jsou stavebním materiálem
různých struktur v buňkách a tkáních a nositelem či
"vykonavatelem" mnohých biochemických funkcí.
Tyto biopolymery se skládají z aminokyselin
(je 22 základních druhů aminokyselin) spojených chemickými vazbami do dlouhých řetězců
jako "korálky na šňůrce" (jak
bylo podrobněji uvedeno výše v úvodní pasáži o buňkách). Pro správnou funkci proteinů je důležitá nejen
sekvence aminokyselin - primární struktura, ale i geometrická
prostorová struktura (3D) - sekundární a
terciální struktura, do níž se řetězce aminokyselin
poskládají či "sbalí". Specifická (a poměrně
neměnná, rigidní) trojrozměrná struktura do značné míry
určuje funkci proteinů metodou "klíče a zámku":
aby se protein mohl navázat na specifickou cílovou molekulu či
strukturu tak, jako když zapadne klíč do zámku. Primární
struktura, daná sekvencí aminokyselin, nemusí jednoznačně
určovat geometrické uspořádíní proteinu. Skládání
bílkovin do správného prostorového uspořádání pomáhají
speciální proteinové molekuly zvané chaperony
(fran. chaperon=gardedáma) - jsou to "strážci" kteří zabezpečují
správnou prostorovou strukturu proteinů, zabraňují vzniku
nesprávných vazeb (některé chaperony
příp. nesprávně sbalené struktury opět
"rozbalí").
Některé proteiny však nemají pevně uspořádaný
prostorový tvar, jsou nestrukturované, flexibilní
- ať již jako celek, nebo obsahují části s pevnou strukturou
i části flexibilní, popř. se skládají do prostorového
tvaru "podle potřeby". Takové flexibilní proteiny se
mohou vázat s různými druhy molekul (jsou
"promiskuitní"); příkladem jsou proteiny p21 a p27.
I známý protein p53 obsahuje nestrukturované sekce.
Proteiny, které řídí či katalyzují
biochemické reakce nebo děje, se nazývají enzymy
(název pochází z řec. zyme=kvas,kvasnice). Každý enzym je "specializován" pro
určitou funkci; enzym + substrát ® produkt + enzym.
Biochemické názvy enzymů jsou většinou tvořeny základem
souvisejícím s funkcí a koncovkou "-asa"
či "-áza": např. lipáza (enzym
štěpící tuky na jednodušší látky), proteináza
(rozkládá bílkoviny na menší části, peptidy),
amyláza (trávicí enzym, který štěpí dlouhé
molekuly škrobu (řec. amylon=škrob) na jednodušší sacharidy), fosfatáza (enzym
uvolňující fosfátovou skupinu z její vazby na jinou
sloučeninu).
Důležitými enzymy jsou tzv. kinázy (řec. kineo=pohybovat),
které jsou schopné aktivovat určité děje a přenášet fosfáty
na jiné sloučeniny, akceptory které mají OH-skupiny;
vznikne fosfoester akceptorové molekuly. Přenos a
navázání fosfátové skupiny PO4 (jejímž zdrojem je nejčastěji adenosintrifosfát
ATP, viz níže "mitochondrie") - fosforylace
- do určitého místa nějakého protienu aktivuje specifickou reaktivitu,
pro kterou fosfátová skupina dodává energii. Proteinkinázami,
proteinázami a molekulami regulujícími jejich aktivitu, je
uskutečňováno propojení různých signálních cest
v buňce. MAPK (mitogenem aktivované
protein kinázy) je skupina buněčných kináz, které se
navzájem postupně fosforylují, čímž vytvářejí síť či
kaskádu vedoucí a umocňující signál; na konci dráhy stojí
látky citlivé k fosforylaci. Dráhy obvykle končí v jádře,
kde fosforylují určité transkripční faktory.
Biochemické názvy některých kináz jsou tvořeny
podobným způsobem jako u ostatních enzymů. Tyrosinkináza
je enzym, který přenáší fosfát na hydroxylovou skupinu
cyklické aminokyseliny tyrosinu, vázaného v proteinu.
Tím ovlivňuje funkci a aktivitu příslušné bílkoviny -
účastní se regulací buněčného růstu a dělení, přenosu
signálů do buněk; zvýšená tyrosinkinázová aktivita
(např. receptoru pro epidermální růstový faktor EGFR) může
vést k nádorovému bujení. U řady kináz vznikly názvy
složitějším způsobem na základě onemocnění, při
jejichž zkoumání byly objeveny. Pro naši oblast biologických
účinků záření je zvláště důležitá tzv. ATM
kináza (Ataxia Telangiectasia Mutated),
jejímž působením dochází k fosforylaci a zvýšení exprese
proteinu p53, který působí jako transkripční faktor
a má zásadní význam v regulaci buněčného cyklu a v indukci
apoptózy (podrobněji je rozebíráno níže "Mechanismy
buněčné smrti", "Apoptóza").
Dále je to antiapoptický protein Bcl-2 (B cell lymphoma leukemia-2) a naopak proaptotický Bax (Bcl-2 associated X protein).
Cykliny jsou proteiny, které jsou
přítomné v buňce především v určité části buněčného
cyklu; v průběhu buněčného cyklu dochází k cyklickým
změnám jejich koncentrace (odtud
pochází jejich název) - expresi a
degradaci, což hraje významnou roli v regulaci buněčného
cyklu. Cykliny obsahují homologické řetězce o velikosti kolem
100 aminokyselin. Vážou se na své partnery - cyklin-dependentní
kinázy CDK. Za nízké
koncentrace cyklinů je většina CDK v neaktivním volném
stavu. Při nárůstu koncentrace se cykliny mohou navázat na
určitá regulační místa CDK, což způsobuje zvýšení
jejich aktivity - aktivní CDK může fosforylovat řadu
dalších enzymů, způsobovat jejich aktivaci a deaktivaci, což
může výrazně ovlivňovat dynamiku buněčného cyklu.
Vzhledem ke komplikovaným regulačním mechanismům v
eukaryotických buňkách je přítomno několik druhů cyklinů
a příslušných CDK, regulujících různé fáze buněčného
cyklu: cykliny D (regulují průchod kontrolním uzlem v
pozdní Gl fázi), cykliny E (ovlivňují přechod z G1
do S fáze), cykliny A (kontrolující průběh S
fáze), cykliny B (řídící zahájení mitózy a
některé procesy jejího průběhu).
Jednoduššími látkami bílkovinné povahy jsou tzv. peptidy
(řec. pepto=vařit,trávit;
vznikají m.j. natrávením bílkovin).
Skládají se rovněž z řetězců aminokyselin, avšak
menšího počtu, cca několika desítek (peptidy byly zmíněny
již na začátku našeho pojednání o buňkách). Slouží k
vzájemné komunikaci buněk, např. v imunitním a nervovém
systému, patří k nim řada hormonů. Do této skupiny
látek bílkovinné povahy patří cytokiny (řec. kytos=dutina,buňka, kineo=pohybovat,
přenášet) produkované buňkami a
sloužící k jejich vzájemnému ovlivňování a předávání
informací. Patří sem např. interferon (lat. inter=mezi, fero=nést) a interleukiny (vzájemné
ovlivňování bílých krvinek).
Modifikace a poškození DNA
Některé chemické látky mohou proniknout do buněčného
jádra, vstupovat do interakce s DNA a modifikovat ji takovým
způsobem, že nemůže úspěšně předávat genetické
informace při dělení buněk. Takové látky mohou zpomalit
nebo zastavit buněčné dělení - nazývají se cytostatika.
Takto postižené buňky posléze podléhají mitotické
smrti, především formou apoptózy. Podobný
účinek má i ionizující záření (a jím
indukované chemické radikály), což bude níže podrobně
diskutováno. Obojí tento mechanismus se používá k likvidaci
nádorových buněk při chemoterapii a radioterapii (§3.6
"Radioterapie").
Řada chemických látek, vstupujících do buněk
zvnějšku, i vznikajících uvnitř při metabolismu nebo
ionizačním ozáření, mohou reagovat s nukleotidy a měnit
sekvence DNA - způsobovat genotoxicitu. Do DNA
eukaryotických buněk též může vstupovat RNA virů
(působením tzv. reverzní transkriptázy) a měnit
její genetickou informaci; tzv. onkoviry mohou být
spouštěcím mechanismem mutací vedoucích k nádorové
transformaci buněk.
Buněčná
stěna
poskytuje ochranu buňkám, separuje buňky od
okolního prostředí a od ostatních buněk, odděluje pochody v
buňce probíhající a zprostředkovává regulace
buněčných funkcí tím, že působí jako selektivní bariéra
- membrána. U eukaryotických buněk
je buněčná stěna tvořena dvouvrstvou fosfolipidovou
membránou. Buňky přijímají chemické "signály" ze
svého okolí (a příp. od ostatních buněk) a reagují na ně.
U jednoduchých bakterií se to omezuje na vnímání zvýšené
koncentrace živin, avšak u mnohobuněčných organismů
fungují složitější a rozvinutější formy komunikace s
prostředím, včetně mezibuněčné komunikace. Mezibuněčná
komunikace zahrnuje celý řetězec: vyloučení signální
molekuly (např. hormonu) vysílající buňkou ®
transport signální molekuly k povrchu cílové buňky ®
registrace molekuly receptorem na povrchu buňky ®
přenos signálu dovnitř cílové buňky ® odpověď
buňky - vyvolání biochemických nebo biofyzikálních změn v
cílové buňce. Malé hydrofobní molekuly podobné
aminokyselinám (jako je acetylcholin, dopamin, histamin, ...)
mohou do buňky pronikat přímo difuzí přes
fosfolipidovou dvojvrstvu plasmatické membrány - pasivní
transport. K výměně některých iontů mezi buňkou a
okolím slouží transmembránové proteiny, které
vytvářejí tzv. iontové kanály.
Receptory
Na povrchu buněk (buněčné stěny) se nacházejí tzv. receptory
(lat. receptor=přijímač podnětů) - specifické molekuly, které jsou schopny rozeznat
jiné určité molekuly v okolí, chemicky je navázat a
transportovat dovnitř buňky, nebo iontovým kanálem ovlivnit
tok iontů skrz plasmatickou membránu. Látka (molekula), která
je schopna se selektivně vázat na buněčný receptor, se
nazývá ligand (lat. ligo=vázat). Ligand se naváže na receptor a spustí se
specifická signalizace dovnitř buňky. Z hlediska struktury se transmembránový
receptor skládá ze třech základních částí (domén):
- Extracelulární doména, tvořená
aminoterminálním koncem receptorového proteinu, má vazebné
místo pro ligand;
- Transmembránová doména, která ukotvuje
molekulu v buněčné membráně;
- Intracelulární doména, tvořená
karboxyterminálním C-koncem makromolekuly, po své aktivaci
spouští přenos signálu - aktivuje další molekuly signální
kaskády v cytoplasmě, příp. až do jádra.
Receptorová aktivace se uskutečňuje pomocí kináz
a fosforylace, jak bylo zmíněno výše v pasáži
"Proteiny, enzymy, kinázy". Po navázání
ligandu a fosforylaci receptoru dojde ke změně konformace
(prostorového uspořádání, rotace - jiná izomerie) této
molekuly a na vnitřní doméně k odkrytí vazebného místa pro
specifické intracelulární signální molekuly; za pomoci
kináz následuje aktivace dalších molekul signální kaskády.
Pokud je chemický signál přenesen až do jádra, jsou
fosforylovány trankripční faktory, které takto aktivovány
indukují transkripci (popř. represi) specifických genů,
produkujících potom příslušné efektorové proteiny
(lat. facio=činit, efficio=vykonat).
Cytoskelet
- kostra a nositel funkcí buňky
Cytoskelet - "buněčná kostra"
(buněčná "mřížka" či matrix) - je systém
mechanické opory a "výztuže" eukaryotických buněk.
Je tvořen složitým pletivem vláknitých proteinových
struktur v cytoplasmě. Tyto struktury jsou trojího druhu:
- Mikrofilamenty (lat. filamentum=nit,vlákno) jsou nejtenší vláknité struktury (tloušťky cca
5-7nm), které svou kontraktilitou vykonávají pohyb buněk jako
celku, s použitím energie získávané štěpením ATP (viz
níže). Mikrofilamenty jsou ve zvýšené míře obsaženy
např. ve specializovaných buňkách svalových vláken.
- Intermediální
filamenty jsou tvořeny o něco tlustšími
proteinovými vlákny (cca 10-15nm) a zajišťují mechanickou
stabilitu buněk a tkání vůči mechanickému namáhání.
- Mikrotubuly
(lat. tubulus=trubice,rourka) jsou nejtlustší a nejsložitější struktury
cykloskeletu (průměr cca 20-30nm). Jsou to tenké duté trubice
složené z proteinu zvaného tubulin, uspořádaného
do dlouhých řetězců dimerových jednotek, v nichž se
střídají molekuly alfa- a beta-tubulinu.
Tato vlákna se šroubovicově stáčejí (13 dimerů alfa a beta
tubulinu tvoří jeden úplný závit) a jednotlivé závity jsou
"bočně" vázány do trubice. Molekuly tubulinu
obsahují vazná místa pro guanosintrifosfát (GTP).
Polymerace tubulinu, spojená s prodlužováním mikrotubulů, se
děje postupným navazováním na tom konci mikrotubulu
("+" konec), který obsahuje beta-tubulin s navázaným
GTP. Hydrolýzou GTP vzniká GDP (guanosindifosfát) a
další růst vlákna se přeruší. Opačný proces k polymeraci
- disociace, spočívající v oddělování dimerů
tubulinu z konce vlákna obsahujícího alfa-tubulin
("-" konec), vede k postupné depolymeraci a
zkracování mikrotubulů. Sestavování a rozklad mikrotubulů
je řízen proteiny zvanými MAP (Microtubule Associated
Proteins). Mikrotubuly jsou svými konci ("-")
"ukotveny" v centrální části buňky v tzv. centrozomu,
tělíska v těsné blízkosti jaderné membrány, které hraje
důležitou úlohu při dělení buněk.
Vnitrobuněčný pohyb
a transpost
je jednou z podstatných vlastností buněk, který je nezbytný
k uskutečňování základních biologických pochodů.
Vnitrobuněčný pohyb je zprostředkovaný cytoskeletem, na
který se může vázat řada speciálních proteinů. Podél
mikrotubulů tak dochází k transportu řady
důležitých molekul v buňce. Je to prostřednictvím
speciálních látek zvaných kinesiny,
které mají vazebná místa pro různé molekuly. Kinesiny jako
"molekulové stroje" se pohybují -
"kráčí" - po dutých vláknech mikrotubulů (pomocí
vazeb "molekulových motorů" dineinu, které se
tyčinkovými výběžky kontaktují s mikrotubuly) jako po
"lanovce" a přenášejí tak dočasně navázané
molekuly. K pohonu každého kroku slouží molekula
adenosintrifosfátu (ATP), která střídavě reaguje s
koncovými částmi kinesinu, přičemž se adenosin-trifosfát
(ATP) hydrolyzuje na adenosin-difosfát (ADP) a odštěpuje se
fosfát. Uvolněná chemická energie se prostřednictvím
elektrických polarizací přeměňuje na mechanickou
sílu, způsobující pohyby a transport molekul. Při
jednom takovém kroku se kinesin posune o vzdálenost dvou
tubulinových dimerů, cca 10nm. Za jednu sekundu může molekula
kinesinu vykonat cca 80 kroků.
Na rozdíl od obvyklého pojetí sketetu
(kostra člověka, skelet stavby) není cytoskelet neměnnou
pevnou a tuhou strukturou, ale vysoce pružným a dynamickým
systémem, který je neustále podle potřeb buňky
přestavován. Změny struktury a velikosti jednotek cytoskeletu
jsou způsobeny polymerací a depolymerací (rozkladem,
disociací) proteinů do podoby řetězců a vláken (s příp.
šroubovitou prostorovou strukturou - u mikrotubulů). V buňce
je neustálá zásoba cytoskeletálních proteinů (tubulin,
aktin); tyto monomery pak polymerizují do struktur cytoskeletu,
nebo se naopak rozpadají zpět na monomery. Cytoskelet
transformuje chemickou energii v mechanickou - je zodpovědný za
všechny druhy buněčných pohybů, vnitrobuněčných (přesun
organel, dělení buněk) i extrabuněčných (pohyb buněk,
bičíků, řasinek...). Dále cytoskelet propojuje navzájem
jednotlivé bunečné struktury. A to nejen mechanicky. Podél
vláken cytoskeletu, především mikrotubulů, dochází k
interakcím různých proteinů a přenosu chemických signálů,
nezbytných pro regulaci buněčných pochodů.
Zprostředkovává intracelulární přesun složitých molekul
mezi jádrem a dalšími organelami, podílí se i na dělení
buněk (při dělení buněk vytváří mitotické vřeténko).
U somatických buněk, které jsou součástí
tkání a orgánů, na cytoskelet navazuje vně buňky tzv. extracelulární
matrix: systém proteinových fibrinových a
kolagenních vláken (lat. fibra=vlákno,
řec. kolla=klíh), spojujících
buňky a držících je pohromadě v tkáních a orgánech.
Zajišťuje spojení mezi buňkami, udržuje integritu a tvar
tkání, přenáší pohyb. Samotný mezibuněčný prostor je
vyplněn kapalinou gelové konzistence (intersticiální
tekutina, "tkáňový mok"), sloužící k přenosu
živin a kyslíku k buňkám a odvodu odpadních látek
metabolismu.

Stavba eukaryotické buňky. Ve
zvětšených výřezech jsou schématicky zakresleny detaily
některých struktur.
(tento obrázek je zde znovu uveden pro přehlednost)
Buněčné
organely
Mitochondrie - chemické "elektrárny"
buňky
Důležitými organelami v eukaryotické buňce jsou mitochondrie
(řec. mitos=vlákno, chondros=zrno). Mívají
rozmanitý tvar od protáhlých vláken až po kompaktní zrna,
velikosti cca 0,2-5 mikrometrů. Počet mitochondrií závisí na
metabolické aktivitě buňky: v průměrných
buňkách.jich je několik stovek, buňky s vyššími nároky na
spotřebu energie mohou obsahovat několik tisíc mitochondrií,
v metabolicky exponovaných kardiomyocytech je jich až 100 000 a
zaujímají více než 30% objemu buňky.
Mají dvě membrány, vnitřní a vnější :
- Vnitřní membrána je
nepravidelného, mnohonásobně zprohýbaného tvaru (prohlubně do nitra se někdy nazývají kristy). Je selektivně propustná pouze pro molekuly
podílející se na respiračním řetězci a oxidační
fosforylaci. Na vnitřní membráně jsou lokalizovány
multiproteinové komplexy, které transportem protonů a
elektronů zprostředkovávají buněčnou respiraci; z hlediska
našeho výkladu je důležitý zvláště cytochrom c (viz níže "Apoptóza").
- Vnější membrána se podobá
buněčné stěně a je propustná pro většinu malých molekul,
nikoli však pro složitější proteinové molekuly (jako je
cytochrom c). Vyvinula se v průběhu fylogenetického vývoje z
plasmatické membrány aerobních bakterií po jejich endocytóze
(viz níže).
Hlavní funkcí mitochondrií je produkce chemické
energie ve formě molekul ATP (adenosin-tri-fosfát) C10H8N4O2NH2(OH)2(PO3H)3H. Molekuly ATP,
které jsou "přenašeči energie" v buňkách,
vznikají v mitochondriích oxidací citrátů a mastných
kyselin (Krebsův cyklus, oxidace vodíku, oxidační
fosforylace). V místě potřeby se ATP oxidací mění na ADP
(adenosindifosfát+P), nebo AMP (adenosinmonofosfát+2P) za
uvolnění značné energie (cca 57J/g). Mitochondrie se někdy
označují za "elektrárny" buňky, v nichž probíhá
oxidace živin, především glukózy, za vzniku oxidu
uhličitého, vody a výstupního ATP, jehož energie je v
buňkách využívána pro endotermické procesy - syntézu
makromolekul, transport molekul proti gradientu, buněčný pohyb
(včetně svalové kontrakce), tvorba elektrických potenciálů
v membránách, produkci tepla. Mitochondrie vznikají v
buňkách průběžně binárním dělením
("pučením", podobně jako bakterie) nezávisle na
buněčném cyklu; uvnitř vnitřní membrány obsahují svou
vlastní mitochondriální DNA, úplně jinou než
jaderná DNA.
Evoluční původ mitochondrií
Mitochondrie mají zajímavý evoluční původ. Dávné
eukaryotní buňky, když se vyvíjely z prokaryot, neměly
mitochondrie. Požíraly mimo jiné různé prokaryotní
buňky, kterými se živily. Před asi 1,5-2 miliardami let se
občas stávalo, že prvotní eukaryotické buňky fagocytovaly
některé druhy dávných aerobních bakterií (podobných
protobakteriím řádu Rickettsiales), které však
nerozložily a nestrávily, ale nechaly je neporušené -
ustavily s nimi endosymbiózu *). Buňka
získávala z okolí kyslík a živiny, ty předávala těmto
bakteriím - budoucím mitochondriím - které je metabolizovaly
na energetické molekuly pro vlastní potřebu i potřeby celé
buňky. Taková symbióza se ukázala oboustranně
výhodná. Během miliónů let si buňka svou bakterii
zcela "ochočila", endosymbiot se vzdal větší
části své nezávislosti a stal se pouhou organelou. Kruhová
DNA, podobná prokaryotním nukleotidům, je v mitochondriích
dosud a zajišťuje jejich částečnou genetickou autonomii. U
rostlinných eukaryotických buněk se místo mitochondrií
vyskytují chloroplasty (jakési fotochemické
"baterie"), jejichž obdobný evoluční původ se
odvozuje od endosymbiózy se sinicemi.
*) Vysledovat fylogenetický
"evoluční strom" eukaryot až k
jejich "kořenu" je však velmi nesnadné. Kromě primární
endosymbiózy někde na začátku, docházelo během evoluce
k několika dalším sekundárním či terciálním
endosymbiózám. Srovnávací analýza morfologických
znaků je často zavádějící. Spolehlivější metodou je
nyní molekulární fylogenetika,
která vyvinula postupy pro rekonstrukci fylogeneze podle
podobnosti genů a proteinů. Srovnáváním sekvencí genů
(nejčastěji genů pro RNA malé jednotky ribosomu, SSU rRNA,
které jsou přítomné ve všech buňkách) u různých
organismů lze vysledovat určité podobnosti, které mohou být
indiciemi pro jejich fylogenetickou příbuznost. Problémem je,
že v průběhu evoluce velmi často docházelo ke genovým
fúzím původně samostatných genů a naopak ke genovým
rozdělením na dvě nové části. Proto je nutno
fylogenetické studie provádět na více genech a proteinech - multigenové
či fylogenomické analýzy používající
sekvenování genomů a molekul mediátorové mRNA, s následnou
statistickou analýzou podobností.
Lysosomy
Dalšími organelami v buňce jsou lysosomy
("rozkladná tělíska" - "trávicí
měchýřky"). Trávení je enzymatické
štěpení přijatých živin potravy na základní biologické
stavební jednotky, jimiž jsou aminokyseliny, monosacharidy a
mastné kyseliny. V lysosomech probíhá chemický
rozklad - hydrolýza- různých složitějších
organických látek (cukrů, tuků, nukleových kyselin,
bílkovin) v kyselém prostředí s mnoha různými enzymy.
Produkty tohoto rozkladu mohou být pak zpracovány v mitochondriích
za vzniku energetických molekul ATP, které
"roznášejí" vazbovou chemickou energii potřebnou k
syntéze složitých látek a k dalším funkcím buněk. A v
ribosomech na vznik specifických buněčných proteinů.
Lysosomy mívají průměr cca 0,1-1 mikrometr, v buňkách jich
je několik stovek; větší počet je v gastrointestinálním
traktu - v jaterních a pankreatických buňkách.
Ribosomy - "továrny"
na proteiny
Ribosomy (ribonukleonproteinové částečky)
jsou drobné organely nacházející se ve velkém počtu v
cytoplasmě buněk a též na povrchu endoplastického retikula.
Mají velikost cca 20-30 namometrů. Počet ribosomů v buňkách
je značně variabilní, je úměrný rychlosti růstu buňky. Ve
většině buněk je řádově 10 000 - 100 000 ribosomů, ale v
některých případech jich v epiteliálních buňkách alveolu
mlécné žlázy savců může být až 10 milionů. Ribosomy
mají v buňkách jen dočasnou existenci, poměrně krátkou. Po
dokončení produkce specifického proteinu se obě podjednotky
oddělí a obvykle se rozloží. Nové ribosomy jsou u
eukaryotických buněk vytvářeny v jadérku,
kde probíhá syntéza RNA a biogeneze ribosomů. U
prokaryotických buněk se tento proces odehrává v cytoplasmě,
kam putují molekluly RNA.
Ribosomy jsou složeny z RNA a proteinů,
strukturovaných do dvou podjednotek. Malá podjednotka ribosomu
má molekulovou hmotnost cca 800kDa a skládá se z 20 proteinů
a molekuly RNA délky asi 1600 nukleotidů (16S RNA). Velká
podjednotka ribosomu má velikost asi 1500 kiloDaltonů a
skládá se z 33 proteinů a dvou molekul RNA (23S RNA o délce
2900 nukleotidů a 5S RNA délky 120 nukleotidů). V ribozomech
probíhá syntéza proteinů z řetězce mRNA pomocí translace
- dekódování informace z mRNA, podle níž je sestavován
výsledný řetězec aminokyselin; ke "čtení" se
využívají molekuly tRNA, které nesou na jedné straně
aminokyselinu a na druhé straně mají trojici nukleotidů
(antikodon), která se může párovat s kodonem mRNA (bylo
popsáno výše). Specifické nukleotidy 16S RNA z malé
podjednotky ribosomu vytvářejí vodíkové můstky s nukleotidy
kodonu i antikodonu pouze tehdy, když dojde k jejich správnému
párování a geometrické orientaci. Vlastní peptidická
kovalentní vazba, která spojuje dvě aminokyseliny, vzniká ve
velké podjednotce ribozomu, kde se nachází tzv.
peptidyl-transferázové centrum obsahující 23S RNA a
ribosomální proteiny. Ribosomy jsou jakési buněčné
"linky" či "továrny" na výrobu bílkovin:
jaderná DNA ("projekční kancelář")
dodává informační mRNA ("technický výkres"),
která se v ribosomech překládá do sekvence aminokyselin
proteinů (pomocí transferové tRNA pro každou
aminokyselinu) - probíhá vlastní "výroba" molekuly
specifické bílkoviny. Bylo podrobněji diskutováno výše
"Přenos
informace - proteosyntéza".
Další organely
Poměrně velkým útvarem v buňce je endoplasmatické
retikulum (v mikroskopu se jeví
jako jakási "sraženina" v cytoplasmě) tvaru stočeného membránového listu. Skládá se ze
dvou typů: drsného (granulárního) retikula, jehož
povrch je posetý ribosomy (tyto granule způsobují
"drsnost") a hladkého endoplasmatického
retikula se sítí kanálků spojených s drsným retikulem. Tyto
útvary hrají ústřední roli v syntéze proteinů, lipidů,
steroidů a dalších látek v buňce. Golgiho komplex
je soustava endomembránových váčků (vezikul) v
blízkosti endoplasmatického retikula, sloužících k
transportu a úpravě proteinů.
Specializace
buněk
Mnohobuněčné organismy se skládají z buněk různých
druhů, které mají různé tvary a různou činnost - jsou
"specializované" k tomu, aby
vytvářely různé diferencované tkáně a orgány se
specifickou funkcí, nebo aby mechanicky stavěly např. opěrný
či pohybový aparát. Tyto specializované buňky,
vykonávající určitou funkci, se nazývají efektorové
(lat. efektor=vykonavatel). V lidském těle se nachází asi 230 druhů
různých specializovaných buněk. Jsou to jednak buňky tělní
- somatické (řec. sóma=tělo) - to jsou prakticky všechny buňky v těle, a buňky
pohlavní - gametické (řec.
gameté= žena, manželka) - u
savců jsou to vajíčka a spermie.
Pro zajištění růstu a regenerace jsou v
tkáních a orgánech dále přítomny buňky kmenové
(mateřské, klonogenní). Kmenové buňky jsou schopné
neomezeného dělení, přičemž jsou schopny produkovat jak
identické buňky kmenové, tak buňky dceřinné, nesoucí
vlastnosti dané diferencované tkáně - asymetrické
dělení na dvě různé buňky, identickou kmenovou a
odlišnou dceřinnou buňku *). Asymetrické dělení zajišťuje
proces diferenciace, při němž se vznikající
buňky svou stavbou a funkcí přizpůsobují specifické roli,
kterou mají v organismu vykonávat. Všechny buňky v organismu
jsou totiž opatřeny stejnou genovou výbavou, avšak v
důsledku tohoto procesu v konkrétní buňce dochází k
realizaci pouze určité části genetické informace (vlivem
specifických transkripčních faktorů jsou v buňce
přepisovány jen určité geny, jiné se neuplatňují).
Dceřinné efektorové buňky zpravidla vstupují do klidové G0
fáze buněčného cyklu.
*) O dělení buněk a buněčném cyklu je
pojednáno níže v části "Účinky záření na buňky", pasáž "Radiační účinky
během buněčného cyklu".
Nové výzkumy ukázaly, že specializované
efektorové buňky mohou za určitých okolností (např. vlivem stresu
z nepříznivého okolí, jako je změna kyselosti prostředí) ztratit
svou specializaci a stát se buňkami které mají k
dispozici celou genetickou výbavu. Dělení těchto buněk se
může patrně podílet na regeneraci poškozených tkání;
spekuluje se i o tom, že některé buňky po ztrátě
specializace se vlivem mutací mohou transformovat na klonogenní
buňky nádorové.
Zánik
- smrt - buněk
Zánik živých
organismů
Žádné organismy nežijí věčně - jsou "smrtelné".
Příčiny zániku (smrti) organismů mohou bý
velmi různorodé, ale můžeme je zhruba rozdělit do dvou
kategorií :
1.
Vnější příčiny
- mechanické zničení, napadení a "sežrání"
jiným organismem, tepelné poškození, chemické či radiační
poškození, nepříznivá změna vnějších podmínek,
nedostatek živin.
2.
Vnitřní faktory
- fyziologické poruchy a onemocnění,
"opotřebování" orgánů a degenerace životních
funkcí, stárnutí - senescence.
Vnější a vnitřní faktory spolu často úzce
souvisejí. Infekce, radiace či chemické škodliviny, i když
se s nimi v akutní fázi organismus úspěšně vyrovná, mohou
iniciovat latentní procesy vnitřní degradace, které posléze
mohou způsobit zánik organismu...
Stárnutí organismů
Stárnutí - senescence - živého
organisamu je komplexní nevratný proces, projevující se
postupným snižováním účinnosti životních funkcí a
chátráním tělesných struktur organismu. Je nedílnou
součástí života všech mnohobuněčných organismů a nakonec
vyústí v jejich zánik. Rychlost senescence je základním
limitujícím faktorem pro délku života
organismů. Tato maximální délka života je velmi
různá pro jednotlivé druhy organismů.
Nejdéle žijícími
organismy jsou některé jehličnany - sekvoje Sequoia
sempervirans či borovice Pinus aristata,
dosahující 3000-5000 let. Z živočichů jsou dlouhověké
např. želvy Chelonoidis nigra (cca 200 let) či mlži Arctica
islandica (500 let). Většina živočichů má délku
života v rozmezí roků či desítek let, u hmyzu jsou to
většinou měsíce, nejkratší je u jepice (max. 3
dny).
Stárnutí je multifaktoriální
proces, na kterém se podílí různé mechanismy, z nichž
patrně nejdůležitější jsou tři :
->
Reaktivní volné radikály, především
kyslíkové, vznikající při mnoha metabolických procesech v
organismu. Hlavním zdrojem volných radikálů v buňkách jsou mitochondrie,
ve kterých probíhá buněčné dýchání a tvorba chemické
energie. V organismech sice jsou přítomny antioxidační
enzymy, ale s přibývajícím věkem se snižuje schopnost
je produkovat. Volné radikály se pak začínají více
akumulovat a mohou poškozovat buňky a tkáně (především způsobovat zlomy řetězců DNA, jak je
uvedeno v následujícím bodě).
->
Hromadění defektů DNA vznikajících
spontánně a náhodně během života při chybách v
replikacích, reakcemi kyslíkových radikálů, nebo reakcemi
mutagenních látek (které se většinou
do buněk dostávají z okolí s potravou).
Některé tyto vážnější defekty v důležitých geneticky
kódujících částech DNA nejsou opraveny, v organismu se
hromadí, může docházet k poruchám správné funkce buněk v
tkáních. Je pozorováno, že počet spontánních chrozomových
aberací v somatických buňkách roste s věkem.
->
Zkracování telomerů při mitotickém dělení
buněk (bylo popsáno výše v části
"DNA, RNA, proteiny, chromosomy, telomery", pasáži "Telomery"). Po překročení určité kritické délky již
telomery ztrácí svou ochrannou funkci a buňka se již nemůže
dělit; zpravidla pak nastává programovaná buněčná smrt -
apoptóza. Pravidelné zkracování telomerů při každém
dělení způsobuje, že somatické buňky během svého života
mohou provést pouze určitý omezený počet dělení - cca 50-80.
Tento počet dělení se nazývá Hayflickův limit
(Hayflick a Moorhead to zjistili v r.1951). Buněk schopných se dělit je proto s postupem času
v organismu stále méně, funkční schopnost tkání klesá a
proto organismus stárne - replikativní stárnutí.
Pozn.: Proces
stárnutí - senescence - bývá někdy dáván do
souvislosti s.2. zákonem termodynamiky -
růstem entropie (neuspořádanosti)
uzavřených systémů. Tento 2.termodynamický zákon je zde
však jen skrytým fyzikálním rámcem,
ležícím hluboko v molekulárním pozadí. Skutečnými
explicitními mechanismy jsou zde však zmíněné bio-chemické
procesy volných radikálů, defektů DNA a zkracování telomer
při dělení buněk.
Mechanismy
buněčné smrti
Na buněčné úrovni se setkáváme se čtyřmi
základními typy - mechanismy - zániku a inaktivace: apoptóza,
autofagie, nekróza a senescence buněk. Jako zvláštní
kategorie se někdy uvádí "mitotická katastrofa". Za
fyziologických okolností je smrt eukaryotických buněk jedním
z mechanismů udržování tkáňové homeostázy
- rovnováhy v produkci nových buněk a zánikem buněk
starých, nadbytečných, poškozených. Dále může sloužit
jako ochrana před zmutovanými buňkami, které mohou být pro
organismus nebezpečné.
Apoptóza
buněk
Základní způsob řízeného (programovaného) zániku
poškozených, nefunkčních či jinak nadbytečných buněk u
mnohobuněčných organismů, se nazývá apoptóza
(řec. apoptosis = padání -
název pochází z opadávání listí, způsobeného zánikem
buněk v řapících) - jakási buněčná
"sebevražda". Je to složitý řetězec procesů
ovlivňovaný řadou faktorů a řízený mnoha složitými
biochemickými molekulami, především proteiny a enzymy.
Apoptóza může být vyvolána dvěma druhy podnětů :
¨ Vnitřní
(intracelulární) aktivace apoptózy -
neopravitelné poškození DNA, toxické látky v buňce (např.
produkty oxidace), nedostatek živin. Apoptóza
spouštěná vnitřními mechanismy funguje jako ochrana proti
přežívání a množení defektních buněk, především
zmutovaných buněk s poškozenou DNA.
¨ Vnější
(extracelulární) aktivace apoptózy - vazba
určitých látek (ligandů "smrti"), vysílaných
regulačními mechanismy tkání a organismu, na příslušných
receptorech cytoplasmatické membrány. Správně
fungující apoptóza, spouštěná vnějšími regulačními
mechanismy z tkáně, pomáhá udržovat tkáňovou homeostázu,
představuje účinnou ochranu proti nadměrnému zmnožení
buněk.

Nahoře: Vnitřní a vnější signální cesty
aktivace apoptózy. Dole: Morfologické změny
buňky v průběhu apoptózy.
Vnitřní signální cesta
apoptózy
Důležitou úlohu v apoptóze, zvláště v procesu vnitřní
aktivace apoptózy, má protein p53 (má molekulovou hmotnost 53 kilodaltonů a délku 393
aminokyselin). Za normálních okolností
je jeho hladina v buňce na nízké úrovni (udržuje ji protein mdm2),
která stačí k udržení regulace buněčného cyklu.
Poškození DNA aktivuje kinázu ATM,
která spustí produkci proteinů pro opravu DNA a (přes mdm2)
aktivuje a fosforyluje protein p53, který působí jako
transkripční faktor. V počátečních fázích může p53
aktivovat opravu DNA (přes proteiny GADD45) a zpomalit
buněčný cyklus (přes protein p21 kódovaný genem
WAF/CIP1) tak, aby stačila proběhnout reparace. Protein p21
inhibuje cyklin-dependentní kinázy CDK a zastaví
buněčný cyklus v G1 fázi; v případě správné funkce p53
je buněčný cyklus obnoven až po odstranění chyb v DNA.
Pokud p53 zjistí poškození DNA přesahující možnosti
opravy, zvýší se jeho exprese, čímž se indukuje syntéza Bax
a dalších proteinů, navazujících se na mitochondrie;
zároveň dochází k inhibici antiapoptického Bcl2
proteinu (zmíněného níže). Membrány mitochondrií
ztrácejí potenciál a stávají se propustné; z mitochondrií
se uvolňuje cytochrom c *), protein DIABLO (direct IAP binding protein with low pI), AIP (Apoptosis-Inducing
Protein) a nastartuje se kaspázový
řetězec (viz níže).
*) Cytochrom c, pokud je uvnitř
mitochondrií - lokalizovaný na vnitřní membráně (přes niž
zprostředkovává transport elektronů), je důležitý pro
buněčnou respiraci (je zde cytochrom-c-reduktáza a
cytochrom-c-oxidáza). Pokud se však z mitochondrií uvolní,
může vést k záhubě buňky.
Protein p53 (objevený v r.1979 v
britském Cancer Research) má tedy funkci regulátoru
buněčného cyklu a jakéhosi "strážce genomu":
- Může aktivovat opravu DNA, přičemž může na chvíli
pozastavit buněčný cyklus, aby byl poskytnut čas reparačním
mechanismům;
- Pokud se ukáže, že DNA buňky je tak vážně poškozena,
že její oprava již není možná, může spustit apoptózu,
která programově dovede buňku k "bezpečnému"
zániku.
Tímto způsobem se zajišťuje ochrana organismu před
potenciálně nebezpečnými buňkami s poškozeným genomem,
tedy i před nádorovými buňkami. Odtud název tumor-supresorový
gen TP53 pro příslušnou sekvenci na DNA
(lokalizovanou na 17p13.1), která kóduje jako produkt
(trankripční faktor) protein p53. Mutace genu TP53 může vést
k nádorovému bujení (spolu s dalšími
faktory, viz §3.6 "Radioterapie", pasáž "Karcenogeneze"). Na funkci TP53 se podíl i několik dalších genů
(kooperujících i konkurujících).
Vnější signální
cesta apoptózy
Vnější aktivace apoptózy je zahájena příchodem
"smrtícího" ligandu, který se
naváže na příslušný "smrtící" receptor
lokalizovaný na povrchu buňky. Jedním z takových ligandů je
tzv. TRAIL gen (název pochází z oblasti
onkologie: tumour necrosis factor-related apoptosis-inducing
ligand). Pod povrchem buňky se pak
aktivují pro-kaspázy (8 a 2), proces se větví na inhibici
membrány mitochondrií (a uvolnění cytochromu c
stejně jako u shora uvedené vnitřní aktivace) a na přímou
aktivaci efektorových kaspáz (-3,6,7).
Kaspázový řetězec
Vlastní fáze nevratné apoptózy je způsobena aktivací
proteinů ze skupiny cysteinproteáz, zvaných kaspázy
*) (ang. zkratka caspase = cysteinyl
aspartate-specific protease), které
rozkládají intracelulární proteiny (proteolytická
degradace), včetně cytoskeletu a buněčné matrix; to pak vede
i k níže zmíněným morfologickým změnám buňky. Napadají
dále i jádro a štěpí DNA.
*) Je zatím známo 14 druhů kaspáz, z
nichž se na apoptóze podílí asi polovina. Některé z nich,
tzv. pro-kaspázy (-2,8,9,10) v inaktivní
formě, se běžně vyskytují v cytoplasmě. Reakcí těchto
"signálních" kaspáz s cytochromem c, nebo asociací
s receptory, dochází k expresi efektorových kaspáz
(-3,6,7), rozkládajících proteiny a další makromolekuly v
buňce.
Po spuštění apoptického procesu
se DNA rozštěpí na menší úseky, probíhá hydrolýza
buněčných proteinů, degradace cykloskeletárních struktur a
membrán organel. Dále dochází k membránové
depolarizaci buněčné stěny, k odkrytí fosfolipidů
na povrchu buněk, ke zvýšené permeabilitě
plasmatické membrány, posléze k porušení integrity
buněčné stěny. V konečné fázi dojde ke
smrštování a rozpadu buňky na několik menších
fragmentů (apoptických tělísek), na jejichž povrch se z
vnitřní stěny dostanou molekuly (např.
fosfatidylserin - PS) stimulující jejich fagocytózu
- "pozření" okolními buňkami, fagocyty nebo
imunitními buňkami (makrofágy -
zvýšená expozice PS na povrchu buňky je pro makrofágy
lákavým signálem: "sežer mne!"). Na rozdíl od nekrózy dochází tedy i k
regulovanému a šetrnému "odklizení" produktů
buněčného zániku.
Apoptóza je hlavním mechanismem biologického účinku -
buněčné smrti - při ozáření nižšími a
středními dávkami, desetiny až jednotky Gy. Při
indukci apoptózy ionizujícím zářením (vnitřní signální
cesta) se mechanismus jejího vzniku a časová závislost u
různých typů buněk významně liší. Rychle se dělící
radiosenzitivní buňky mohou vstoupit do apoptózy z různých
bodů buněčného cyklu, méně radiosenzitivní buňky
vykazují různě dlouhé "zablokování" v některé
fázi buněčného cyklu, většinou v G2 fázi. V této době se
buňky nedělí a je jim poskytnut čas pro reparaci poškození.
Pokud je poškození ireparabilní, je iniciována apoptóza.
Celkový čas, který mají buňky k dispozici při reparaci
poškození DNA před případným vstupem do apoptózy, je
důležitým faktorem radiosenzitivity těchto buněk při
nižších dávkách (2-5Gy). Při vyšších dávkách (cca
20Gy) se ionizujícím zářením indukovaná apoptóza objevuje
nezávisle na zablokování buněk v určité fázi cyklu a doba,
kdy se po ozáření apoptóza projeví, závisí na obdržené
radiační dávce.
Zajímavým efektem, doprovázejícím apoptózu
konkrétních nevratně poškozených buněk, je tzv. bystander
efekt (diskutovaný níže), vedoucí k apoptóze či
genetickým změnám i u některých okolních buněk,
které původně poškozené nebyly.
Inhibice apoptózy
V buňkách a tkáních se mohou uplatňovat i antiapoptické
mechanismy. Některé mutace genu TP53 (jeho delece nebo bodová
mutace) mohou způsobit inhibici apoptózy. Apoptóza může být
též zablokována na úrovni mitochondrií. Byl nalezen
antiapoptický gen Bcl-2 (B cell lymfoma/leukemia
protein 2 - byl izolován z nádorových buněk lymfomu B),
který se nachází v mitochondriích a jehož zvýšená
koncentrace chrání membrány mitochondrií - zabraňuje
průniku cytochromu c a spuštění kaspázového
řetězce proteolytické degradace v cytoplasmě (blokuje efekt
proteinu p53). Bcl-2 je svým genem BCL-2 intenzívně
exprimován během embryonálního vývoje, v dospělosti se
vyskytuje jen v kmenových buňkách (a v buňkách
nádorových).
Bcl-2 i BAX jsou transkripčními cíly pro důležitý
regulační protein p53. Exprese pro-apoptického proteinu Bax
může být indukována ionizujícím zářením, cytotoxickými
látkami (jako jsou chemoterapeutika) či jiným genotoxickým
stresem.
Autofagie
buněk
Jedná se o jakési "sebe-pozření" buňky (z řec. auto = sám sebe, fago = jíst,hltat). Při úplné autofagii (makroautofagii)
buněk, autofagocytóze, dochází k porušení stěn
lysosomů a následné degradaci (rozkladu,
"natrávení") buněčného obsahu. V buňce vznikají
autofagické vakuoly, posléze proces autofagie může postihnout
celou buňku. Autofagie může být indukována cytotoxickými
látkami nebo ozářením, za fyziologických podmínek funguje
jako adaptační mechanismus na nedostatek živin či kyslíku. Částečná
autofagie - řízený proces vlastního štěpení a
trávení - nastává tehdy, když se buňka snaží přežít
nepříznivé podmínky natrávením části buněčné
cytoplasmy nebo svých méně důležitých organel. Autofagické
váčky jsou transportovány do lysosomů, v jejichž kyselém
prostředí dochází k rozkladu složitých biologických
molekul, přičemž dochází k recyklaci energie a potřebných
látek. Udržuje se tak proteinová homeostáza během
nepříznivých podmínek; po jejich odeznění může buňka
dále fungovat a dělit se.
Nekróza
buněk
Přímý zánik (odumření) buněk, který prakticky není
řízen buněčnými mechanismy, se nazývá nekróza
(řec. nekros=mrtvý). Vzniká následkem těžkého nevratného poškození
buněk - mechanické poškození, chemické poškození, silné
přehřátí či podchlazení, hypoxie, silné ozáření.
Dochází k zastavení oxidační fosforylace, k nahromadění
iontů v buňce, edému (zvětšení) buněk, prasknutí membrán
organel a uvolnění proteolytických enzymů do cytoplasmy.
Nastane štěpení bílkovin a DNA, porušení buněčné stěny
a vylití degradovaného buněčného obsahu do
extracelulárního prostoru, což je v tkáni doprovázeno
zánětlivou reakcí. Nekróza může postihovat celé skupiny
vzájemně sousedících buněk (tkáňová nekróza).
Při ozáření ionizujícím zářením dochází k nekróze
buněk až při velmi vysokých dávkách
desítky až stovky Gy.
Senescence
buněk
Stárnutí buněk, zvané senescence,
je dlouhodobý multifaktoriální proces, zahrnující jak
nitrobuněčné "programové" molekulární mechanismy,
tak i časově se kumulující exogenní škodlivé faktory
ovlivňující životaschopnost buněk. Uplatňuje se
progresívní poškozování buněk reaktivními formami kyslíku
a dusíku v průběhu života tkání, při stále se
snižující kapacitě antioxidačních mechanismů. Buňky mohou
dosáhnout jen určité hranice v počtu svých dělení, tzv. Hayflickův
limit (cca 40-60 cyklů); pak již buňky schopnost dělení
ztrácejí. Omezenost replikačního potenciálu buněk je dána
především zkracováním tzv. telomer - jsou
to okrajové komplexy v DNA, které chrání konce chromozomů
před nežádoucími reakcemi a vazbami a před jejich
vyhodnocením buněčnými mechanismy jako zlomy DNA. Při
replikaci DNA nedochází ke kompletní syntéze konců DNA,
takže při každém buněčném dělení jsou na dceřinné DNA
okrajové konce - telomery - zkracovány. Při přílišném
zkrácení již telomery nechrání dostatečně konce
chromozomů, což buněčné kontrolní mechanismy vyhodnotí a
zastaví buněčný cyklus. Zkracování telomer tak funguje jako
"mitotické počítadlo". Po dosažení Hayflickova
limitu dochází ke stárnutí buněk, k replikační senescenci
(srov. též výše pasáž "Zánik
- smrt - buněk").
Existuje však speciální enzym zvaný telomeráza
(je to komplex složený z RNA a proteinů,
obsahující sekvence sloužící jako předloha pro syntézu
sekvencí telomeru DNA - reverzní transkriptáza), který je schopen dosyntetizovat koncové sekvence
telomerů a zabránit tak jejich zkracování při dělení
buněk. Takové buňky jsou pak schopné neomezeného
dělení (immortilizace -
"nesmrtelnost" buněk), což fyziologicky probíhá
pouze v dělících se embryonálních a kmenových
buňkách, zatímco patologicky se uplatňuje u buněk nádorových
(§3.6 "Radioterapie").
Senescenci mohou urychlit některé škodlivé
faktory chemické, jakož i expozice ionizujícím zářením
(stárnutí buněk pokožky urychluje nadměrná expozice
slunečním zářením) - předčasná stresem
indukovaná senescence (regulační cesta senescence nezávislé
na zkracování telomer vede přes protein p16).
Entóza
buněk
Entóza buněk (z řec. entos=uvnitř) je jev, kdy se dvě buňky vzájemně spojí a sloučí
v jednu buňku, dočasně nebo trvale - jedna buňka je
"internalizovaná" uvnitř druhé, vzniká "buňka
v buňce". V laboratorních koloniích buněk se pod
mikroskopem občas pozoruje, že dvě buňky se postupně k sobě
přibližují, až do sebe "vstoupí", nastane
"invaze" jedené živé buňky do cytoplasmy jiné
buňky. V řadě případů se jedná o "kanibalismus",
kdy jedna buňka pohltí druhou, která zanikne vlivem
lysosomálních enzymů - to by se dalo zařadit do kategorie buněčné
smrti (tak je tomu u fagocytů). Někdy ale dochází k endosymbióze,
kdy pohlcená buňka přežívá, může se uvnitř
"hostitelské" buňky dokonce dělit, či ji může
opět bez poškození opustit.
K entóze dochází u buněk, které se oddělily z vazby v
extracelulární matrix. Když se taková uvolněná buňka
těsně přiblíží k jiné buňce, začnou na ni působit
adhezní síly k cytoskeletu sousední buňky, které ji mohou
vtlačit dovnitř. Zatím je otázkou, zda entóza je jev, ke
kterému skutečně dochází v organismu (kde jsou v tkáních
buňky fixovány v extracelulární matrix), nebo jen v
buněčných kulturách volných buněk..?.. Entóza by mohla
hrát určitou roli v nádorových omemocněních. Zatím není
jasné, zda pozitivní (další typ buněčné smrti, který
může napomáhat redukci nádorových buněk) nebo negativní
(nádorové buňky se mohou "skrýt" v jiných
buňkách před imunitními mechanismy či chemoterapeutiky a pak
se opět uvolnit a začít se množit)..?..
Mitotická
katastrofa
Takto se někdy označuje složitější kombinovaný
mechanismus, který může (ale nemusí) vyústit v buněčný
zánik. Nastává jako důsledek chybné mitózy,
když se buňka pokouší dělit bez náležité opravy
poškozené DNA (jako je na obr.5.2.2c), v důsledku selhání v
kontrolním uzlu G2/M a předčasné aktivace CDK1. Při
mitotické katastrofě se objevuje větší počet
multipolárních dělících vřetének a dekondenzovaných
chromosomů, dochází k jaderné fragmentaci či ztrátě
jaderné membrány, může být přítomno dvě i více jader (multinukleace)
vzniklých nepřesným rozdělením při citokonezi. Tato situace
může vést k "sekundární" mitotické buněčné
smrti, především mechanismem apoptózy či autofagie. Pokud
však dojde k inhibici procesu apoptózy, může docházet k
asymetrickému multipolárnímu dělení za vzniku aneuploidních
buněk s genovými mutacemi či chromosomální nestabilitou.
Poznámka: K
chybné mitóze může docházet též působením některých
chemických látek, které se navazují na mikrotubuly
a brání jim v polymeraci či depolymeraci. Depolymerace
cytoplasmatických mikrotubulů a polymerace nových mikrotubulů
(astrálních, polárních, kinetochorových) kolem centrosomů
při jaderné membráně, vytvářejících dělicí
vřeténko, je jedním z klíčových článků při mitóze
buněk. Příslušné anti-tubulinové látky (inhibitory
mikrotubulů) se proto označují jako mitotické jedy.
Z přírodních rostlinných látek je to např. kolchicin
(alkaloid obsažený v ocúnu), který způsobuje inhibici
polymerace mikrotubulů, nebo taxol (alkaloid paclitaxel
obsažený v tisu) který způsobuje inhibici depolymerace.
Cíleného zásahu mikrotubulárních inhibitorů do dělení
buněk však lze využít pro zastavení růstu nádorových
buněk (§3.6 "Radioterapie", pasáž "Chemoterapie").
Imunitní
zánik buněk
V mnohobuněčných prokaryotních organismech dochází ke
složitým interakcím různých specializovaných buněk. V
průběhu evoluce se vyvinul imunitní systém,
jehož úkolem je chránit organismus před cizorodými
buňkami - především infekcí vnějšími vetřelci,
ale i před vlastními poškozenými či zmutovanými buňkami.
----....... Hlavními biochemickými molekulami,
zprostředkovávajícími imunitní ochranu, jsou proteiny ze
skupiny imunoglobulinů. I když imonoglobuliny
mohou indukovat i apoptózu, hlavním mechanismem imunitní
likvidace nežádoucích či "podezřelých"
buněk je aktivace komplementů - membránových
glykoproteinů C1-C9, které svými proteolytickými účinky
atakují cytoplasmatické buněčné membrány a způsobují
jejich penetraci. Buňka zaniká
a uvolněné chemické látky způsobují zánětlivou reakci s
kumulací leukocytů. Na rozdíl od apoptózy se zde jedná o vnější
proteolytickou likvidaci buňky. Dalším mechanismem imunitní
cytocidy je indukce fagocytózy - fixní Fc
oblast navázané protilátky se specificky váže na Fc receptor
některých typů leukocytů, zejména makrofágů, které pak
rozpoznávají a následně fagocytují nádorové buňky.
............
Tyto mechanismy buněčné likvidace se používají v biologicky
cílené terapii nádorových onemocnění s použitím monoklonálních
protilátek (§3.6 "Radioterapie",
pasáž "Monoklonální protilátky").
Další
podrobnosti stavby buněk a jejich chemických a biologických
funkcí leží již mimo rámec tohoto fyzikálně zaměřeného
pojednání. Přejdeme proto k našemu hlavnímu tématu –
biologickým účinkum ionizujícího záření :
Mechanismy
účinku záření na živou hmotu
Volné radikály
Jedním ze základních chemických jevů při ozáření látek,
zvláště látek obsahujících vodu a složitější
sloučeniny, je tvorba volných radikálů.
Volné radikály jsou takové atomy a molekuly, které mají na
poslední orbitě elektronového obalu jeden nebo více
nespárovaných elektronů. Takový atom či molekula je pak
značně nestabilní a reaktivní*). Snaží se
dostat do rovnovážného stavu tím, že získá z okolních
molekul jiný elektron "do páru". Při této reakci se
molekula, která elektron ztratila, může stát novým
radikálem. Volné reaktivní radikály svými oxidačními a
redukčními účinky jsou schopny štěpit
různé druhy vnitřních molekulových vazeb v biomolekulách a degradovat
tak jejich chemickou strukturu, nutnou pro příslušné
biologické funkce.
*) Kromě volných radikálů podobné
vlastnosti vysoké reaktivity vykazují i některé jiné látky,
jejichž molekuly nemají nepárové elektrony. Je to např. peroxid
vodíku H2O2,
kyselina chlorná, nebo atomární kyslík O1. I tyto látky
vznikají při ozáření a podílejí se na biologických
účincích (zvláště za zvýšené přítomnosti kyslíku -
viz niže "kyslíkový efekt").
Volné radikály vstupují v
biologickém prostředí do mnoha reakcí. Je to např. lipoperoxidace
tuků (za vzniku aldehydů), oxidace proteinů, glykace
proteinů s glukózou, změny v řetězcích RNA a DNA, které
mohou vést k smrti buňky nebo k k mutacím
(viz níže).
Během miliónů let evoluce se
organismy částečně "naučily" využívat volné
radikály i ke svému prospěchu. Příkladem jsou bílé krvinky
obsahující prekurzory a enzymy, které jsou schopné generovat
volné radikály; ty se pak účastní likvidace bakterií ve
fagocytech. Z hlediska biologických účinků záření se zde
však budeme zabývat především takovými reakcemi volných
radikálů, které vedou k poškození buněk.
Určitými "protivníky"
volných radikálů jsou antioxidanty. Tyto
látky buď zabraňují vzniku volných radikálů, nebo volný
radikál přednostně oxiduje tuto látku, což působí proti
oxidaci uvnitř buňky. Nejznámějším antioxidantem je kyselina
askorbová (vitamín C), kyselina močová (v
krevní plazmě zabraňuje vzniku hydroxylových radikálů), cystein,
kyselina listová; z prvků pak např. selén,
hořčík, zinek, chrom, ...
Účinek ozáření na
buňky
Chceme-li si rámcově přiblížit účinky ionizujícího
záření na buňky, je třeba samostatně uvažovat dvě
základní situace :
× Silné
ozáření
(dávkou stovky Gy) => rozklad biochemických molekul, denaturace bílkovin v cytoplasmě a organelách,
zastavení veškerých životních funkcí, okamžitý zánik
buněk (v interfázi) - nekróza buněk.
× Slabší
ozáření
(desetiny až jednotky Gy) => zanedbatelný účinek na
cytoplasmu a organely, radiobiologický účinek
na DNA
může vyústit v mitotickou smrt
buňky - apoptóza, nebo změnu
genetické informace - mutace. Nebo vlivem reparačních
mechanismů nedojde k žádnému
účinku.
V našem pojednání se budeme zabývat
radiobiologickými procesy především při běžných
situacích malých a středních radiačních dávek desetiny,
jednotky nebo desítky Gy. Začneme účinky jednotlivých
radiačních kvant.

Co se tedy stane, když přilétající
kvantum ionizujícího záření vnikne
do buňky?
Podle obrázku "Buňka.gif" (který
si zde pro názornost uvádíme znovu) má eukaryotická buňka složitou
strukturu, takže záleží na tom, která konkrétní část
buňky je zasažena kvantem záření :
--> Pokud kvantum záření
zasáhne cytoplasmu a poškodí některou
bílkovinu v cytosolu, je tato molekula záhy odstraněna v
lysosomu a nestane se nic. Molekul proteinů v
cytoplasmě je velké množství a jsou neustále doplňovány
proteosyntézou v ribosomech.
--> Když kvantum záření zasáhne
některou buněčnou organelu - lysosom,
mitochondrii, mikrotubulus, je tato struktura opět záhy
nahrazena nově vytvořenou a v podstatě se opět nestane
nic.
--> Pokud však kvantum
záření zasáhne buněčné jádro a v něm deoxyribonukleovou
kyselinu DNA, může dojít k řadě závažných biologických
účinků, podrobně rozebíraných níže :
Dominantní
účinek záření na DNA, genotoxicita
Jak bylo výše zmíněno, ionizující záření způsobuje v
živé tkáni chemické a biochemické změny, které obecně
mohou poškozovat všechny části buněk, cytoplasmu,
jednotlivé organely. O reakci buněk na ozáření však
rozhoduje především chování DNA. Jaderná deoxyribonukleová
kyselina (DNA) je biochemicky nejdůležitější
makromolekulou v buňce - jsou v ní obsaženy základní
informace o struktuře a funkci buňky. Zásah do biochemické
struktury DNA může způsobit, že buňka přestane vyrábět
potřebnou bílkovinu, nebo může tvořit změněné
"cizí" bílkoviny, které neplní svou funkci (někdy
mohou být i toxické).
Makromolekuly DNA jsou dominantními
"terči" pro biologické účinky
ionizujícího záření - může zde docházet především ke
zlomům cukro-fosfátového řetězce a ke změnám bazí. Např.
oxidací na aminoskupině jako je adenin vzniká skupina OH, na
kterou se místo thyminu váže cytosin - vzniká chyba v
řazení aminokyselin do řetězce. Na dvojšroubovici
DNA tak záření může způsobovat řadu poškození (viz
obr.5.2.2b), z nichž hlavní jsou dva druhy přerušení či
"zlomů" :
× Jednoduché zlomy (SSB - single
strand break),
poškozující pouze jedno vlákno (řetězec) DNA. Tyto zlomy si
buňka zpravidla snadno opraví za pomoci enzymu DNA ligáza.
× Dvojité zlomy (DSB - double
strand break),
postihující obě vlákna (řetězce) DNA. Zde je oprava
podstatně obtížnější a často je neúspěšná. Dvojitý
zlom struktury DNA vede často k zániku buňky - k jejímu letálnímu
poškození, zaniká zpravidla apoptózou (podrobně
byla popsána výše v pasáži "Mechanismy buněčné smrti").
O mechanismech oprav poškození DNA bude pojednáno níže -
pasáž "Reparační procesy".
Fragmenty DNA,
mikrojádra
Při vzniku dvojitých zlomů DNA se často nepodaří tyto zlomy
opravit. Může pak dojít k oddělení většího fragmentu
DNA od původní dvoušroubovice DNA, který zůstává
v cytoplasmě a při dělení buňky může přejít do
cytoplasmy jedné z dceřinných buněk. Mikrojádra
jsou fragmenty chromosomů, obalené jadernou membránou.
Mívají velikost cca 1/10 jádra buňky a po chromatinovém
obarvení jsou dobře pozorovatelná v mikroskopu.
Při radiační
expozici sice dochází v buňkách k poškozování i jiných
biochemických molekul v cytoplasmě, cytoskeletu či organelách
- lipidů, sacharidů, proteinů a dalších. Těchto molekul je
však v buňkách obsažen velký počet (a jsou průběžně
doplňovány syntézou dalších molekul) a výraznější
účinek záření by nastal až při poškození většího
procenta těchto molekul; to nastává až při poměrně
vysokých dávkách desítky a stovky Gy. K výraznému
poškození DNA však dochází i při nižších dávkách
(desetiny až jednotky Gy), kdy vliv na ostatní biochemické
molekuly je ještě malý. Proto se při výkladu mechanismů
účinků ionizujícího záření na buňky soustředíme
především na účinky na DNA.
Pozn.: Některé
nové radiobiologické studie s použitím velmi tenkých
"mikrosvazků" nabitých částic (především
a a
protonů, bylo však prokázáno i na X-záření) ukázaly, že v některých případech přímé
poškození DNA není nezbytné pro spuštění
intracelulárních mechanismů poškození. I v případě ozáření
cytoplasmy může někdy vzniknout jakási
"dálkově indukovaná" odezva (bystander
response), vedoucí k radiačnímu poškození
buněk - apoptóze či genetickým změnám (srov. níže diskutovaný "Bystander efekt").
Jelikož poškození DNA vede k narušení či změně
genetických informací v buňce, hovoříme o genotoxických
účincích *) ionizujícího záření a jím indukovaných
chemických látek v buňkách. Celkově působí ionizující
záření jako cytostatikum (poškození buněk,
zastavení buněčného dělení) a mutagen
(poškození nebo pozměnění genetické informace). Pro
škodlivé účinky ionizujícího záření na organismus,
jednotlivé tkáně a orgány, se používá souhrnný název radiotoxicita.
*) Genotoxicitu vykazuje i
řada chemických látek, které do buněk
vstupují zvnějšku (metabolickou cestou organismu), nebo
vznikají uvnitř buněk (při vnitřním metabolismu buněk nebo
při ionizačním ozáření). Tyto látky vstupují do jader,
reagují s DNA a způsobují účinky deterministické
(mitotická smrt buněk - cytostatika, silnější ozáření)
nebo stochastické (mutace, vznik nádorů - dlouhodobé
působení karcinogenních látek nebo slabší radiace); viz
níže "Vztah dávky a biologického účinku".
Rovněž některé viry (retroviry, onkoviry)
mají vysokou genotoxicitu: RNA těchto virů je schopna,
působením reverzní transkriptázy, vstupovat do DNA
eukaryotních buněk a měnit jejich genovou sekvenci.
Nejsou známy žádné specifické genetické změny či
mutace, které by bylo možno přisoudit pouze
účinkům ionizujícího záření a odlišit je od změn
vyvolaných chemickým působením (vnějším nebo vnitřním).
Genetické účinky záření se projevují jen zvýšenou
frekvencí spontánně se vyskytujících mutací a
genetických změn.
Základní
stádia účinku ionizujícího záření na organismus
Nejdříve si radiační účinky přehledně rozebereme z
globálního hlediska celého organismu (v
dalším výkladu se pak opět vrátíme k induktivnímu postupu:
intracelulární mechanismy ® buňky ® tkáně ® orgány ® organismus). Proces účinku
ionizujícího záření na živou tkáň probíhá ve čtyřech
význačných etapách, lišících se svou rychlostí a hlavně
druhem probíhajících procesů; příslušné procesy jsou
schématicky zobrazeny na obr.5.2.1 :
- Fyzikální
stadium
Při interakci kvanta ionizujícího záření s hmotou
je energie záření předávána především
orbitálním elektronům v atomech za vzniku ionizace
a excitace (příslušné
procesy jsou popsány v §1.6).
Pokud mají uvolněné elektrony dostatečně vysokou
energii, mohou vytvářet celou kaskádu excitací a
ionizací dalších atomů. Při absorbované dávce 1Gy
v tkáni se vytváří přibližně 105 ionizací v
objemu každé ozářené buňky (o typické velikosti
cca 10mm). Tento primární proces je velmi rychlý (prakticky okamžitý, rychlost kvant je rovna
nebo blízká rychlosti světla),
trvá jen cca 10-16-10-14 sekundy.
- Fyzikálně-chemické
stádium
Ionizace a excitace vedou k narušení
chemických vazeb mezi atomy a molekulami.
Nastávají sekundární fyzikálně-chemické procesy interakce
iontů s molekulami, při nichž dochází k disociaci
molekul a vzniku volných radikálů
(např. z vody H2O vznikají vodíkové kationty H+ a
hydroxylové anionty OH- a
nestabilní produkty schopné oxidace H2O2, HO2). I tento
proces je velmi rychlý, netrvá déle než 10-14-10-10sec.
- Chemické stádium
Vzniklé ionty, radikály, excitované atomy a další
produkty reagují s biologicky
důležitými organickými molekulami
("atakují" molekuly DNA, RNA, enzymů,
proteinů) a mění jejich složení a funkci. Typickou
poruchou na molekulární úrovni jsou zlomy
řetězců v molekule DNA - buď zlom jen
jednoho vlákna cukro-fosfátového řetězce, nebo
úplný zlom dvojvlákna DNA. Dále mohou vznikat
poškození purinových a pyrimidinových bazí,
atypické vazbové "můstky" (cross-linky)
uvnitř dvouvlákna DNA, lokální denaturace a další
chemické změny - obr.5.2.2b. Jednotlivé "genotoxické"
procesy tohoto chemického stádia trvají různě
dlouhou dobu - od tisícin sekundy do řádově jednotek
sekundy, v závislosti na transportní době reaktivních
složek z místa svého vzniku do místa lokalizace
napadené biomolekuly.
- Biologické
stádium
Molekulární změny v biologicky důležitých látkách
(v DNA, enzymech, proteinech) mohou vyústit ve funkční
a morfologické změny v buňkách, orgánech i
v organismu jako celku. Časová délka této fáze se
pohybuje od několika sekund na buněčné úrovni,
několik dní v tkáních a orgánech, až po léta na
úrovni celého organismu. Různorodost a delší
časové rozvržení biologických změn souvisí se
složitostí biochemických a metabolických pochodů v
živých organismech a s působením řady
zpětnovazebních mechanismů. Na úrovni celého
organismu se biologické stádium při vysokých
dávkách záření může somaticky projevit již po
několika desítkách minut, při středních dávkách
během několika dní - akutní poškození či nemoc z
ozáření v důsledku zničení velkého počtu buněk.
Při nízkých dávkách může však zahrnovat dobu
latence několika let nebo i desítek let (pozdní
stochastické účinky). Konkrétní druhy biologických
účinků ionizujícího záření jsou podrobněji
popsány níže.

Obr.5.2.1. Schématické znázornění význačných procesů a
jejich časové posloupnosti při účincích ionizujícího
záření na živou tkáň.
Pozn.: Měřítko na časové ose je v
zásadě logaritmické, avšak v některých úsecích je
poněkud upraveno tak, aby bylo možno přehledně zakreslit
jednotlivé děje.
Pouze fyzikální a chemické stádium je
závislé na fyzikálních parametrech záření,
zatímco následná radiobiologická reakce buněk je určena
pouze biologickými vlastnostmi konkrétních
druhů buněk. Z obr.5.1.1 je mimo jiné vidět, že ve
většině případů interakce kvant ionizujícího záření s
živou tkání nedochází k žádnému účinku.
Je to tehdy, když:
J Dojde k rekombinaci volných
radikálů dříve, než tyto stačí reagovat s biologicky
důležitými látkami;
J Reparační mechanismy na úrovni buňky úspěšně opraví
poškození DNA či jiných látek;
J Buňky usmrcené zářením jsou rychle nahrazeny
dělením zdravých buněk - kompenzační proliferace
buněk;
J Imunitní mechanismy organismu rozpoznají a zlikvidují
geneticky zmutované buňky.
K radiačním účinkům na organismus dochází
především za dvou okolností:
N
Když je organismus ozářen vysokou dávkou záření a zanikne
příliš mnoho buněk, které organismus není schopen
včas nahradit;
N
Když reparační mechanismy na úrovni buněk neopraví
úspěšně a správně všechna poškození a imunitní systém
organismu včas nerozpozná a neeliminuje
mutované buňky, které se dále dělí.
Všechny tyto situace, které vyústí nebo nevyústí v
biologické účinky, budou podrobněji rozebírány níže.
Jen malá část
absorbované energie záření se přeměňuje na disociační a
vazbové energie chemických reakcí, převážná většina
energie se v konečném důsledku mění na teplo.
Při dávkách používaných v biologických aplikacích je
však toto radiační zahřívání zanedbatelné.
Zásahový a radikálový mechanismus
radiačního účinku na buňky
Vraťme se nyní k intracelulárním procesům radiačního
účinku, k vlivu na DNA. K poškození struktury DNA dochází
dvěma základními mechanismy :
- Zásahový
mechanismus
"přímého
účinku", podle něhož poškození důležité
části buňky, především jejího jádra a DNA,
nastává při přímém zásahu kvantem
záření, při němž dochází k lokální absorbci
energie, ionizaci a následné chemické změně
zasažené struktury (obr.5.2.2b nahoře; na obr.5.2.1 to
odpovídá horní větvi fyzikálně-chemického
stádia). Vzhledem k velmi malé velikosti cílových struktur (molekula dvoušroubovice DNA má průměr
zhruba jen 2 nanometry) však tento
zásahový mechanismus má pouze druhořadý
význam, neboť pravděpodobnost takových
"přímých zásahů" je poměrně nízká,
takže citlivost živé tkáně k záření by byla
podstatně menší než se pozoruje. Přímý účinek se může poněkud výrazněji
projevovat v případě hustě ionizujícího záření
(jako je alfa, protony). Skutečně
pozorovaná radiosenzitivita živé hmoty je proto
způsobena především druhým mechanismem :
- Radikálový
mechanismus
"nepřímého
účinku" vychází z toho, že každý
organismus je složen především z vody (tvoří téměř 80%), v níž
jsou rozptýleny biologicky aktivní látky. Interakce
záření s živou tkání, a tedy i s buňkami, bude
proto probíhat především na molekulách
vody.
Vlivem ionizace bude docházet k radiolýze
vody,
přičemž vznikají i velmi reaktivní
volné radikály H, OH a produkty schopné oxidace (H2O2, HO2). Tyto
reaktivní zplodiny pak napadají organické molekuly
biologicky důležitých látek a chemicky je pozměňují či destruují (obr.5.2.2b dole; na obr.5.2.1 to odpovídá dolní větvi
fyzikálně-chemického stádia). Výsledkem může být řada
změn, které takto "nepřímo" ovlivňují
biochemické děje v buňkách, především v důsledku
poškození struktury DNA. Největší radiobiologickou
účinnost mají větší "shluky" radikálů,
které jsou schopny porušit oba řetězce DNA (viz níže "Duální radiační
akce", "LQ model"). I v případě, že k primární
interakci záření dojde ve vodě mimo buňku, mohou
vzniklé zplodiny vniknout do buňky a tam vykonat svůj
škodlivý účinek *).
*) Pro reflexi složitosti a
komplexnosti radiačně-biologických dějů viz též
tzv. bystander efekt dálkové
indukce radiačních účinků v tkáni, zmíněný
níže (v části "Účinky záření na
buňky").
Obr.5.2.2. Radiobiologické účinky na subcelulární
úrovni. a) Zásahový a radikálový
mechanismus účinku záření na živou tkáň.
Nahoře: Při vniknutí záření
do makromolekuly DNA dojde k ionizaci a přímému destrukčnímu
účinku. Dole: Ionizující záření
interaguje s molekulou vody, dochází k radiolýze vody : H2O
® H+
+ OH- - vzniku volných radikálů. Vysoce
reaktivní radikály H+ a OH- napadají složité organické molekuly a chemicky je mění.
Dochází k narušení DNA v jádrech buněk.
b) Různé typy
poškození DNA vlivem záření a chemických vlivů (hrubé schématické znázornění). c)
Radiační účinky během buněčného cyklu.
Zastoupení zásahového a
radikálového účinku
V organismech jsou složité biochemické molekuly rozptýleny
především ve vodě. Ve vodním
prostředí (roztoku, suspenzi) závisí podíl
přímého a nepřímého účinku na koncentraci
molekul biologicky důležitých látek. Při ozařování
vysušených vzorků se uplatňuje hlavně přímý účinek, u
vodních roztoků je podíl nepřímého účinku zpravidla
dominantní a tím větší, čím je nižší koncentrace.
Uvnitř buněk se nachází vodní prostředí s poměrně
vysokou koncentrací biologicky důležitých molekul -
nepřímý mechanismus je zde sice dominantní, ale je nutno
brát v úvahu i přímý účinek. Podíl přímého a
nepřímého účinku dále záleží na tom, zda se jedná o
řídce či hustě ionizující záření. Radikálový
mechanismus nepřímého účinku převažuje u řídce
ionizujícího záření. Hustě ionizující záření
vytváří natolik vysokou koncentraci radikálů, že dochází
k jejich časté rekombinaci dříve, než by tyto radikály
mohly vstupovat do reakcí s biologicky důležitými molekulami
- zvýšenou váhu proto může nabývat přímý účinek.
Pozn.: Při vývoji radiobiologických
představ snaha o vysvětlení účinků ionizujícího záření
na živou tkáň vedla k vyslovení dvou základních teorií -
starší zásahové a novější radikálové
teorie. Jejich úloha a podíl na radiačních účincích byl
později upřesněn a zdokonalen mechanismem duální radiační
akce a lineárně-kvadratickým modelem rozebíraným níže.
Kyslíkový faktor
Účinek ionizujícího záření závisí též na přítomnosti
kyslíku - tzv. kyslíkový efekt. Za
přítomnosti kyslíku vznikají při radiolýze vody silně
oxidující peroxydové radikály, které reagují
nevratně s atomy v DNA. Přítomnost kyslíku tedy zvyšuje
radiační účinky, především u řídce
ionizujícího záření. U hustě ionizujícího záření, kde
je zvýšený podíl přímého zásahového mechanismu (a též
zvýšená rekombinace radikálů), je kyslíkový efekt méně
významný. Kyslíkový efekt se v některých případech může
výrazně uplatňovat v radioterapii (§3.6, část "Fyzikální
a radiobiologické faktory radioterapie").
Mechanismus
duální radiační akce, molekulárně-biologický proces
Radikálový mechanismus byl později dále zdokonalen a
upřesněn na základě poznatků molekulární biologie.
Pro výsledný biologický účinek je významná nejen celková
energie (dávka) předaná tkáni, ale i prostorová
distribuce této energie v elementárních objemech,
jakož i časové rozložení dávky. Mikrodozimetrickým
rozborem distribuce dávky záření a sledováním
chromozomálních aberací se zjistilo, že radiační
poškození buňky závisí na hustotě ionizace
v kritickém místě. Ukázalo se, že k poškození buňky je
zapotřebí dosažení určité kritické hodnoty lokální
hustoty energie v daném místě a čase (prokázali
to v r.1972 H.H.Rossi a A.M.Keller). K
poškození buňky dochází při kombinaci dvou
primárních dějů *) odehrávajících se na dvojvláknech
nukleové kyseliny DNA v jádře buňky - duální
radiační akce, přičemž pravděpodobnost poškození
je závislá na počtu vzniklých zlomů a na působení
reparačních procesů - jedná se o komplexní molekulárně-biologický
děj.
*) Porušení jen jednoho vlákna
(řetězce) DNA mohou reparační mechanismy buňky (viz níže)
zpravidla snadno opravit - jedná se o subletální
("potenciálně letální") poškození. Současné
poškození obou řetězců DNA v blízkých místech vede
většinou k letálnímu účinku na buňku. Buněčné
reparační procesy na DNA neproběhnou okamžitě, ale mají
určitou dobu trvání (cca desítky minut). Při vyšší
intenzitě (dávkovém příkonu) i řídce
ionizujícího záření se proto zvyšuje pravděpodobnost
případů, že i zlom druhého vlákna DNA nastane dříve, než
proběhne oprava prvního vlákna, čímž dochází zpravidla k
letálnímu poškození buněk - jednotlivá subletální
poškození se kumulují v letální. Biologický účinek pak
závisí nejen na celkové radiační dávce, ale i na jejím
časovém rozvržení - tzv. efekt dávkového příkonu
(diskutovaný níže v části LQmodel); při vyšším dávkovém
příkonu nastává větší radiobiologický účinek.
 |
Schématické porovnání účinků
beta a alfa záření na DNA.
Nahoře:
Elektrony beta s nízkou hustotou ionizace způsobují v
DNA převážně jednoduché zlomy, které si buňka
dokáže opravit.
Dole:
Částice alfa s vysokou hustotou ionizace vyvolávají v
DNA dvojité zlomy, které zpravidla vyústí ve smrt
buňky apoptózou. |
Částice "řídce" ionizujícího
záření, tj. beta a gama, vytvářejí při svém průchodu
kritickým místem většinou pouze po jednom primárním
narušení (zlomu), takže k definitivnímu vzniku poškození je
třeba průchodu dvou jednotlivých částic
daným místem rychle po sobě (tzv. b-proces) - počet
těchto poškození pak závisí převážně na druhé
mocnině dávky, pro menší dávky je poškození výrazně
nižší. Částice "hustě" ionizujícího záření
(alfa, neutrony, protony) jsou schopny při jediném průchodu
kritickým místem vyvolat dvě a více primárních poruch (tzv.
a-proces),
což stačí ke vzniku reálného poškození, takže počet
poškození, tj. radiační účinek, je zde přímo
úměrný dávce záření; poškození zde vzniká
snadněji, tyto druhy záření mají vyšší
biologickou účinnost, což odráží výše uvedený jakostní
faktor Q. Z matematické analýzy těchto dějů (a- a b-procesů, jakož i
procesů buněčné reparace a repopulace) vychází tzv. lineárně-kvadratický
LQ-model závislosti radiačního účinku na dávce; je odvozen a podrobně diskutován níže - pasáž
"Vztah dávky a radiačního účinku",
část LQmodel.
Chromozomové aberace
Jelikož makromolekuly DNA jsou vázány v chromozomech, poškození
DNA se může projevit ve změnách tvaru,
uspořádání a struktury chromozomů - vznikají tzv. chromozomové
aberace, pozorovatelné v mikroskopu. Byla pozorována
celá řada různých abnormalit chromozomů, které se dají
rozdělit na dvě základní skupiny:
× Numerické aberace spočívající v
abnormálním počtu chromosomů, jejichž vlastní struktura je
neporušená. Vznikají při dělení buněk, kdy může
docházet k chybám při rozchodu chromozomů do dceřinných
buněk. Může tak vznikat polyploidie (znásobení
celé chromozomové sady 3× či 4×), nebo aneuploidie (numerická odchylka jen
určitého konkrétního chromozomu, který může být znásoben
3× či 4×, nebo
naopak zredukován - 1×, či zcela
ztracen).
× Strukturní aberace, kdy je porušená
struktura chromozomu v důsledku chromozomových zlomů
(způsobených dvouřetězcovými zlomy DNA) a následné
přestavby. Strukturní aberace se dělí na balancované
(kde je množství původní genetické informace kvantitativně
zachováno) a nebalancované (kdy část genetické
informace chybí nebo přebývá). Pozoruje se několik druhů
změn struktury chromosomů: delece (část chromozomu
chybí - buď terminální na některém z konců, nebo
intersticiální uprostřed); duplikace (zdvojení
některého úseku chromozomu); inverze (dva zlomy na
jednom chromosomu, přetočení segmentu mezi zlomy a opětovné
spojení - mění se pořadí genetické informace); translokace
(výměna dvou odštěpených segmentů dvou chromosomů); fragmentace
(chromozom se rozštěpí na dva nebo více menších částí); prstencový
chromozom (delece konců obou ramének s následným
stočením a spojením zlomených konců); - a několik
dalších.
Chromozomové aberace se nejvýrazněji
uplatňují až při buněčném dělení, kde mohou buď
dělení znemožnit, nebo způsobit nerovnoměrné rozdělení
genetické informace do dceřinných buněk. Některé
chromosomální aberace jsou nevýznamné a prakticky neškodné,
jiné vedou k zániku buněk, některé způsobují mutace a
malformace. Závažné a mnohočetné chromozomové aberace se
pozorují v nádorových buňkách. Mikroskopické
(cytogenetické) sledování chromosomálních aberací má
velký význam i při studiu biologických účinků
ionizujícího záření a v radiační ochraně exponovaných
osob.
Účinky
záření na buňky
Výše zmíněné mechanismy radiačních účinků na
subcelulární úrovni vyúsťují v účinky na základní
stavební jednotky všech živých tkání - na buňky.
Při ozáření buňky příslušnou dávkou záření může
dojít v zásadě ke dvěma význačným typům poškození
(obr.5.2.1 vpravo):
- Smrt
buňky
Při značně vysokých dávkách záření (stovky Gy)
dochází vlivem výše zmíněných mechanismů k destrukci
a denaturaci důležitých složek
buněčného obsahu, což může vést k
bezprostřednímu usmrcení buňky i v
"klidovém" období, tzv. interfázi
(intervalu mezi dvěma buněčnými děleními) - dojde k
nekróze buňky. Daleko častějším
typem zániku buňky však je tzv. mitotická
smrt buňky, k níž dochází v průběhu
buněčného dělení - mitózy. V důsledku ozáření
může dojít k inhibici buněčného dělení. Buňka
poškozená v některé fázi buněčného cyklu může
pokračovat ve svém metabolismu, ale není schopna
projít mitózou, která klade vysoké nároky na
správné podmínky pro přeskupení sub-celulárních
struktur. Zde se tedy poškození neprojeví okamžitě,
ale až tím, že buňka není schopna se dále dělit -
podlehne apoptóze (viz
níže "Mechanismy buněčné smrti"). Mitotická smrt
buňky nastává i při menších dávkách (jednotky
Gy), které nestačí na vyvolání přímé smrti buňky
v interfázi. Ukazuje se tedy, že buňky, které se rychle
dělí, mají vyšší radiosenzitivitu
(mitotická smrt je
převládajícím typem buněčného zániku v důsledku
ionizujícího záření).
- Změny
genetické informace buňky - mutace
Při menších dávkách záření nedochází
bezprostředně k usmrcení buňky ani k zástavě
buněčného dělení, avšak vzniklé radikály mohou
vyvolat chemické změny v DNA (deoxyribonukleová
kyselina), které se někdy nepodaří opravit; a tím i
změny v chromozomech nesoucích zakódované genetické
informace. Tyto změny cytogenetické informace
- mutace - se pak při dělení mohou přenášet
na další buněčné generace. Podle svého rozsahu se
mutace rozdělují na bodové neboli genové
a chromozomové (chromozomové aberace
či změny počtu chromozomů). Z hlediska
reprodukčního se mutace dělí na somatické,
které se projevují jen u konkrétního ozářeného
jedince v ozářené tkáni (kde mohou vést k pozdnímu
somatickému poškození a vzniku zhoubných nádorů
- §3.6 "Radioterapie", pasáž "Kancerogeneze"), a na gametické mutace u
zárodečných buněk, které se mohou přenášet na
další generace v potomstvu ozářených osob (malformace).
Ozáření buněk vede tedy k řadě škodlivých
změn (radiotoxicita), z nichž sice značná
část může být reparačními mechanismy organismu napravena,
avšak část může vést ke zničení buněk a některé změny
(např. v kódu DNA) mohou být trvalé nebo se mohou
reprodukovat. Na účinky ionizujícího záření jsou citlivé
zejména tkáně s intenzívním dělením buněk, jako jsou
např. krvetvorné nebo nádorové, sliznice, vyvíjející se
plod (zvláště v počátečních stádiích vývoje).
Radiační
účinky během buněčného cyklu
Účinek záření na buňky závisí, vedle zmíněných
fyzikálně-chemických faktorů, i na druhu buněk a na časové
fázi v buněčném cyklu, kdy k ozáření došlo.
Dělení
buněk - buněčný cyklus
Buněčný cyklus je
posloupnost časově uspořádaných dějů, kterými buňka
prochází v periodě mezi svými děleními -
je to období od vzniku určité buňky předchozím dělením
mateřské buňky na dvě dceřinné, až do stádia, kdy dojde
opět k rozdělení na dvě buňky dceřinné (jen velmi
schématicky je znázorněno na obr.5.2.2c). Doba trvání cyklu
(tzv. generační doba) je různá pro různé druhy
buněk: u rychle se dělících buněk je to jen 20-24 hodin, u
jiných probíhá dělení jen 2-krát do roka (např.
hepatocyty), některé se nedělí vůbec (neurony, buňky oční
čočky). Základní rozdělení buněčného cyklu je na
"klidové" období interfáze G mezi
dvěma děleními (fáze G
- angl. gap=mezera) a fázi M
vlastního buněčného dělení, mitózu (řec. mitos=nit,vlákno). Podrobněji se buněčný cyklus
eukaryotických buněk dělí na několik fází (obr.5.2.2c):
¨ G1 fáze -
postmitotická - po proběhlém dělení nastává
období růstu buňky (angl. Growth=růst), syntéza RNA, proteinů. V buňce probíhají
fyziologické procesy, dané typem konkrétní buňky a její
funkcí v organismu. Trvá asi 10-12 hodin.
¨ G0 fáze -
klidová. V průběhu G1 fáze může buňka tuto fázi
(a celý buněčný cyklus) opustit a vstoupit do klidové tzv. G0
fáze, kde se již dále nedělí. Dochází k tomu
zvláště u plně diferencovaných buněk jako jsou neurony.
Některé buňky jsou schopny v případě potřeby stav G0
opustit, přejít do G1 fáze a opět se začít dělit (např.
hepatocyty), zatímco neurony zůstávají ve stavu G0 trvale a
již se nedělí.
¨ S fáze -
syntetická - DNA se replikuje na dvojnásobný počet
(zdvojení genetického materiálu). Doba trvání je cca 6-10
hodin.
¨ G2 fáze -
premitotická - dochází ke zdvojování organel a
tvorbě struktur potřebných pro dělení buňky. Trvá asi 2-4
hodiny.
¨ M fáze -
mitotická - dochází k jadernému dělení (karyokineze)
a posléze dělení celé buňky (cytokineze).
Mitotická fáze, která trvá cca 1-2 hodiny, se celkově dělí
na 5 navazujících etap:
× Profáze
- přípravná fáze karyogeneze, během níž se rozpustí
jaderná membrána a rozbalují se chromosomy (chromosomy jsou
již po S-fázi zdvojené, ale jsou ještě spojené v centromeře).
Cytoplasmatické mikrotubuly depolymerují a uvolněný tubulin
je použit k polymeraci tří druhů nových mikrotubulů v
oblasti jádra: - astrální mikrotubuly, rozbíhající
se radiálně od obou centrosomů; - polární mikrotubuly,
vytvářející mezi centrosomy dělicí vřeténko; - kinetochorové
mikrotubuly, zúčastňující se tahu rozdělených
chromosomů k pólům vřetémka.
× Metafáze
- chromosomy se seřazují do ekvatoriální roviny vřeténka,
vzniká tah na opačné strany k pólům vřeténka.
× Anafáze
- dochází k roztržení chromosomů na dvě stejné části
zkracováním mikrotubulů dělicího vřeténka.
× Telofáze
- zaniká dělicí vřeténko, chromosomy se soustřeďují do
dvou nových jader, kolem nichž vzniká jaderná membrána. Tím
je zakončena karyogeneze.
× Cytokineze
- vzniká cytoplasmatická přepážka mezi oběma částmi.
Dochází k tomu buď zaškrcením vlivem kontraktilního
prstence (u živočišných buněk); u kvasinek je to
pučením, u rostlinných buněk vyroste přehrádka mezi
buňkami od středu k okraji.
Mateřská buňka se tak rozdělí
na dvě identické dceřinné buňky *), které vstupují do
fáze G1; ® cyklus
se opakuje - pokud není zastaven kontrolními
uzly (popsanými níže), fyziologicky především restrikčním
G1-checkpoitnem, kdy je buňka uvedena do
"služebné" G0 fáze, dále se nedělí a vykonává
svou diferencovanou funkci..
Podstatně jednodušším způsobem
probíhá dělení prokaryotických buněk
(bakterií): jedná se o binární dělení,
při němž se buňka nejprve prodlouží do protáhlého tvaru,
replikuje svou DNA, začne uprostřed vytvářet přepážku,
čímž se posléze mateřská buňka rozdělí na dvě stejné
buňky dceřinné.
*) Buňky kmenové a
efektorové
U mnohobuněčných organismů s různými diferencovanými
tkáněmi je mechanismus dělení složitější. Zde se tkáně
skládají z buněk kmenových (mateřských,
klonogenních) a buněk dceřinných, efektorových.
Kmenové buňky jsou schopné neomezeného dělení, přičemž
jsou schopny produkovat jak identické buňky kmenové, tak
buňky dceřinné, nesoucí vlastnosti dané diferencované
tkáně - asymetrické dělení na dvě různé
buňky, identickou kmenovou a odlišnou dceřinnou buňku. Díky
svému dělení jsou kmenové klonogenní buňky
radiačně citlivější než efektorové buňky
dceřinné (které jsou kromě toho průběžně doplňovány
dělením buněk kmenových).
Asymetrické
dělení zajišťuje proces diferenciace, při
němž se buňky svou stavbou a funkcí přizpůsobují
specifické roli, kterou mají v organismu vykonávat. Všechny
buňky v organismu jsou totiž opatřeny stejnou genovou
výbavou, avšak v důsledku tohoto procesu v konkrétní buňce
dochází k realizaci pouze určité části genetické informace
(vlivem specifických transkripčních faktorů jsou v
buňce přepisovány jen určité geny, jiné se neuplatňují).
Dceřinné efektorové buňky zpravidla vstupují do klidové G0
fáze buněčného cyklu.
Kontrolní
uzly buněčného cyklu
Složitý proces buněčného dělení je řízen
několikastupňovou regulací. V klíčových místech
buněčného cyklu se nacházejí určité "kontrolní
uzly" či body (check point), v nichž se
"vyhodnocuje" stav buňky v dané fázi a její
schopnost pokračovat v cyklu (obr.5.2.2c). V kontrolních uzlech
je ověřováno, zda byly úspěšně dokončeny všechny děje
probíhající v příslušné fázi buněčného cyklu -
předtím, než buňka postoupí do dalšího stádia svého
cyklu. Hlavní úlohou kontrolních bodů je "dohled"
nad správností či poškozením DNA, aby bylo zajištěno
správné dělení buněk s maximálně bezchybným
přenosem genetické informace. Určité kontrolní
mechanismy patrně fungují průběžně v každém okamžiku
buněčného cyklu, avšak jejich činnost vyúsťuje v několika
význačnějších meznících jednotlivých etap:
Y První kontrolní bod G1 (G1-checkpoint)
či G1/S se nachází na konci fáze G1. Zde se rozhoduje, zda
bude buňka pokračovat v cyklu dělení, nebo přejde do
klidové G0 fáze. Kontrolní uzel G1 se někdy též nazývá startovní
(teprve od tohoto bodu může pokračovat nový bučný cyklus)
nebo restrikční - tvoří jakousi
"bariéru" pro pokračování cyklu, která se
překonává expresí cyklinu D, indukovanou růstovými
faktory; jinak zůstává buňka v klidové fázi G0.
Y Druhý kontrolní uzel se nachází v S-fázi
a kontroluje transkripci DNA; pozastavuje buněčný cyklus,
dokud není DNA úplně replikovaná.
Y Třetí kontrolní uzel G2/M,
umístěný na konci fáze G2 (G2-checkpoint),
kontroluje řadu faktorů rozhodujících o tom, zda je buňka
připravena k úspěšnému vstupu do mitózy. Dohlíží na
integritu DNA, zkoumá zda není DNA poškozená a zda byla
dokončena její syntéza, oddaluje začátek mitózy, v
případě poškození DNA zastavuje buněčný cyklus.
Y Poslední kontrolní uzel M (M-checkpoint)
přichází ke slovu až při mitóze v anafázi a
kontroluje správný průběh a zakončení mitózy. Signální
dráha mitotického kontrolního uzlu M kontroluje m.j. správné
připojení kinetochoru chromosomu k dělicímu vřeténku.
Pokud kontrolní mechanismy najdou nesrovnalost v
některém z kontrolních uzlů, buněčný cyklus se přeruší:
spustí se buď reparační procesy, nebo v
případě závažnějšího neopravitelného poškození (jako
je dvojitý zlom DNA) se zahájí apoptóza
(obr.5.2.2c uprostřed) - "programovaná" buněčná
smrt podrobněji popsaná níže.
Radiosenzitivita buněk a tkání
Největší radiosenzitivita se projevuje při zasažení buňky
v pozdní G1 a premitotické G2 fázi, kdy mechanismy
kontrolních bodů mohou zastavit průběh buněčného cyklu.
Poněkud menší citlivost je v M fázi a v přechodu mezi fází
G1 a S, nejmenší citlivost pro buňky ve fázi G0.
Živá tkáň je tvořena směsí buněk v
nejrůznějších stádiích buněčného cyklu. Průměrná
doba, během které se buňky nacházejí v určitých fázích,
závisí na druhu tkáně. Tkáně rychle rostoucí
s krátkým buněčným cyklem mají vyšší časové
zastoupení buněčných fází G2 a M, takže jsou citlivější
na záření. Pomalu rostoucí dobře
diferencované tkáně (jako jsou nervové, svalové, vazivové)
jsou relativně radiorezistentní, neboť
většina buněk setrvává poměrně dlouho ve fázi G1 a část
je dokonce v klidovém stadiu G0. Různá radiační citlivost
jednotlivých druhů tkání je důležitá z hlediska radiační
ochrany a hraje klíčovou úlohu při léčbě
zářením v radioterapii (§3.6
"Radioterapie"), kde se používá
frakcionované ozařování a někdy též kombinace chemoterapie
a radioterapie, m.j. pro dosažení určité synchronizace
buněčného cyklu s cyklem ozařovacím.
Radiační poškození ~Ţ otrava
organismu chemickým jedem
Z výše uvedeného popisu mechanismu
škodlivého účinku ionizujícího záření na živou tkáň
vyplývá, že radiační účinky nejsou žádnými
"tajemnými" neobvyklými jevy vyvolanými
neviditelným zářením. Konečný účinek je chemický
či chemicko-biologický: záření pouze dodá do tkáně energii
(ve specifické formě ionizace), která nakonec vede k produkci
"jedu" (volných radikálů)
a k vnitřní chemické "otravě"
buněk - úhrnně hovoříme o radiotoxicitě.
Je to konec konců podobné, jako kdybychom do tkáně difuzně
aplikovali např. peroxid vodíku či jinou vysoce
reaktivní chemikálii, mající denaturační či genotoxické
účinky. Mezi otravou chemickým jedem a radiotoxicitou jsou
tři charakteristické rozdílnosti:
1. Molekuly chemického jedu jsou do tkáně dodány zvenčí,
pronikají tam metabolickou cestou (krevní, lymfatickou),
hromadí se nehomogenně v určitých typech buněk. Ionizující
záření dodává pouze energii a toxické látky vznikají uvnitř
buněk a tkání, přičemž jsou distribuovány
prakticky homogenně v celém objemu ozářené
tkáně, uvnitř všech buněk. Složitější
je situace při vnitřní kontaminaci radioaktivní látkou,
kdy je její distribuce nehomogenní - v cílových tkáních a
orgánech, v závislosti na chemickém složení. A též u
záření s krátkým doletem v tkáni (a,b), kdy je ozářeno jen
blízké okolí interakčního místa.
2. Rozdíl v charakteru závislosti účinku na
dávce. Při aplikaci menších koncentrací chemických
toxických látek přežívají téměř všechny buňky a teprve
při překročení určité prahové koncentrace dojde k zániku
prakticky všech buněk v populaci. Při expozici ionizujícím
zářením již malé dávky mohou mít za následek zničení
určitého malého procenta buněk, avšak i po obdržení
značně vysokých dávek určitá část buněčné populace
přežívá (viz níže "LQ model"). Radiobiologický
účinek má statistický pravděpodobnostní
charakter, řídí se Poissonovým rozdělením *)
pravděpodobnosti. Po ozáření množiny N0 buněk přežívá N buněk, přičemž N/N0 ~ e-(počet
letálních poškození). Tato
závislost je matematicky realizována v lineárně-kvadratickém
modelu, odvozeném níže.
*) Poissonovo rozdělení
obecně modeluje náhodné děje v souboru velkého počtu
elementů za situace, kdy pravděpodobnost daného procesu je
relativně malá vzhledem k celkovému počtu elementů. Máme-li
soubor elementů (atomů, buněk) o okamžitém počtu N,
v němž je daný stochastický proces (rozpad jader,
poškození buněk) způsoben řídícím faktorem f
(čas, dávka) s pravděpodobností l, pak element faktoru Df způsobí úbytek
členů souboru o DN = -l.Df elementů. Vede to k diferenciální rovnici pro
závislost počtu zbylých elementů N na působícím
faktoru f: dN/df = -l , jejímž řešením za okrajové počáteční
podmínky N(f=0)=No je exponenciální funkce N = No.e-l.f. Podrobněji je
odvozeno a diskutováno v §1.2, část "Obecné zákonitosti přeměny atomových
jader" pro případ
radioaktivního rozpadu.
3. Další rozdíl v poškození DNA způsobený běžnými
faktory (jako jsou oxidanty z metabolismu) a ionizujícím
zářením spočívá v tom, že po ionizačním ozáření
dochází ke zvýšenému výskytu shluků poškození
DNA (zvláště u hustě ionizujícího záření); u běžných
neradiačních poškození je toto rozložení rovnoměrnější.
Reparační
procesy
Buňky nejsou proti radiačním poškozením úplně bezbranné,
při ozáření živé tkáně nedochází pouze k jednosměrným
a nevratným změnám vedoucím k poškození buněčných
struktur a jejich funkcí. V biologickém stádiu radiačního
účinku probíhají též procesy protichůdné - procesy reparace
a regenerace, které vedou k obnově
schopnosti buněčného dělení a funkce tkání a orgánů. Radiační změny v živých
tkáních tedy mohou být reverzibilní.
V raných etapách evoluce buňky žily pod
vlivem krátkovlnného záření, především ultrafialového.
Během evoluce se musely vyvinout mechanismy, které udržují
integritu DNA (relativní stabilitu genetické informace).
Enzymatické reparační systémy, které jsou schopné
eliminovat poškození DNA (radiačně či chemicky indukované),
byly pro buňky pozitivním evolučním faktorem
a většinou se zachovaly v buňkách dosud. Za
zmínku stojí též okolnost, že reparační systémy nejsou
úzce specifické jen pro jednu škodlivinu.
Probíhají v podstatě dva druhy
reparačních procesů na dvou různých úrovních:
- Nitrocelulární
reparace
je schopnost buňky opravit svoje
životně důležité struktury, poškozené
ionizujícím zářením či jiným vlivem (a to dříve,
než dojde k dalšímu poškození, které by již opravu
zpravidla znemožnilo). Na úrovni postižené
buňky působí jednak antioxidanty
chránící před reaktivními radikály, dále dochází
k enzymatickým procesům, jimiž jsou napravovány
poškozené struktury DNA a procesy odstraňující ty z
nich, které již nelze opravit. Vlivem těchto
chromozomových reparačních mechanismů
může buňka během několika hodin od ozáření obnovit
svou schopnost dělení.
Reparační mechanismy na molekulární
nitro-buněčné úrovni spočívají v
biochemických procesech, které vedou k opravě
určitého typu poškození DNA. Poškození DNA aktivuje
kinázu ATM, která spustí
produkci proteinů pro opravu DNA - DNA ligázy
- a (přes mdm2) aktivuje a fosforyluje protein p53,
který působí jako transkripční faktor. V
počátečních fázích může p53 aktivovat opravu DNA
(přes proteiny GADD45) a zpomalit buněčný
cyklus (přes protein p21 kódovaný genem
WAF/CIP1) tak, aby stačila proběhnout reparace. Protein
p21 inhibuje cyklin-dependentní kinázy CDK a
zastaví buněčný cyklus v G1 fázi; v případě
správné funkce p53 je buněčný cyklus obnoven až po
odstranění chyb v DNA. Pokud p53 zjistí poškození
DNA přesahující možnosti opravy, zvýší se jeho
exprese a nastartuje se proces apoptózy buňky,
popsaný výše ("Mechanismy
buněčné smrti").
Reparační procesy jsou spojené s činností řady
(reparačních) enzymů, zvaných endonukleázy,
exonukleázy, polymerázy, ligázy. Při opravě
chromosomálních zlomů se uplatňuje např. protein nibrin.
Důležitou řídící úlohu v nitrocelulárních
reparacích hraje protein p53,
"genetický strážce", zmíněný výše v
části "Mechanismy buněčné smrti", pasáž "Apoptóza".
p53 vyhledává na DNA poškozená místa *): pokud
takové místo najde, naváže se na ně a iniciuje
produkci enzymů určeným k opravám DNA. Zároveň
spustí expresi proteinu p21, který zastaví
buněčný cyklus, dokud není poškozené místo
reparováno. Pokud je reparace neúspěšná, dochází
nakonec k apoptóze buňky.
*) Na "vyhledávání"
poškozených míst DNA se podílí bílkovina histon
H2AX, kolem níž je "navituta" DNA v
chromosomech. Hned po poškození DNA nastane v místech
poškození fosforylace, při níž se na H2AX
naváže fosfátová skupina. Tím se
"označí" místa, která je nutno opravit - do
fosforylované části H2AX "zapadne (jako klíč do
zámku)" určitá část vazebního proteinu 53BP1
pro p53, který nastartuje proces opravy přrušeného
vlákna DNA.
¨ Jednoduché
zlomy DNA mohou být opraveny poměrně snadno
tzv. excizní reparací: enzymatickým
působením endonukleáz je poškozený úsek řetězce
DNA "vyříznut", vzniklou mezeru pak enzym DNA-ligáza
nahradí "záplatou" dosyntetizovanou na
základě druhého "sesterského" řetězce,
jehož kontinuita zůstala zachována - tento řetězec
je použit jako předloha či šablona (template)
pro opravu poškozeného řetězce.
¨ Obtížná
pro buňku je reparace dvojitých zlomů
DNA, kdy je ztracena část informace na obou
řetězcích *). Tyto zlomy mohou být za určitých
okolností úspěšně opraveny určitými recipročními
rekombinačními procesy, kdy se poškozená místa
(opět s účastí enzymů) vzájemně rekombinují s
odpovídajícími nepoškozenými úseky
"sesterského" řetězce, které působí jako
matrice pro opravu vyříznutého místa poškozeného
vlákna DNA. Nebo mohou být poškozené úseky
"ignorovány" a "provizorně" spojeny
pro zachování integrity DNA.
*) Záleží též na struktuře
chromozomálního systému buňky. U haploidních
buněk (s jednou sadou chromozomů) již jednotlivé
dvojné zlomy DNA vedou k jejich inaktivaci. Většina
somatických buněk je však diploidní -
chromozomální systém je v nich zdvojen, takže
jednotlivé dvojné zlomy DNA lze často opravit. K
zániku buňky zpravidla vede současné poškození
dvojice homologických chromozomů, nebo větší počet
dvojných zlomů v různých místech chromozomálního
systému.
Jsou zde tedy známy dva mechanismy oprav:
- Homologní
rekombinace, při níž je oprava provedena
výměnou stejné nebo podobné (homologní)
sekvence DNA, jaká byla poškozena. Probíhá po
S-fázi, kdy DNA je již zdvojená a lze tedy najít
potřebný úsek v "sesterské" DNA jako
template. Podle tohoto komplementárního řetězce se
dosyntetizuje porušený úsek molekuly DNA; výsledkem
je většinou přesná oprava beze změny genetické
informace. Nalezení odpovídající homologní sekvence
ve složitém řetězci DNA je však obtížné, takže
častějším a jednodušším mechanismem je přímé
navázání:
- Nehomologní
spojování, non-homologous
end-joining (NHEJ), kdy se přerušené řetězce
DNA přímo napojí svými konci, bez nutnosti použití
homologické předlohy. Tento způsob je rychlejší a
jednodušší, avšak může být zdrojem chyb
v sekvenci DNA - změny genetické informace. Integrita DNA a životaschopnost buňky tím
může být obnovena; s "trochou štěstí"
poškozený a ztracený úsek nekódoval nic
důležitého (jen asi 5% genomu
kóduje funkční proteiny, většina sekvencí DNA je
jakési "genetické smetí", které je reliktem
spletité cesty evoluce)...
Nejobtížnější je reparace poškození obou
řetězců v tomtéž úseku, nebo v ne příliš
vzdálených místech.
Úspěšnost reparace
závisí na dávkovém příkonu. Čím vyšší
je dávkový příkon, tím větší je pravděpodobnost,
že i zlom druhého řetězce DNA nastane dříve, než
stačí proběhnout oprava prvního vlákna. V takovém
případě zpravidla dojde k letálnímu
poškození buňky, reparace je neúspěšná.
Chybné
mutagenní reparace
Reparační procesy však
jednak nemusí být úspěšné, jednak při nich může
docházet k novým chybám indukujícím mutace. Při
činnosti reparačních mechanismů existuje určitá
pravděpodobnost, že v místě poškození se do
řetězce DNA vloží chybný nukleotid
či série nukleotidů. Buňka se snaží udržet
integritu DNA (a tím svou životaschopnost) i za cenu
nedokonalých (chybných) oprav. Tato tzv. mutagenní
reparace umožní někdy buňce přežít,
avšak z hlediska celého mnohobuněčného organismu
vzniká riziko dalšího dělení zmutovaných buněk -
vznik stochastických účinků,
především riziko nádorového bujení. Z hlediska
celého organismu tedy pro radiačně poškozené buňky
platí heslo "mrtvá buňka = dobrá buňka".
- Regenerace
v buněčných populacích
Na úrovni postižené tkáně se
reparace radiačního poškození uskutečňuje náhradou
zničených buněk pomocí dělení
přežívajících (kmenových klonogenních) buněk,
které si zachovaly normální schopnost dělení -
jejich repopulací; tento proces trvá
dny až týdny. V některých případech je zničená
tkáň nahrazena afunkčním pojivem.
Pro konkrétní "radiační akci"
(zásah buňky kvantem ionizujícího záření) závisí
pravděpodobnost biologického účinku především na dvou
okolnostech:
1. Druh poškození DNA
(obr.5.2.2b). 2. Fáze buněčného cyklu, v
níž k poškození došlo (obr.5.2.2c).
Jednoduché zlomy vlákna (řetězce) DNA dokáží reparační
mechanismy zpravidla bezchybně opravit (pokud na to mají
"dostatek času"). Dvojité zlomy DNA, pokud k nim
dojde ve fázi G1 a G2, jsou rozpoznány v "check
pointech" a vedou většinou k zániku buňky (obr.5.2.2c
uprostřed). Poškození DNA, vzniklé ve stádiu po
"check-pointech", však nemusí být buněčnými
regulačními mechanismy rozpoznáno a může s ním dojít k
mitóze - zde je zvýšené riziko dělení buněk se změněným
genomem, které může vyústit v mutace (stochastické účinky)
- obr.5.2.2c dole. Při praktickém ozáření organismu jsou
jednotlivé buňky v tkáních v nejrůznějších fázích
svého buněčného cyklu a zároveň dochází k poškození DNA
různého druhu. Jednotlivé mikroskopické děje se proto v
průměru skládají ve výsledný radiobiologický účinek -
deterministický či stochastický.
Podstatně záleží též na rychlosti
buněčného cyklu. Buňky, které se rychle dělí, mají v
průměru méně času na opravu poškození vzniklého v jejich
DNA, takže budou více trpět následky neopravených nebo
chybně opravených poškození. Plyne z toho důležitý obecný
závěr: rychle se dělící buňky jsou
radiosenzitivnější.
Reparační a regenerační procesy vedou mimo
jiné k tomu, že rozdělení dávky na menší dílčí dávky v
dostatečných časových intervalech vede k menším
biologickým účinkům ve srovnání s toutéž dávkou
absorbovanou jednorázově. Resp. při stejné celkové
absorbované dávce se biologický účinek snižuje, pokud jí
bylo dosaženo při nižším dávkovém příkonu (čemuž
samozřejmě odpovídá delší čas expozice) - viz níže
"LQ model" - efekt dávkového příkonu.
Účinky záření na tkáňové úrovni
Shora rozebírané účinky záření na subcelulární a
buněčné úrovni jsou základním východiskem
k pochopení účinků na vyšších úrovních organizace - v
tkáních, orgánech, celém těle. Nejsou však východiskem
postačujícím! Platí zde známá obecná zkušenost, že systém
není jen prostým součtem svých prvků (resp. "organizovaný celek je více než
součet jeho částí").
Některé radiační účinky v živé tkáni jsou způsobeny
nejen základními buněčnými mechanismy, ale přistupují zde
i interakce různých tkáňových faktorů,
jakou jsou intracelulární komunikace
biochemickými signálními cestami, pohyb molekul a iontů
mezibuněčným prostorem, dělení buněk a obnova tkání. Na
úrovni orgánů a celého organismu k tomu přistupují
složité biologické vztahy mezi různými druhy buněk a
tkání při činnosti orgánů a funkční vztahy mezi
jednotlivými orgány v těle.
Biochemické
interakce buněk. Mimocílové dálkově indukované radiační
účinky - bystander efekt, abskopální efekt
Pohled klasické radiobiologie je do značné míry mechanistický:
k poškození dochází pouze u buněk, které
jsou zasaženy ionizujícím zářením nebo chemickým
činidlem, čímž dojde k poškození DNA nebo jiné důležité
struktury dané buňky. Tak tomu skutečně je
při ozáření množiny izolovaných buněk
(jako je kolonie bakterií). U vyšších organismů jsou však
buňky začleněny do tkání, v nichž
dochází k vzájemné biochemické interakci buněk
řadou složitých procesů (především regulačních).
Některé z těchto procesů (repopulace, redistribuce,
reoxygenace) jsou zmíněny níže v souvislosti se
závislostí biologických účinků na radiační dávce a
jejím časovém průběhu. Vzhledem k těmto interakcím buněk
lze očekávat, že na (radiční) poškození jedné konkrétní
buňky mohou určitým způsobem reagovat i
další okolní buňky v tkáni.
Tento proces byl
skutečně pozorován při experimentech s velmi úzkými ostře
kolimovanými svazky (micro-beam) záření a, kterými byly
ozařovány buňky v tkáňové kultuře. Zjistilo se, že po
ozáření cílových buněk i okolní buňky
jevily známky poškození, i když samy nebyly
ozářeny. K podobným výsledkům vedly i experimenty,
kdy vzorek ozářených buněk byl přenesen do kolonie buněk
neozářených. Tento pozoruhodný efekt by mohl být způsoben
zmíněnými biochemickými interakcemi buněk v tkáni.
Mechanismus tohoto jevu zatím není přesně znám. K
ovlivňování okolních buněk by mohlo docházet v zásadě
třemi cestami :
× Přes mezibuněčné prostředí
Buňky zasažené zářením mohou vytvářet určité difuzibilní
látky, které jsou schopny ovlivnit jiné sousední buňky.
Primárně ozářené a letálně poškozené buňky mohou do
svého okolí (mezibuněčné prostředí - extracelulární
matrix) "vysílat chemické signály" - uvolňovat
biochemické molekuly, účastnící se apoptózy nevratně
poškozených ozářených buněk (uvažuje se protein p53 či
ligand TRAIL, jak bylo zmíněno výše v pasáži
"Apoptóza"), či molekuly toxické, kyslíkové nebo
dusíkové radikály. Tyto látky mohou difundovat a vstupovat do
okolních buněk (nebo se vázat na příslušné receptory na
povrchu, aktivovat vnější signální dráhy apoptózy), v
nichž mohou způsobovat podobnou reakci, jako u zářením
přímo zasažené buňky.
× Přes mezibuněčná spojení
Mezibuněčná spojení (gap
junction) jsou uskutečňována
membránovými kanálky, zvanými konexony, o průměru
cca 1,5-2 namometry, kterými mohou procházet molekuly do
hmotnosti až 2 kDa. Při poškození jedné buňky většinou
dojde k rychlému uzavření kanálku, čímž se zabrání
poškození sousedních buněk. Pokud však nedojde zavčas k
inhibici této cesty přenosu, může docházet k přenosu
poškození na okolní buňky.
× Makrofágy
Konečně k apoptóze okolních nezasažených buněk by
mohla přispívat i činnost makrofágů, které vedle
vlastní apoptické buňky mohou napadnout i některé buňky
sousední.
 |
Bystander-efekt.
Radiační poškození jedné buňky může indukovat
poškození i některých okolních buněk, které nebyly
ozářeny. |
Pro tento efekt radiačních účinků indukovaných
v sousedních buňkách se používá název bystander
efekt (angl. bystander =
divák, okolostojící, čumil),
"efekt nezúčastněného diváka": okolní
přímo nezasažené buňky zde nejsou "nezúčastněným
pozorovatelem" radiačního poškození ozářených buněk,
ale jsou též "vtaženy" do tohoto procesu. Bystander
efekt tak poněkud zvyšuje celkový počet
radiačně poškozených buněk v ozářené tkáni (obr.5.2.4b).
Bystander efekt může u okolních buněk způsobovat apoptózu,
chromosomové aberace i mutace.
Pozn.:
Bystander-efekt byl pozorován nejen u radiačně poškozených
buněk, ale i u lokálního chemického cytotoxického
poškození.
Abscopální efekt
Jev, kdy dochází k biologickým změnám v neozářené části
biologického systému v důsledku reakce ozářené části, se
obecně označuje jako vedlejší, mimocílový
neboli abskopální efekt (lat.
ab = mimo,pryč; scopium = terč, cíl, úhel pohledu). Postradiační změny většinou nastávají v
buňkách a tkáních těsně sousedících s ozářenými okrsky
- jako je výše zmíněný bystander efekt. Byly však
pozorovány i "dálkové" abskopální
efekty. V radioterapii při lokálním ozáření jedné
nádorové léze někdy (bohužel vzácně) dochází k navození imunoefektu - imunogenní
buněčné smrti - i proti dalším metastázám téhož
nádoru (viz též §3.6, pasáž "Imunoterapie"). Přesný mechanismus
abskopálního imunoefektu zatím není znám, ale podílí se na
něm pravděpodobně masívní apoptóza či nekrotická smrt
nádorových buněk, ozářených vysokou radiační dávkou. To
vyvolá lokální zánětlivou imunitní reakci,
při níž se uvnitř ozářeného tumoru vytvářejí T-lymfocyty,
které se mohou specificky aktivovat pohlcením
antigenů z nádorových buněk. Tyto specificky aktivované
efektorové T-lymfocyty pak migrují do
neozářených sekundárních nádorů, kde zahájí cílenou "likvidační"
imunitní odpověď proti nádorovým buňkám daného typu,
které mají stejné antigeny (za účasti monocytů,
transformujících se v makrofágy).
Vedle tohoto velmi
žádoucího efektu se někdy diskutuje i nepříznivý
abskopální efekt v normálních zdravých tkáních,
který by mohl indukovat genomovou nestabilitu, buněčnou smrt,
nebo onkogenní transformaci buněk. Takový mechanismus však
nebyl prokázán, příčiny vedlejších účinků záření na
zdravou tkáň jsou pravděpodobně jiné (§3.6, pasáž "Vedlejší účinky radioterapie -
radiotoxicita, sekundární malignita").
Bylo by málo pravděpodobné, kdyby radiačně zmutované buňky
pouze migrovaly a založily vzdálené nádorové ložisko, aniž
by takové ložisko vzniklo v blízkosti ozářeného místa.
Mohla
by ale vzniknout situace, kdy ozáření způsobí snížení
imunity organismu, v důsledku čehož může v určitém místě
dosud "spící" klon zmutovaných buněk zahájit
nádorový růst. Takový složitý proces však asi nelze
považovat za radiační abskopální efekt..?..
Různá
radiosenzitivita buněk a tkání
Organismus je funkční celek tkání a orgánů, které nemají
stejnou citlivost k ozáření (radiosenzitivitu). Při stejné
absorbované dávce se v různých tkáních projeví rozdílné
biologické účinky. Při rozboru účinků záření na buňky
jsme dospěli k poznatku, že rychle se dělící buňky jsou
citlivější na radiační poškození. Tento základní
poznatek se projevuje i na tkáňové úrovni a někdy se
vyjadřuje pravidlem: "radiosenzitivita tkáně je
přímo úměrná reprodukční aktivitě a nepřímo úměrná
stupni diferenciace" *). Toto pravidlo je jen
přibližné, u konkrétních tkání a orgánů k tomu
přistupují specifické biologické vlivy (viz
níže "Lokální radiační účinky tkáňové a orgánové"). Tkáně a orgány mají
různou citlivost nejen na poškození buněčnou smrtí, ale
mají i rozdílnou vnímavost k uplatnění cytogenetických
účinků, k riziku vzniku nádorů.
*) Ta přímá a nepřímá úměrnost se
zde nemůže brát matematicky, ale jen jako vyjádření
rostoucího či klesajícího trendu. Nazývá se někdy
pravidlem Bergonie-Tribondeau, podle prvních autorů
kteří k němu empiricky dospěli.
Vztah
dávky a biologického účinku
Je samozřejmé, že biologický účinek záření je v prvé
řadě závislý na velikosti absorbované dávky, že s dávkou
roste. Z hlediska vztahu dávky a účinku rozlišujeme dva
základní typy radiobiologických účinků :
- Stochastické
účinky - mitogenní
Pokud dávka záření není velká, s naprostou
většinou poškození biologicky aktivních látek se
organismus úspěšně vyrovná svými reparačními
mechanismy. I při malých dávkách *) však
existuje určitá pravděpodobnost, že některá
poškození se opravit nepodaří (resp.
při opravě dojde k "chybě"), dochází k postradiační genové
nestabilitě, která může vyústit v mutace.
Pokud se mutované buňky dále dělí,
mohou vzniknout pozdní trvalé následky genetického
nebo nádorového charakteru. Jelikož takové následky
jsou zcela náhodné, individuální a
nepředvídatelné, nazývají se účinky
stochastické. Mají pravděpodobnostní charakter -
u jedinců z ozářeného souboru osob se poškození či
onemocnění vyskytují náhodně s
určitou pravděpodobností, která roste s dávkou. Za
stochastické účinky jsou odpovědné buňky, které přežily
radiační poškození, avšak radiace u nich způsobila genetické
změny v DNA.
*) Stochastické účinky (s
ještě vyšší pravděpodobností) mohou nastat
samozřejmě i při vyšších dávkách, po příp.
odeznění účinků deterministických.
U stochastických účinků závažnost
postižení a průběh vzniklého onemocnění nejsou
závislé na výši dávky; na absorbované dávce
závisí pouze pravděpodobnost výskytu
nádorového či genetického poškození. Jde přitom o
chorobné stavy, které i bez vlivu záření se "samovolně",
bez zjevné příčiny *) vyskytují v populaci. V jednotlivých
konkrétních případech není možné radiačně indukované
nádory a genetické změny odlišit od samovolně vzniklých
případů, jejich klinický obraz je stejný (neexistují žádné příznaky specifické pro nádory
vzniklé v důsledku ionizujícího záření). Ionizační ozáření pouze zvyšuje
pravděpodobnost vzniku těchto onemocnění,
příslušné riziko je přídavné k ostatním
rizikům. Průměrný koeficient rizika vzniku
radiačně indukovaného maligního onemocnění se odhaduje na
0,055 Sv-1,
neboli 5,5% na 1Sv (tj. pokud 1000 osob
obdrží efektivní dávku 1Sv, lze očekávat, že u 55 z nich
to vyvolá fatální zhoubný nádor).
*) Jak bylo diskutováno výše, způsobuje
to patrně genotoxicita některých chemických
látek, které do buněk buď vstupují zvnějšku
(metabolickou cestou organismu), nebo vznikají uvnitř buněk
(při vnitřním metabolismu buněk). Tyto látky vstupují do
jader, reagují s DNA a způsobují poruchy její genové
sekvence, které nemusí být úspěšně opraveny...
Závislost
stochastických účinků na věku
Při stejné dávce záření je pravděpodobnost stochastických
účinků v obráceném poměru k věku
ozářeného jedince. Je to způsobeno dvěma okolnostmi:
¨ Časový
faktor - stochastické radiační účinky mají dlouhou
dobu latence, pravděpodobnost jejich manifestace roste s časem
od ozáření. Při ozáření organismu v mladším věku je
pravděpodobně k dispozici více času na projevení pozdních
stochastických účinků. Při ozáření ve starším věku se
stochastické účinky často již do konce života nestačí
uplatnit.
¨ U dětí
probíhá v důsledku růstu intenzívnější dělení buněk,
což vede k vyšší radiosenzitivitě.
Lineárně-kvadratická
závislost stochastických účinků na dávce
Podle teorie duální radiační akce je
pravděpodobnost radiačního poškození buňky - a tedy i
pravděpodobnost neúspěšné opravy DNA ® pravděpodobnost mutací a
výskytu stochastických účinků, především maligních
transformací, závislá na hustotě ionizace v
daném místě. Podobně jako u deterministických účinků,
(kde radiační hubení buněk má lineárně-kvadratickou
dávkovou závislost - odvození viz níže "LQ model"), i u stochastických účinků má
pravděpodobnostní rozdělení výskytu maligních transformací
na efektivní dávce lineárně-kvadratický
charakter. Při nízkých dávkach do cca 1Sv má křivka lineární
tvar přímé úměrnosti četností malignit na dávce (černá
přímka na obr.5.2.3a), při vyšších dávkách je výskyt
radiačně indukovaných malignit úměrný druhé mocnině
efektivní dávky - kvadratická závislost. Teoreticky
očekávaná kvadratická závislost stochastických účinků
pro vyšší dávky se však obtížně prokazuje vzhledem k
tomu, že při vysokých dávkách téměř všechny buňky v
populaci rychle hynou deterministickými účinky.
Lineární bezprahová závislost stochastických účinků
(?)
Při nízkých dávkách se tedy pro stochastické účinky
většinou předpokládá, že míra účinku, tj.
pravděpodobnost výskytu radiačně indukovaných poškození (nádorových či genetických) je
lineárně závislá na dávce (černá
přímková čára na obr.5.2.3a) a že stochastické účinky
jsou bezprahové - mohou být vyvolány i velmi
malými dávkami, třebas i na úrovni přírodního radiačního
pozadí, byť s nepatrnou pravděpodobností. V klasické
radiobiologii se hypoteticky předpokládá, že každá mutace
jednotlivé buňky (ať již generovaná
radiačně či biochemicky) může být
prvním krokem ke karcinogenezi (je dikutováno v §3.6 "Radioterapie"). I kdyby tomu tak bylo,
mutagenní účinky velmi nízkých radiačních dávek však
mohou být s otazníkem..?.. - bude níže diskutováno.
Pozn.: V
zájmu vědecké objektivnosti by snad již na
tomto místě bylo vhodné upozornit, že v oblasti velmi
nízkých dávek < 0,2Gy je všeobecně uznávaná lineární
bezprahová závislost jen hypotéza, vzniklá
přímočarou extrapolací prokázaných účinků z oblastí
vyšších dávek (> 0,5Gy) směrem k nule, do oboru nízkých
dávek, kde tyto účinky nikdy přímo prokázány
nebyly (podrobněji je
diskutováno níže v pasáži "Malé
dávky záření: - jsou škodlivé či prospěšné?").
Na tomto předpokladu, tzv. lineární
bezprahové závislosti stochastických účinků, je
založen "konzervativní přístup" k
radiační ochraně, který se promítá do řady norem a
předpisů pro práci s ionizujícím zářením. Novější
radiobiologické studie však ukazují, že závislost
stochastických účinků na dávce není lineární, ale že v
oblasti velmi nízkých dávek jsou účinky patrně nižší
než by odpovídalo lineární závislosti *) - modrá křivka na
obr.5.2.3a.
*) Toto chování by mohlo souviset s radiačně
induvanou reparací a též s tzv. hyper-radiosenzitivitou
k nízkým dávkám (viz níže
"Odchylky od LQ modelu"), kdy
ozářené buňky (s rizikem změněného genomu) se zvýšenou
pravděpodobností zanikají. Názory radiobiologů se zde
liší, diskutuje se někdy i o relativně zvýšené
pravděpodobnosti stochastických účinků v oblasti nízkých
dávek, např. v souvislosti s výše zmíněným bystander
efektem..?..
Pokud by se navíc potvrdily některé alternativní
názory (zmíněné níže "Malé
dávky záření: - jsou škodlivé či prospěšné?"), mohla by ve skutečnosti
křivka závislosti stochastických účinků na radiační
dávce mít tvar zelené křivky na obr.5.2.3a - i pro
stochastické účinky by existoval práh(!) (podobně jako je tomu u účinků deterministických), jenže mnohonásobně nižší. A při nejnižších
dávkách by se mohla projevovat tzv. radiační hormeze
- úsek zelené křivky křivky pod vodorovnou osou..?..
Radiobiologické výsledky se budou jistě zpřesňovat, avšak
co se týče malých dávek záření, srovnatelných s
přírodní hladinou na niž jsou naše organismy
"přizpůsobeny", v současné době neexistuje
přímý důkaz, že nízká úroveň záření je
zdraví škodlivá (viz níže diskusi v
pasáži "Malé dávky záření: - jsou
škodlivé či prospěšné?").

Obr.5.2.3. Závislost biologického
účinku na velikosti absorbované dávky záření.
a) Pravděpodobnost výskytu pro stochastické
účinky. b) Závažnost poškození pro
deterministické účinky.
c) Závislosti přežívající frakce buněk N/N0 na dávce podle
lineárně-kvadratického modelu.
- Deterministické
účinky - tkáňové reakce
Při vysokých dávkách záření je počet
poškozených molekul biologicky aktivních látek již
natolik vysoký, že buňky ani organismus nejsou schopny
je zcela opravit – větší část buněk hyne,
vzniká nemoc z ozáření. Poškození
tkáně je zde přímo úměrné obdržené dávce
záření, není již náhodné, je naopak předvídatelné
*) – hovoříme o účincích deterministických
- tkáňových a orgánových reakcích.
*) Je však užitečné
připomenout, že i v základech deterministických
účinků leží stochastický mechanismus
zániku buněk (viz níže "LQ
model"). Při vyšších
dávkách je ale počet poškozených buněk natolik vysoký,
že statistický charakter se již neprojevuje
(relativní rozptyl S=1/ÖN počtu
poškozených buněk N je velmi malý).
Deterministické účinky se klinicky
projevují až po dosažení určité prahové dávky,
přičemž s rostoucí dávkou roste jednak pravděpodobnost
vzniku poškození (tj. při ozáření
souboru osob roste počet jedinců, u nichž lze poškození
prokázat; při vyšších dávkách se účinky projeví u
každého), jednak u daného jedince se zvyšuje
závažnost poškození. Závislost radiačního
účinku na absorbované dávce pro deterministické účinky je
znázorněna na obr.5.2.3 uprostřed. Základním patogenním
mechanismem je snížení počtu buněk (deplece
buněk) v ozářené tkáni. Na škodlivém účinku se
podílejí i toxické látky, vznikající při
zániku a rozkladu velkého počtu buněk. Esovitý tvar křivky,
začínající od určitého dávkového prahu, je odrazem
skutečnosti, že v ozařované tkáni (buněčné populaci) je
určitá funkční rezerva, zpravidla dosti
značná. Pokles počtu buněk se stoupající dávkou proto
zpočátku nezpůsobuje v ozařované tkáni žádné funkční
potíže, teprve při vyšších dávkách vede deficit
buněk k somatickým projevům. Hodnota prahové dávky
pro člověka kolem 1Gy podle obr.5.2.3b je jen průměrná
(celotělová) a orientační. Každá tkáň má
obecně jinou prahovou dávku projevu
deterministických účinků, závislou na radiosenzitivitě
buněk a funkční rezervě v tkáni - např.
přibližně: kůže 3Gy, plíce 5Gy, spermie 0,3Gy, oční
čočka 1,5Gy, vyvíjející se zárodek in utero 0,1Gy, .....
Patologicky zvýšená
radiosenzitivita
se vyskytuje u jedinců s genetickou poruchou chromosomální
instability, kde je snížená schopnost
reparačních mechanismů na buněčné úrovni (porucha
stability a reparability DNA homologní rekombinací -
hypersenzitivita ke genotoxickým vlivům), jakož i snížení
imunitních procesů (imonosuprese) na úrovni organismu *).
Pokud jsou u heterozygotní buňky oba dominantní geny
v pořádku, radiační či jiné poškození jednoho z nich
nemusí funkci buňky narušit. Pokud však jeden gen je v
pořádku a druhý je porušený, poškození jednoho genu může
vést k celkové poruše činnosti buňky. U homozygotů
s takovou poruchou reparability jsou následky poškození
ještě výraznější, uplatňují se v plné míře. U těchto
osob je pro deterministické účinky prahová dávka
snížená a i diagnostické ozáření (např.
náročnější rtg vyšetření CT nebo angio, dávka cca 40-60
mSv) u nich může vyvolat lehké deterministické
účinky. Při radioterapii se projevuje zvýšená radiotoxicita
pro zdravé tkáně, při chemoterapii zvýšená citlivost na cytostatika.
Rovněž riziko stochastických účinků, a to i z
přírodního radiačního pozadí či jiných škodlivin
(chemických, včetně produktů metabolismu), je zde podstatně
vyšší - častější výskyt nádorových onemocnění
(zvláště lymfomů).
*) Jednou z takových poruch je tzv. Nijmegen breakage
syndrom (NBS, název je odvozen od města v Holandsku, kde
byla tato porucha poprve identifikována v r.1981 a kde je
centrální registr těchto pacientů) - autozomálně dědičný
syndrom chromozomální instability. Je způsoben mutací genu
nazvaného NBS1 nebo NBN, který kóduje
protein nibrin, jenž má důležitou funkci při
opravě chromosomálních zlomů způsobených ionizujícím
zářením či jinými genotoxickými činidly. Geneticky
podmíněná chromosomová instabilita se dále vyskytuje u
syndromů Ataxia telangiectasia, Bloomův syndrom,
Fanconiho anemie, Xerodermie pigmentosum, Li-Fraumeni
syndromu zmutovaného genu TP53 kódujícího p53, či zcela
raritního Wernerova syndromu předčasného stárnutí.
Důsledkem poruch buněčného cyklu je řada patologických
klinických projevů. Vedle zvýšené radiosenzitivity a
častějšího výskytu nádorových onemocnění se projevují i
poruchy růstu, neurologické a kožní projevy, vlivem
snížené imunity se často vyskytují infekční onemocnění.
Tyto vrozené dědičné poruchy, které nejsou kauzálně
léčitelné (podpůrně lze léčit jen jejich konkrétní
klinické projevy), se naštěstí vyskytují velmi vzácně,
úhrnná incidence všech zmíněných druhů činí asi 0,02%
populace. Heterozygotních nositelů je však podstatně více,
cca 0,5%.
Upozornění: Nezaměňovat,
prosím, tuto patologicky zvýšenou celkovou
radiosenzitivitu s fyziologickou hyper-radiosenzitivitou
(relativní) v oblasti nízkých radiačních dávek, která je
vlastní všem buňkám - je rozebírána níže v pasáži
"Hyperradiosenzitivita k nízkým dávkám. Model
indukované reparace".
Deterministické+stochastické
účinky
Stochastické a deterministické účinky záření
mají základní intracelulární mechanismy a některé
vnější aspekty společné a nelze je od sebe vždy striktně
oddělovat. V základech deterministických
účinků leží mechanismus radiačního usmrcování
buněk, který má na buněčné úrovni
pravděpodobnostní (tj. "stochastický") charakter,
řídí se Poissonovou statistikou (viz níže "LQ
model"). Při středních a vyšších dávkách je
však počet usmrcených buněk natolik velký, že statistické
fluktuace se prakticky neprojevují, výsledná závislost má deterministický
charakter. I při nízkých dávka (nižších než práh
deterministických účinků), u nichž se většinou diskutují
jen stochastické účinky, dochází "skrytě" k
usmrcování určitého menšího počtu buněk; navenek se to
neprojeví jen proto, že zbylé nepoškozené buňky stačí
zajistit funkční potřebu tkáně nebo orgánu a jsou včas
nahrazeny dělením těchto nepoškozených buněk. LQ model
popisuje nejen radiobiologické účinky deterministické, ale
implicitně leží i v základech pravděpodobnosti účinků
stochastických.
Dále je třeba mít na paměti, že spolu s časnými
účinky deterministickými se latentně mohou
uplatňovat i pozdní účinky stochastické,
pokud organismus přežije deterministické účinky. Je to
pozorováno při radioterapii, založené na deterministických
účincích na nádorovou tkáň, kde vedle akutní radiotoxicity
se po delším čase mohou vyskytnout sekundární
postradiační malignity, způsobené stochastickými
účinky té části záření, která se absorbovala mimo
primární cílový tumor (včetně rozptýleného záření) a
ozářila i další tkáně a orgány (§3.6
"Radioterapie", část "Fyzikální a
radiobiologické faktory radioterapie").
Terminologická poznámka:
V dalším textu často používáme označení "deterministický
radiační účinek" v poněkud slabším a
obecnějším významu - ve smyslu letálního poškození a
zániku buněk, bez nutnosti manifestace somatických
projevů pro celý organismus. Tedy "deterministické
účinky na buněčné úrovni".
| Porovnání
charakteru deterministických a stochastických účinků
záření na organismus |
| Vlastnosti: |
Deterministické
účinky |
Stochastické
účinky |
| Patogeneze: |
Smrt buněk - snížení jejich počtu |
Změna cytogenetické informace -
mutace |
| Specifičnost: |
Specifický klinický obraz,
typický pro účinky ioniz. záření |
Nespecifický obraz,
neodlišitelný od spontánních případů |
| Závislost na dávce: |
Účinek se projeví až od určité
prahové dávky, pak roste s dávkou |
Pravděpodobnost výskytu roste
s dávkou od nuly (bezprahová závislost) |
| Časová závislost: |
Většinou poměrně rychlý nástup |
Pozdní účinky, dlouhá doba latence |
Radiobiologické modelování
Radiobiologické účinky
záření na buňky a tkáně obecně závisejí především na
absorbované dávce, na druhu záření, druhu buněk v tkáni a
též na časových faktorech. Tyto obecně složité závislosti
byly měřeny v řadě radiobiologických experimentů a
ověřovány i na klinických studiích, především v
radioterapii. Vznikla přirozená snaha popsat tyto empirické
zákonitosti pomocí matematických modelů a
funkcí, které by vyjadřovaly závislost radiobiologické
odezvy na dávce D, její časové distribuci a
vlastnostech ozařované tkáně. Modely, které by umožňovaly
srovnat a analyzovat různá radiobiologická data a
předpovídaly buněčné přežití na základě fyzikálních
aspektů (druh a energie kvant záření) i biologických
vlastností buněk a tkání (radiosenzitivita,
reparační schopnosti buněčných linií normálních i
nádorových).
Jedná se především o funkční vyjádření
přežívajícího počtu buněk N z původně
ozářeného počtu N0, resp. dávkové závislosti frakce
přežívajících buněk [N/N0](D). Do 70.let spočívalo toto modelování v
konstrukci empirických matematických funkcí,
obsahujících vhodné mocniny dávky D, ozařovacího
času T a počtu frakcí n (mocniny
byly většinou neceločíselné, např. T0,33 či T0,11,
n0,24 a pod. - tak postupovali např. M.Standquist v
r.1946, nebo F.Ellis v r.1969); tyto funkce
se prokládaly empiricky zjištěnými závislostmi.
Zásadní pokrok v radiobiologickém modelování
nastal v 80.letech, kdy na základě podrobnějších
mikrodozimetrických měření a vyhodnocování chromozomových
aberací byl zformulován tzv. lineárně-kvadratický
(LQ) model - viz níže. Tento přístup již není
čistě empirický, ale vychází z rozboru mechanismů
procesu poškození a usmrcení buněk ionizujícím zářením
na subcelulární a molekulární úrovni. Parametry tohoto
modelu (koeficienty a,b a časové faktory) lze odvodit z měřených dat
(experimentálních a klinických), čímž lze v rámci jednoho
modelu odlišit chování a odezvy různých druhů
tkání. LQ model se používá především pro deterministické
radiační účinky, avšak implicitně leží i v základech
účinků stochastických. LQ model zde podrobněji rozebereme,
níže pak stručně uvedeme některé další modely.
Lineárně-kvadratický
(LQ) model radiobiologického účinku
Deterministický radiační účinek, spočívající ve
zničení většího počtu buněk, je zapříčiněn
především zlomem obou vláken DNA v jádrech
buňek. Jak bylo diskutováno shora (viz
část "Zásahová a radikálová teorie
radiačního účinku"),
podle teorie duální radiační akce závisí
radiační poškození buňky na hustotě ionizace
v kritickém místě. Pro stanovení funkčního vyjádření
přežívajícího počtu buněk N (z původně
ozářeného počtu buněk N0) na obdržené dávce D používá LQ model tři
výchozí předpoklady:
× Zlom
jednoho řetězce DNA může být snadno reparován -
subletální poškození ® přežití buňky.
× Zlom
obou vláken (řetězců) DNA je obtížně reparovatelný -
letální poškození ® zpravidla zánik buňky (apoptóza).
× Jedná
se o pravděpodobnostní děje s Poissonovou statistikou: po
ozáření množiny N0 buněk přežívá N buněk, přičemž N = N0.e-<pravděpodobnost
letálního poškození buněk>.

Dvojný zlom DNA může být způsoben dvěma
druhy procesů:
¨
a-proces
- zásah jedné ionizující částice, která zlomí
zároveň oba řetězce-vlákna DNA (projevuje se především u
hustě ionizujícího záření, avšak i u řídce
ionizujícího záření mohou sekundární elektrony poškodit
obě větve DNA). Počet ireverzibilně poškozených buněk je
zde přímo úměrný dávce - lineární
závislost na dávce D. Je-li počáteční počet buněk N0, pak po ozáření
bude počet přežívajících buněk možno vyjádřit
exponenciálním vztahem N = N0.e-a.D, kde a je průměrná
pravděpodobnost a-poškození na jednotku dávky (odvození z Poissonova
statistického rozložení je analogické jako u
exponenciálního zákona radioaktivního rozpadu - viz §2.2,
část "Obecné zákonitosti přeměny atomových
jader", místo času t by
zde vystupovala dávka D). Hodnoty koeficientu a se pohybují v
rozmezí cca 0,1¸0,8 Gy-1.
¨
b-proces
- časově blízké zásahy dvou nezávislých ionizujících
kvant, při nichž každé z nich zlomí jedno vlákno DNA
(porušení jednoho vlákna DNA umožňuje reparaci - subletální
poškození, poškození obou řetězců je zpravidla letální).
Počet radiačně poškozených buněk je zde úměrný druhé
mocnině dávky - kvadratická závislost na
dávce D. Příslušný exponenciální zákon poklesu počtu
buněk v tomto případě bude N = N0.e-b.D2, kde b je průměrná pravděpodobnost b-poškození na čtverec
jednotky dávky. Závislost je zpočátku pozvolná, téměř
lineární (možnost reparace buněk po subletálním
poškození), pak přechází v prudší exponenciální
průběh, způsobený kumulací subletálních účinků v
letální. Koeficient b nabývá pro lidské buňky hodnot cca 0,01¸0,1 Gy-2.
Celková
pravděpodobnost přežití buňky při uplatnění obou procesů
bude pak dána součinem jednotlivých pravděpodobností, což
vede k výslednému exponenciálnímu zákonu: N = N0.e-(a.D+b.D2). Závislost buněčného přežití na dávce se často
vyjadřuje pomocí křivky přežívající frakce
buněk N/N0
v (semi)logaritmickém měřítku:
-ln(N/N0) = a.D + b.D2 - lineárně-kvadratická
závislost, obr.5.2.3c nahoře.
Pro hustě ionizující záření (vysoký LET, uplatňuje se
především a-proces) má tato křivka téměř přímkový
tvar, pro řídce ionizující záření (nízký LET,
převládá b-proces) má graf tvar paraboly.
V aplikacích LQ modelu se často
zavádí poměr a/b [Gy]
vyjadřující dávku, při které je poškození a-mechanismem
stejné jako b-mechanismem (lineární a kvadratická komponenta jsou
biologicky ekvivalentní z hlediska výsledného letálního
efektu pro buňky). V grafickém vyjádření hodnota poměru a/b charakterizuje zakřivení
grafu závislosti přežívající frakce buněk ln(N/N0) na dávce podle
obr.5.2.3c. Hodnoty a/b závisejí na relativním zastoupení jednotlivých
fází buněčného cyklu. Pro rychle se dělící buňky (např.
nádorové) jsou vyšší hodnoty poměru a/b » 10 Gy, pro normální
(pozdně reagující) tkáně je a/b » 2¸4 Gy. Poměr a/b vystupuje v
odvozené biofyzikální dávkové veličině, kterou je tzv. biologická
efektivní dávka (biologický ekvivalent dávky)
BED ş
-ln(N/N0)/a = D.[1 + D/(a/b)]. BED má
význam v radioterapii při posuzování vlivu frakcionace
celkové ozařovací dávky D na n dílčích
frakcí d, kdy BED = D.[1 + d/(a/b)] (viz
§3.6 "Radioterapie",
část "Fyzikální a
radiobiologické faktory radioterapie").
Časový faktor
Takovéto jednoduché závislosti platí v
případě jednorázového ozáření. V
případě časově protrahovaného ozařování
- kontinuálního či opakovaného (frakcionovaného), se kromě
zmíněných mechanismů uplatňují i časové faktory
reparace buněk (především u b-poškození) a repopulace
buněk dělením v tkáni. Při ozáření dávkou D
během ozařovací doby T se pak v LQ modelu do výchozí
lineárně-kvadratické závislosti zavádějí dvě další
veličiny - faktory buněčné regenerace RG a repopulace RP
:
1. Reparace
Za každý elementární časový interval Dt, během něhož buňky
obdrží dávku DD=D.Dt/T a poškodí se přitom N.b.DD2 buněk, se zároveň stačí zregenerovat N.l.Dt buněk, kde
parametr l je rychlost buněčné reparace
(l =
ln2/T1/2,
kdeT1/2 je
poločas reparace). Integrací od 0 do T se získá
modifikovaný exponenciální zákon N = N0.e-RG.b.D2, v němž u kvadratického exponentu vystupuje
přídavný časový koeficient regenerace, tzv. Lea-Catchesidův
faktor*) RG = 2.[(1-e-l.T).(1-1/l.T)]/l.T, který je funkcí rychlosti buněčné reparace l a ozařovací doby
T. Rychlostní koeficient reparace l se pohybuje v rozmezí od
cca 0,4hod-1 pro normální tkáně až do cca 1,5hod-1 pro rychle se
dělící tkáně (např. nádorové).
*) Lea-Catchesidův dávkově-časový integrál:
V obecném případě lze uvažovat kontinuální
ozařování množiny N(t) buněk časově proměnnou
dávkou D(t) s okamžitým dávkovým příkonem R(t)=dD(t)/dt.
Pak za každý elementární časový interval Dt, během něhož
buňky obdrží dávku DD=R(t).Dt a poškodí se přitom N(t).b.DD2 buněk (subletálně), se zároveň stačí
zregenerovat N(t).l.Dt buněk, kde parametr l je rychlostní koeficient
buněčné reparace. Integrací příslušné diferenciální
rovnice od t=0 do průběžného času t, za okrajové
podmínky při t=0 N(0)=N0, získáme řešení pro časovou závislost počtu
buněk N(t), kterou lze rovněž zapsat v původním
(kvadraticky)exponenciálním tvaru N(t) = N0.e-RG(t).b.D(t)2, kde modifikující veličina
RG(t,l) = [2/D(t)2]. 0ňtR(t).dt
. 0ňt'R(t').e-l.(t-t')dt'
je zobecněná tzv. Lea-Catchesidova funkce (závislosti tohoto druhu již v letech 1942-45
empiricky zjistili D.E.Lea a D.G.Catcheside
při zkoumání buněčných aberací na Drosophile), vyjadřující "balanci" mezi
poškozováním buněk dávkovým příkonem R(t) a jejich
průběžnou reparací s rychlostním koeficientem l. Funkce RG
závisí na časovém průběhu dávkového příkonu R(t) během
celé expozice. V mezních případech krátké
expoziční doby T<<1/l je RG®1 (reparace se během
ozařování neuplatní), v opačném případě dlouhé
ozařovací doby T>>1/l je RG®0 (téměř všechna
potenciálně letální poškození se stačí zreparovat).
b-proces, v koprodukci s buněčnou reparací, způsobuje
tedy tzv. efekt dávkového příkonu: že
totiž biologický účinek ionizujícího záření závisí
nejen na celkové absorbované dávce, ale i na dávkovém
příkonu *), jak je schématicky znázorněno v dolní
části obr.5.2.3c. Pro nízký dávkový příkon
(LDR) je vysoký počet reparací a křivka přežívající
frakce buněk je poměrně plochá - menší biologický
účinek (modrá křivka). Čím vyšší je dávkový
příkon, tím je větší pravděpodobnost případů, že i
zlom druhého řetězce DNA nastane dříve, než proběhne
oprava prvního vlákna, čímž dochází zpravidla k
letálnímu poškození buněk. Pro vysoký dávkový
příkon (HDR) je proto křivka přežívající frakce
strmější - větší biologický účinek,
výrazně rostoucí s dávkou (červená křivka na obr.5.2.3c
dole).
*) V exponenciálním zákonu pro b-proces N = No.e-RG.b.D2 vystoupí dávkový příkon explicitně,
když z kvadrátu dávky D2=D.D jednu veličinu dávky D přeneseme do
Lea-Catchesidova faktoru RG: RG.D = 2.[(1-e-l.T).(1-1/l.T)].D/l.T a uvědomíme
si, že D/T je dávkový příkon R. V
obecném Lea-Catchesidově integrálu vystupuje dávkový
příkon R
přímo.
2. Repopulace
Vedle exponenciálního poklesu počtu buněk v důsledku
radiačního poškození dochází průběžně k náhradě
zaniklých buněk dělením buněk přežilých. Za časový
interval Dt vzroste počet N stávajících buněk o N.n.Dt, kde n je rychlost
buněčné repopulace; často se používá čas
zdvojení T2r= ln2/n počtu buněk repopulací. Integrací se získá
exponenciální zákon růstu počtu buněk repopulací N = N0.en.T. V logaritmickém tvaru to vede k dalšímu aditivnímu
členu RP = ln2.T/T2r, vyjadřující poměr ozařovacího času T a času T2r
zdvojení počtu buněk repopulací. Buněčná repopulace
ještě zvýrazňuje výše uvedený efekt dávkového
příkonu.
Při zahrnutí
těchto časových vlivů nabývá lineárně-kvadratická
závislost výsledný tvar (v semilogaritmickém měřítku):
-ln(N/N0) = a.D + {2.[(1-e-l.T).(1-1/l.T)]/l.T}.b.D2 - ln2.T/T2r .
Tyto vztahy
mezi biologickým účinkem a radiační dávkou, včetně
jejího časového průběhu (dobou ozáření T), hrají
důležitou úlohu především v radioterapii,
kde se používá frakcionace ozařovacích dávek za
účelem optimalizace výsledné radiační odezvy nádorové
tkáně vzhledem ke zdravé tkáni - viz §3.6 "Radioterapie".
Zajímavým důsledkem uvedených závislostí LQ modelu může
být absence deterministického účinku i u
poměrně vysokých celkových dávek záření (podstatně
vyšších než prahových pro jednorázové ozáření podle
obr.5.2.3b), pokud je ozařování dlouhodobé s dávkovým
příkonem nižším, než je rychlost buněčné reparace a
repopulace. V takovém případě se mohou vyskytnout jen
účinky stochastické.
Odchylky od LQ modelu. Alternativní modely
a závislosti.
Lineárně-kvadratický model je jen zjednodušeným
mechanistickým popisem složitých dějů,
odehrávajících se při ionizačním ozařování tkání a
buněčných populací. V praxi se od standardního
(idealizovaného) LQ modelu vyskytují určité odchylky.
Vyšší mocniny
dávky
Dvojný zlom DNA se obvykle považuje za neopravitelný, vedoucí
k inaktivaci a mitotické smrti buněk. Pozdější experimenty
však ukázaly, že i takové poškození si buňka někdy dovede
opravit, byť s menší pravděpodobností. Do dávkové
závislosti radiobiologického účinku je, vedle první a druhé
mocniny, někdy třeba zahrnout menší opravy obsahující i vyšší
mocniny dávky (obr.5.2.4a). Mohly by mít
částečně svůj původ ve vícečetných interakcích
(současných či jdoucích rychle za sebou) kvant ionizujícího
záření, resp. jejich zplodin, s buněčnými jádry, které
jsou reparační mechanismy tím obtížněji schopny opravit. Ve
skutečnosti se zde však uplatňuje mnoho různých vlivů.
Projevuje se to zvláště u hustě ionizujícího záření
(s vysokou hodnotou lineárního přenosu energie LET), kde
navíc předávaná energie je rozložena nerovnoměrně
(zvláště v oblasti Braggova maxima u záření a, protonů a
dalších těžkých nabitých částic). Závislost [ln(N/N0)](D) lze pak rozvést
do Taylorova rozvoje podle různých mocnin dávky D.
Tkáňové
biologické vlivy.
Ještě významnější jsou některé individuální biologické
vlivy. Každá tkáň je ve skutečnosti heterogenní
buněčnou populací, obsahující buňky v různých
fázích buněčného cyklu a buňky s různou
radiosenzitivitou - s různými koeficienty a,b: výsledná
křivka přežití [ln(N/N0)](D) je pak superpozicí několika různých LQ
křivek. Kromě toho během vlastní expozice může nastávat
tzv. redistribuce buněk (změna v
relativním zastoupení buněk s různou radiosenzitivitou:
snížení zastoupení buněk ve fázi G1 a G2 a celkově
kmenových klonogenních buněk, zatímco buněk ve fázi M a S a
efektorových dceřinných buněk bude relativně vyšší
zastoupení) během ozařování, nebo reoxygenace
(změna obsahu kyslíku - výše zmíněný "kyslíkový
efekt"). Kyslíkový efekt je významný především při
použití řídce ionizujícího záření (nejčastěji se
používá fotonové záření g či X), kde převládá
nepřímý radikálový mechanismus radiačního účinku. U
hustě ionizujícího záření, kde je zvýšený podíl
přímého zásahového mechanismu (a též zvýšená
rekombinace radikálů), je vliv kyslíku (oxygenace) na
radiobiologické účinky méně významný. Tyto biologické
procesy mohou mít za následek změny v radiační
citlivosti buněk a tkání během expozice, což vede k
dalším odchylkám od závislostí LQ modelu.
Bystander
efekt.
Diskutuje se i tzv. bystander efekt
dálkové indukce radiačních účinků v tkáni (popsaný
výše v části "Účinky záření na tkáňové
úrovni"), který může poněkud zvyšovat
počet poškozených buněk (obr.5.2.4b). Do LQ modelu
lze vliv bystander-efektu zahrnout vložením nového
empirického koeficientu B>1, udávajícího průměrný
počet poškozených buněk při zásahu jedné buňky : N/N0 = e-B.(a.D+b.D2). To je ale ekvivalentní standardnímu LQ modelu s
poněkud vyššími hodnotami parametrů a´ = B.a, b´ = B.b. Výsledné koeficienty
radiosenzitivity a´,b´ pro tkáň jsou tedy vlivem bystander-efektu poněkud
vyšší než koeficienty a,b pro individuální buňky. Faktor B je různý
pro různé tkáně. V praktických radiobiologických
experimentech se však radiosenzitivita stanovuje pro tkáň (či
tkáňové kultury), kde je již vliv bystander-efektu
implicitně obsažen: a®a´,b®b´. LQ model pro praktické použití tedy zůstává nezměněn.
Bystander efekt nemění základní principy a závislosti LQ
modelu, způsobuje jen rozdíly v radiosenzitivitě mezi
buněčnou a tkáňovou úrovní.

Obr.5.2.4. Některé odchylky od LQ modelu závislosti
biologického účinku na dávce.
a) Vícečetné interakce záření s buňkami
vedou k přítomnosti členů s vyšší mocninou dávky D.
b) Bystander-efekt poněkud zvyšuje celkové množství
poškozených buněk (snižuje frakci přežilých buněk). c)
V oblasti nízkých dávek se na grafu přežilé frakce buněk
pozoruje relativně zvýšená citlivost buněk -
hyperradiosenzitivita.
Hyper-radiosenzitivita
k nízkým dávkám. Model indukované reparace
Čím vyšší je absorbovaná dávka ionizujícího záření,
tím větší množství volných radikálů vzniká - tím
větší by mělo být i poškození buněk v tkáni či
buněčné populaci. A tím větší procento usmrcených buněk:
závislost N/N0 přežilé frakce buněk na dávce by měla být monotónně
klesající. Některé radiobiologické experimenty však
ukázaly, že v oblasti velmi nízkých dávek (cca 0,1-0,5Gy)
má jinak pozvolně klesající, téměř přímková závislost
N/N0
přežilé frakce buněk (podle obr.5.2.3c), výraznou
"dolinku", ukazující na relativně zvýšenou
citlivost buněk, než by odpovídalo těmto nízkým
dávkám (obr.5.2.4c) - tzv. hyper-radiosenzitivita
k nízkým dávkám pro deterministické účinky. Buňky
začnou reparovat až od určité dávky...
Detailní mechanismus tohoto paradoxního
chování zatím není znám. Může souviset s kinetikou enzymů
v G2 fázi buněčného cyklu při reparacích homologními
rekombinacemi (viz výše pasáž
"Nitrocelulární reparace"), kdy
se zvyšující se dávkou se zvyšuje koncentrace enzymů, což
indukuje zvýšenou rychlost reparace. Na buněčné úrovni se
tedy zdá, že buňky by mohly potřebovat jistou malou úroveň
poškození, aby zpětnovazebnými procesy nastartovaly produkci
reparačních enzymů. Pokud při nízkých dávkách tato
úroveň není dosažena, reparace by neprobíhala a v
check-pointech by byla další mitóza zastavena ® inaktivace buněk
®
vyšší senzitivita k nízkým dávkám. Při vyšší dávce (a
tedy větším poškození v DNA) by produkce reparačních
enzymů již probíhala ® účinnější reparace ® relativně nižší
senzitivita - závislost se vrátí na standardní křivku LQ
modelu. Tento jev se někdy označuje jako indukovaná
reparace.
Pozn.1: Uvažuje
se též neurčitě o jakémsi "fyziologickém obranném
mechanismu" proti mutagenním účinkům záření v oblasti
zvýšené pravděpodobnosti přežití buněk s částečně
poškozenou genetickou informací; tyto buňky vlivem
hypersenzitivity zahynou (v duchu výše zmíněného hesla pro
poškozené buňky "mrtvá buňka = dobrá buňka")
a neohrožují organismus pozdějšími stochastickými účinky.
Pozn.2: Mechanismus radiačně
indukované reparace by mohl přispívat k radiační
hormezi diskutované níže v pasáži "Nízké
dávky záření:- jsou škodlivé či prospěšné?".
Pozn.3: Jakýmsi
"předobrazem" nízkodávkové hyperradiosenzitivity
možná mohl být tzv. Petkau effect (Petkóův
jev), který v r.1972 popsal kanadský radiobiolog A.Petkau.
Jednalo se údajně o zvýšenou destrukci buněčných membrán
při dlouhodobém ozařování velmi nízkými dávkami
záření. Vysvětloval se mechanismem působení záporných
kyslíkových iontů, které v nižší koncentraci více
poškozují membrány, zatímco při vyšší koncentraci
dochází k jejich větší rekombinaci a menšímu účinku.
Toto vysvětlení není příliš přesvědčivé a samotný
Patkauův jev nebyl potvrzen pozdějšími
radiobiologickými studiemi (byl pozorován v době, kdy
technické prostředky ani radiobiologické poznatky ještě
neumožňovaly spolehlivě prokázat takový jev, ani odhalit
jeho mechanismus; mohlo se jednat třebas i o chemické
působení nosičů použitého radionuklidu 22Na, nebo podobné
vedlejší jevy.?..). Ve světle nynějších radiobiologických
poznatků by primárním efektem nízké dávky měl být
účinek na DNA, jejíž neopravené poškození vyvolá
apoptózu buňky se sekundárním poškozením buněčné
membrány (jak bylo uvedeno výše v části "Mechanismy
buněčné smrti"). O apoptóze
buněk se v té době mnoho nevědělo.
V rámci LQ modelu se standardními parametry a,b lze
hyperradiosenzitivitu zahrnout vložením počáteční složky s
vyšší hodnotou parametru ahyper>a - předpokladem dávkové
závislosti parametru a: a(D) = a + (ahyper-a).e-D/Dhyper, kde ahyper je počáteční vyšší hodnota popisující sklon
křivky [ln(N/N0)](D) pro nízké dávky, a je standardní hodnota pro
vyšší dávky, Dhyper (»0,2Gy) je hranice oblasti projevu hyperradiosenzitivity.
LQ model N/N0 = e-[a(D).D+b.D2] s takto dávkově závislým parametrem a(D) pak dobře
vystihuje experimentální data. Pro vysoké dávky D>>Dhyper přechází ve
standardní LQ model s obvyklými parametry a,b, pro nízké dávky
D<<Dhyper se chová jako LQ model s parametry ahyper,b. Jedná se tedy o
kombinaci dvou LQ modelů s různými a-citlivostmi (dvě
různé směrnice na obr.5.2.4c), sloučených do jedné rovnice;
nazývá se někdy IndRep model (indukované reparace).
Upozornění: Nezaměňovat,
prosím, tuto fyziologickou (relativní)
hyper-radiosenzitivitu v oblasti nízkých dávek, vlastní všem
buňkám, s patologicky zvýšenou celkovou
radiosenzitivitou, způsobenou genetickými poruchami chromosomové
instability - byla zmíněna výše v pasáži "Vztah
dávky a biologického účinku".
(multi)Terčíkový
model
Tento jednoduchý a do značné míry fenomenologický model je
předchůdcem LQ modelu. Vychází z předpokladu, že v buňce
je jeden či několik na záření citlivých terčíků.
Pokud je některý z těchto terčíků zasažen (zářením nebo
radikálem), vede to k inaktivaci a smrti buňky. Pokud je
přítomen jeden takový terčík, pak analogickou
aplikací Poisonova statistického rozdělení pravděpodobností
zásahu, jakou jsme výše použili u a-procesu v LQ modelu,
dostaneme závislost přežilé frakce buněk N/N0 na dávce D:
N/N0 = e-D/Do, kde Do je dávka, která
vede v průměru k jednomu zásahu terčíku. Pokud je přítomno
n terčíků, pak multi-terčíkový model
jedno-zásahové inaktivace dává závislost: N/N0 = 1 - (1 - e-D/Do)n. Pro získání lepší shody s experimentálními
hodnotami v oblasti nízkých dávek se někdy n-terčíková
závislost kombinuje s 1-terčíkovou závislostí (každá s
jinou hodnotou empirické konstanty Do).
Kinetické modely
zlomů DNA - LPL a RMR molel
Z 80.let pocházejí modely založené na analýze kinetiky
takových zlomů DNA, které mohou (ale nemusí) vyústit v
usmrcení buněk. Modely letálního a potenciálně
letálního účinku (LPL, S.B.Curtis 1989) a opraveného/neopraveného
poškození (repair/misrepair model - RMR, C.A.Tobias 1985),
které se někdy sjednocují do tzv. modelu dvou lézí TLK
(two-lesion kinetic), jsou pro oblast obvyklých dávek (jednotky
až desítky Gy) prakticky identické s LQ modelem.
Model lokálního
účinku
LEM (Local Effect Model) zohledňuje lokální
distribuci dávky podél dráhy ionizujícího záření, ve
vztahu k rozměrům a hustotě rozložení buněčných jader v
ozařované tkáni. Vychází z jednoduchého obecného vztahu
N/N0 = e-N(D),
kde N(D) je průměrný počet letálních poškození vztažený
na 1 buňku při dávce D (počítá se jen s a-procesem).
Zavádí pak lokální objemovou hustotu letálních poškození s(D) = N(D)/V, (kde V je průměrný objem buněčných jader), kterou dává do vztahu s lokální hustotou dávkové
distribuce podél dráhy částic pro různé druhy záření.
Pomocí této analýzy model lépe popisuje biologické účinky
hustě ionizujícího záření (protonového, a-částic,
záření těžších iontů).
Dvoustupňový
pravděpodobnostní model
Toto další zdokonalení v modelování radiobiologického
účinku rozpracovali naši odborníci (P.Kundrát,
M.Lokajíček, H.Hromčíková). Podobně jako u klasického LQ
modelu, se zde vychází z analýzy buněčného poškození
letálním a-procesem a méně závažného poškození b-procesem,
které je v zásadě opravitelné, avšak kombinace dvou b-poškození je
letální. S použitím Poissonovy statistiky se analyzuje
pravděpodobnost zásahu buňky (jádra buňky) určitým počtem
částic v závislosti na dávce, LET a velikosti jádra, jakož
i pravděpodobnost přežití buňky po proběhnutí
reparačních procesů. Při této analýze se předpokládá,
že podmínkou přežití buňky po daném počtu zásahů
ionizující částicí je žádné poškození a-procesem a
maximálně jedno poškození b-procesem, jakož i jeho úspěšná reparace. Model je
propracován zvláště pro protonové a iontové záření.
Vysokodávkové
modifikace LQ modelu - LQL, gLQ, USC, KN, PLQ
Při ozařování vysokými dávkami
záření (d > 5,10 i více Gy/frakci), které
umožňují pokročilé konformní techniky stereotaktické
radioterapie a HDR brachyterapie (§3.5, část "Stereotaktická
radioterapie SBRT"), se ukázal
určitý nesoulad mezi očekávanými a pozorovanými
účinky: klasický LQ model při těchto vyšších dávkách na
frakci poněkud nadhodnocuje biologický účinek radioterapie,
předpovídá vyšší poškození normální tkáně NTCP. Jako
kdyby zde křivky přežívající frakce buněk -ln(N/No) (v log-lineárním
měřítku) při vyšších dávkách ve skutečnosti vykazovaly
zvýšený podíl lineární složky než kvadratické. Pro
zachycení těchto klinických poznatků se někdy používají
některé empirické modifikace LQ modelu,
které lépe vystihují radiobiologické účinky při vyšších
dávkách :
×
LQL model (lineárně-kvadraticko-lineární)
pro vyšší dávky/frakci (vyšší než 2.a/b, v praxi > cca 6Gy)
přidává dodatečnou lineární složku
zvyšující přežívající frakci buněk.
×
Zobecněný gLQ model (generalized LQ).
Standardní (konvenční) LQ model předpokládá, že rychlost l opravy radiačně
indukovaného subletálního poškození zůstává s časem
konstantní, což vede k exponenciálnímu vzorci pro opravu v
Lea-Cathesidově členu RG. Některé experimentální studie
však naznačují, že že reparační rychlost subletálních
poškození se s časem zpomaluje. Zobecnění v gLQ modelu
spočívá v zavedení reparačního členu s recipročním
časem 1/T do Lea-Cathesidova členu RG.
×
Univerzální křivka přežití USC (Universal
Survival Curve), která se sestavuje pro oblast vysokých
dávek na základě kombinace LQ modelu
(který dává dobrý popis pro malé a střední dávky) a multiterčíkového
MT modelu (lépe popisujícího účinek při vyšších
dávkách - závislost v této oblasti vychází spíše jako
přímka).
×
KN (Kavahagh-Newman) model
zavádí do b-členu v LQ modelu další dávkově závislý faktor:
ln(N/N0) =
-a.D - b.D2.[1 + (b/g).D]-1.
×
PLQ (Pade Linear Quadratic) model
zavádí do celkového výrazu pro pravděpodobnost buněčného
přežití v LQ modelu dodatečný dávkově závislý faktor:
ln(N/N0) =
(-a.D -
b.D2).(1 + g.D)-1 (název pochází z toho, že výraz se dá modelovat
jako Padé-aproximace poměru dvou polynomů).
Fenomenologický
charakter LQ modelu?
Všechny výše zmíněné složité procesy na úrovni buněk,
buněčných populací a tkání (jejichž mechanismy často
nejsou dosud detailně prozkoumány) způsobují, že v praxi
koeficienty a,b v LQ modelu někdy ztrácejí svůj jednoznačný
fyzikální či radiobiologický význam a nabývají charakter empirických
konstant. V oblasti radiačních dávek používaných v
biologických aplikacích (jednotky až desítky Gy) sice dobře
modelují skutečnou závislost N/N0 přežilé frakce buněk na dávce, avšak samotný LQ
model se stává spíše sumárním fenomenologickým popisem
biologického účinku záření. Přesto ale tento model,
vycházející z přesné analýzy příslušných mechanismů,
zůstává nejlepším a nejpropracovanějším modelem
dávkové závislosti radiobiologického účinku pro praktické
použití.
Malé dávky záření: - jsou
škodlivé či prospěšné?
aneb
Změní se
základní paradigma radiační ochrany?
"Každé
ozáření zdravé živé tkáně ionizujícím zářením, a to
i velmi malou dávkou, může být pro organismus potenciálně
nebezpečné svými pozdními stochastickými účinky. Proto je
nutno všemi dosažitelnými prostředky snížit dávky
záření na minimum."
V krajním případě dokonce i jediné kvantum ionizujícího
záření, které pronikne do organismu, může poškodit DNA v
buňce a vést nakonec ke vzniku nádorového onemocnění ..?!..
Toto je základní východisko nynější
radiační ochrany, "kanonizované" ve všech normách
a předpisech pro práci s ionizujícím zářením, včetně
našeho "Atomového zákona". V tomto odstavci se
pokusíme tak trochu "kacířsky" zpochybnit
toto základní paradigma radiační ochrany - budeme diskutovat
některé alternativní názory na rizika z
ozáření nízkými dávkami.
Na jakých faktických údajích je
toto základní východisko radiační ochrany založeno? Kromě
experimentů na malých zvířatech (krysách), se zdrojem
údajů o biologických účincích záření stala zločinná
zneužití jaderných sil v Hirošimě a Nagasaki a též řada
radiačních havárií. Při těchto tragických událostech bylo
mnoho osob ozářeno různými dávkami záření, včetně velmi
vysokých a letálních dávek. Radiobiologie a radiační
medicína tak získala vcelku dobrou představu o deterministických
účincích záření, průběhu nemoci z ozáření
a možnostech jejího léčení. Dlouhodobým sledováním řady
osob, které dostaly nižší dávky než odpovídají akutní
nemoci z ozáření, byly získány i důležité informace o stochastických
účincích záření a jejich závislosti na velikosti dávek.
Další údaje o deterministických a stochastických účincích
záření byly získány sledováním rozsáhlých souborů
pacientů ozářených při medicínských terapeutických a
diagnostických aplikacích (radiotoxicita, sekundární
postradiační malignity).
"Lineární
bezprahová teorie" je pouze neprokázaná hypotéza
Společným znakem většiny studií o biologických účincích
ionizujícího záření je to, že se jedná o střední,
vyšší a vysoké dávky (od
několika desetin Sv až do mnoha desítek Sv). Pro tyto hodnoty
lze sestrojit vcelku objektivní závislost mezi hodnotou dávky
a biologickými účinky (obr.5.2.3). Co se týče nejnižších
dávek (na úrovni jednotek a desítek mSv), je nutno
přiznat, že je to "terra incognita", kde chybí
spolehlivé údaje *); nelze se tomu divit, neboť samo
označení "stochastické účinky" říká, že je
obtížné najít zde nějaké kauzální zákonitosti...
*) Pro střední a vyšší dávky (v
oblasti nad cca 400mGy) je vztah mezi dávkou a účinkem prokázaný
a statisticky významný. Směrem k nižším dávkám se však
výsledky rozmazávají vlivem statistických fluktuací a
nejistot; pro nejnižší dávky již biologický účinek není
statisticky prokazatelný. Při předpokládaném zhruba
lineárním vztahu mezi dávkou a účinkem počet jedinců,
potřebný k prokázání statistické významnosti
stochastického účinku, roste s obráceným čtvercem
průměrné dávky potřebné k vyvolání efektu. Pokud účinek
při dávkách kolem 1Gy je prokazatelný ve statistickém
souboru několika tisíc osob, pak prokázání účinku
podmíněného dávkou 0,1Gy vyžaduje statisícový soubor. Pro
nejnižší dávky blízké nulovým hodnotám pak existence přírodního
radiačního pozadí zcela znemožňuje
analýzu vztahu dávky a radiačního účinku. Může se zde
dále projevovat řada rušivých vedlejších "maskovacích"
faktorů, zcela zkreslujících pozorované výsledky!
Konzervativní
radiobiologové a odborníci v radiační ochraně tedy vezmou
bod [0,0] jako výchozí (nulová dávka = nulový účinek),
proloží přímkovou závislost od nuly do skutečně
prokázaných hodnot a chybějící hodnoty v
oblasti nejnižších dávek bez rozpaků nahradí extrapolovanými
hypotetickými hodnotami (přímka na obr.5.2.3 vlevo).
A hned tu máme tvrzení o škodlivých stochastických
účincích i nejnižších dávek záření, neboli o bezprahovosti
stochastických účinků. Tvrzení často opakované (a proto
obecně přijímané), avšak neprokázané!
Lineární bezprahová teorie není hypotéza radiobiologická,
ale je výsledkem zpracování a přímočaré aproximace
dostupných dat.
Pečlivou analýzou
nashromážděných údajů o vztazích dávek a biologických
účinků se ukazuje, že závislost účinku na dávce
pravděpodobně není lineární. Účinky v
oblasti nízkých dávek jsou zřejmě menší
než by odpovídalo dříve předpokládané lineární
závislosti (blíže skutečnosti je možná modrá nebo zelená
křivka na obr.5.2.3 vlevo). Předpoklad lineární závislosti a
bezprahovosti stochastických účinků, na němž je budována
dosavadní koncepce radiační ochrany, představuje konzervativní
přístup, nadhodnocující rizika v oblasti malých
dávek.
Obraťme se k argumentaci z jiného
směru - vývoje života na Zemi a úloze
reparačních procesů v jádrech buněk. Základní mechanismus
genetického předávání informací v prvotních buňkách se
vyvinul před stovkami milónů let, kdy úroveň přírodního
ionizujícího záření byla mnohem vyšší
než dnes (vyšší přírodní radioaktivita, nižší
stínící schopnost atmosféry vůči kosmickému záření).
Tato vysoká úroveň radiačního pozadí byla jednak
důležitou hybnou silou evoluce života (mutace
+ přírodní výběr ® vývoj nových druhů), jednak přinutila buňky, aby
si vyvinuly dostatečně účinné reparační mechanismy
proti radiačnímu poškození. A tyto mechanismy si
pravděpodobně zachovaly svou účinnost
dodnes. I nyní je náš organismus v důsledku přírodní
radioaktivity a kosmického záření každou sekundu ozařován
několika tisíci kvanty ionizujícího záření.
Velké množství reaktivních
radikálů a oxidantů vzniká jako zplodiny běžného metabolismu
v organismu; je jich dokonce mnohem více než při ozáření
nízkými či středními dávkami ionizujícího záření
(odhaduje se na statisíce poškození nukleotidů DNA v každé
buňce za den). Lze proto očekávat, že škodlivé radikály
vyvolané malou dávkou ionizujícího záření se ztratí
"jako kapka v moři" velkého množství škodlivých
zplodin běžného metabolismu.
Pozn.: Toto
zhruba platí pro "řídce" ionizující záření.
"Hustě" ionizující záření vyvolává dvojité
zlomy DNA, které jsou hůře opravitelné, což vede k jeho
vyšší radiobiologické účinnosti včetně vyššího rizika
stochastických účinků.
Radiační
hormeze a adaptivní odezva
Někteří odborníci se navíc domnívají, že přiměřené
množství poruch vyvolaných malou dávkou záření (zejména
řídce ionizujícího) může v organismu iniciovat a stimulovat
reparační mechanismy na úrovni chromozomů, které
"opraví" nejen tyto radiační poruchy, ale
"přiberou" i řadu dalších defektů vzniklých při
metabolismu, které by jinak mohly zůstat neopraveny. Tato radiační
hormeze *), či adaptivní odezva nebo radiačně
indukovaná reparace při nízkém ozáření buněk a
organismů, je jakási obdoba "imunizace" v organismu.
*) Hormeze
Slovo hormeze pochází z řec. "hormaein"
= "vybudit, excitovat, posílit". Jedná se o
zkušeností podložený jev, kdy nízké dávky toxických
látek nejen že organismus nepoškodí, ale dokonce zlepšují
jeho fyziologické funkce. Hormeze vznikla patrně během evoluce
jako jedna ze schopností organismů reagovat na nepřízeň
prostředí - chlad, horko, nedostatek potravy, toxické látky -
faktory narušující fungování organismu. Na tyto stresové
faktory organismy často reagují přizpůsobením (adaptací).
Působení malých množství toxických látek, které
poškozují biologické molekuly, spouští stresovou odpověď a
může vést k hormezi; organismus pak lépe snáší i vyšší
dávky dané toxické látky. Jedním z těchto faktorů
stimulujících hormezi by mohlo být i ionizující záření...

Obr.5.2.3. Závislost biologického
účinku na velikosti absorbované dávky záření.
a) Pravděpodobnost výskytu pro stochastické
účinky. b) Závažnost poškození pro
deterministické účinky.
c) Závislosti přežívající frakce buněk N/N0 na dávce podle
lineárně-kvadratického modelu.
Tento obrázek jsme si zde pro názornost uvedli znovu; jedná se
především o obr. a) vlevo - velmi nízké
dávky.
Podle těchto názorů (dosud však též
spolehlivě neprokázaných) by tedy malé dávky záření mohly
být pro organismus dokonce prospěšné!
Nízká dávka záření spustí "signál" vydávaný
poškozenými DNA a následný reparační proces opraví
veškeré nalezené chyby (a odstraní ty nukleotidy, jež
opravit nelze), nejen ty způsobené zářením. Je-li množství
poškození způsobených zářením menší než je
"kapacita" reparačního systému, opraví se i další
chyby; po ozáření malou dávkou je v DNA méně chyb než
před ním - dochází k pozitivnímu účinku
(úsek zelené křivky pod vodorovnou osou na obr.5.2.3a). Při
vyšší dávce, kdy rozsah radiačního poškození překročí
"reparační kapacitu", je již účinek ozáření negativní
(zbytek zelené křivky v kladných hodnotách).
Při radiační adaptivní
odezvě se může uplatňovat několik mechanismů :
¨ Časový
- zpomalení buněčného cyklu, takže do začátku další
mitózy se některá poškození stačí opravit;
¨ Chemický
- neutralizace a tím detoxikace reaktivních radikálů;
¨ Biochemický
- aktivace enzymů podílejících se na intracelulární
reparaci - výše uvedená radiačně indukovaná
reparace;
¨ Imunitní
- stimulace obranných mechanismů na úrovni celého organismu,
které by mohly napomoci eliminaci buněk změněných nejen
vlivem radiace.
Určitá malá
"přípravná" či "preventivní" dávka
záření může tak chránit buňky proti
poškozením vyvolaným následnou mnohem vyšší dávkou. Malá
dávka aktivuje v buňce enzymy určené k
opravě genetické informace, díky čemuž se buňka snáze
vypořádá s případnými následky silnějšího ozáření.
Co se týče vlivu záření na složité mnohobuněčné
organismy, vyskytuje se i názor, že malá dávka záření nebo
některých toxinů zbavuje organismus buněk, které mají
oslabené reparační mechanismy a u kterých by v budoucnu
hrozilo, že propadnou zhoubnému bujení.
Tyto (zatím) nekonformní
názory byly ověřovány i experimentálně.
Bylo by samozřejmě eticky nepřípustné provádět takové
experimenty na lidech, a dokonce ani ne na vyšších
zvířatech. Byly však prováděny zajímavé experimenty na bakteriích.
Kultura bakterií (.......) byla rozdělena na dvě části, z
nichž jedna byla umístěna do dobře stíněného boxu, kde
byla úroveň radiačního pozadí nižší než v přírodě.
Druhá skupina bakterií byla za stejných ostatních podmínek
(teplota, tlak, vlhkost, živiny) vystavena slabému poli
ionizujícího záření. Byl zjištěn překvapivý výsledek:
bakterie vystavené záření prosperovaly po všech stránkách
poněkud lépe než bakterie z druhé skupiny stíněné před
zářením! Jednalo se zde však o sledování celé kultury
bakterií (při jejíž reprodukci se mohly projevovat
výběrové efekty), nikoli o sledování individuálních vlivů
na jednotlivé bakterie.
Je jasné, že nelze nijak
přímočaře přenášet tyto experimentální výsledky a
spekulativní úvahy na biologické účinky záření pro
člověka. Bakterie jsou prokaryotní organismy, které vzhledem
ke své jednobuněčnosti samozřejmě nemohou onemocnět
nádorovým onemocněním. My jsme eukaryoti s velkým
množstvím buněk různých druhů, propojených množstvím
složitých signálních drah; právě tato okolnost umožňuje
vznik nádorových onemocnění v důsledku cytogenetických
mutací, m.j. i působením ionizujícího záření. Hodně zde
však může záležet na fungování a míře radiačně
indukované reparace.
Teprve další bádání v oblasti
molekulární biochemie a cytologie, jakož i rozsáhlejší
studie epidemiologické, snad pomohou otázku účinku malých
dávek záření blíže objasnit. Dokud toto není spolehlivě
objasněno, je z hlediska spolehlivosti radiační
ochrany nutno v praxi aplikovat lineární bezprahovou
teorii, která je v oblasti malých dávek spojena spíše s
mírným nadhodnocením rizika a malou pravděpodobností
možného podhodnocení.
Pokud se však výše
uvedené závěry prokáží v dalších experimentech a
následně i v klinických studiích, lze v budoucnu očekávat změnu
konzervativního paradigmatu současné radiační
ochrany v oblasti nízkých dávek záření a následně pak i revizi
příslušných norem a předpisů. Radiofobie,
která je vlivem masmédií hluboce zakořeněna v západní
společnosti, však bude asi přetrvávat velmi dlouho...
Časový
průběh a druhy biologických účinků záření
Z hlediska doby nástupu a časového průběhu účinků
záření na organismus, či jeho tkáně a orgány, rozlišujeme
dvě skupiny - časné a pozdní účinky :
× Časné účinky ozáření
se vyvíjejí během poměrně krátké doby (dny až týdny) po
jednorázovém ozáření větší dávkou záření. Jsou
způsobeny zánikem významné části buněk ozářené tkáně,
především kmenových buněk, u rychle proliferujících
tkání, v nichž je potřebná průběžná rychlá obnova
dceřinných efektorových buněk, které mají krátký
životní cyklus. Deplece kmenových buněk se
záhy projeví v úbytku buněk efektorových, což se odrazí ve
zhoršení funkce ozářené tkáně. Tyto tkáně (např.
krvetvorná tkáň či buňky sliznic) mají vysokou
radiosenzitivitu a rychlou reakci na ozáření. Jedná se o
akutní účinky deterministické a platí zde pravidlo, že
čím vyšší je dávka, tím dříve
nastupují účinky a tím jsou též závažnější.
Pokud není poškozeno příliš mnoho kmenových buněk, po
překonání těchto časných účinků nastává též
poměrně rychlé zotavení tkáně buněčnou
repopulací (akcelerovaným
dělením kmenových buněk, s příp. přechodnou ztrátou
asymetrie dělení ve prospěch efektorových buněk) a její návrat k normální funkci. S delším
časovým odstupem se však mohou vyskytnout pozdní
radiační účinky (deterministické a stochastické),
diskutované níže.
Velmi časné
radiotoxické účinky
Při celotělovém ozáření vysokou dávkou záření se velmi
rychle, během několika hodin, mohou objevit velmi časné
příznaky stresové reakce organismu, jako je únava, nevolnost,
sucho v ústech. Tyto projevy velmi časné radiotoxicity
nejsou způsobeny mechanismy radiačního zabíjení buněk -
větší počet buněk je sice poškozen, avšak toto poškození
se projeví později, až při mitóze těchto buněk. Velmi
časná radiotoxicita je zde způsobena podrážděním
regulačních center organismu (nervových a humorálních)
přímým působením ozářením uvolněných iontů,
radikálů a dalších zplodin radiolýzy. Při
velmi vysokých dávkách (stovky Gy jednorázově) pak mohou
nastoupit velmi rychlé a fatální radiotoxické účinky vlivem
denaturace buněčného obsahu (rychlá nekrotická smrt
buněk) i mezibuněčného prostředí.
Mezi časné účinky ozáření - časnou
radiotoxicitu - patří:
- Akutní nemoc z
ozáření (akutní
postradiační syndrom)
Vzniká po jednorázovém ozáření celého těla
(či jeho větší části) dávkami většími než asi
1Gy. Klinický průběh zde závisí na velikosti dávky.
Při dávkách od cca 3 do 8Gy vzniká krevní
(dřeňová, hematologická) forma způsobená
poškozením orgánů krvetvorby. V krevním obraze
výrazně poklesne počet bílých krvinek, lymfocytů,
klesá i počet červených krvinek a krevních
destiček. Pokud jsou v kostní dřeni zachovány
ostrůvky funkčních kmenových buněk krvetvorby,
může jejich dělením docházet k postupné regeneraci
po 6-8 týdnech. Při dávkách kolem 10Gy jsou buňky
krvetvorby zpravidla nevratně zničeny, dávka je
smrtelná, pokud se nepodaří kostní dřeň úspěšně
nahradit transplantací.
Při dávkách vyšších než 10Gy se navíc
rozvíjí střevní
(gastrointestinální) forma nemoci z ozáření,
způsobená zničením buněk střevní výstelky. Zde
dochází k závažným poruchám hospodaření organismu
s tekutinami a minerály, s možností bakteriální
toxémie.
Při ještě vyšších dávkách na úrovních
desítek a stovek Gy nastupuje velmi rychle po ozáření
nervová či neurovaskulární
forma akutní nemoci z ozáření, spojená se zánikem
většího množství nervových buněk (přímým
poškozením nervových buněk nebo hypoxií v důsledku
poškození cév), následnými poruchami orientace a
koordinace, bezvědomím a smrtí. Buňky jsou již v
interfázi usmrcovány nekrózou, což vyvolává akutní
záněty.
Akutní nemoc z ozáření má čtyři
časová stádia:
- Časná fáze, zvaná též prodromální,
zmíněná výše; velmi rychle odeznívá.
- Latentní fáze, během níž
se neprojevují žádné subjektivní potíže. Se
vzrůstající dávkou záření se latentní fáze
zkracuje.
- Manifestní fáze, v níž
dochází k plnému rozvoji nemoci z ozáření,
způsobenému zánikem velkého počtu buněk. Projevuje
se zvýšená únava, teplota, krvácení, záněty
sliznic, možnost rozvoje bakteriálních a virových
infekcí. Tato fáze trvá cca 4-6 týdnů.
- Fáze rekonvalescence v
příznivém případě, kdy podle závažnosti nemoci z
ozáření postupně dochází k částečnému nebo
úplnému uzdravení. Usmrcené buňky jsou nahrazeny
dělením buněk zdravých.
- Akutní radiační
dermatitida
Při ozáření kůže dávkami nad 3Gy dochází k
dermatitidě 1.stupně - k erytému (zrudnutí) kůže a
ztrátě ochlupení, při dávkách nad 10Gy pak
dermatitida 2.stupně spojená s puchýři a vředy na
kůži, dále k nekróze (dermatitis 3.stupně).
Radiační dermatitidy jsou doprovázeny degenerativními
změnami kůže a obtížně se hojí.
- Radiační záněty,
kterými může tkáň reagovat na rychlý zánik
většího počtu buněk za vzniků zplodin buněčného
rozkladu.
- Poškození fertility
- Poškození embrya
a plodu
Lidský zárodek a plod, tvořený intenzívně se
dělícími buňkami, je velice citlivý
k ionizujícímu záření; k jeho poškození může
dojít již při ozáření dávkou od 0,1Gy. Charakter
poškození plodu ionizujícím zářením závisí,
kromě výše radiační dávky, především na stádiu
vývoje, tj. na době uplynulé od oplodnění.
V počátečních fázích (v
prvních 3 týdnech), kdy počet buněk v zárodku je
ještě malý a jejich funkce není specializována, má
jejich radiační poškození zpravidla za následek zánik
zárodku a ukončení gravidity. Charakter
tohoto účinku v raném stádiu embrya se někdy
označuje heslem "všechno nebo nic" -
zárodek buď zanikne, nebo přežije bez následků.
V období hlavní organogeneze (od
3. do 8.týdne) může ozáření způsobit malformace
ve vyvíjejících se orgánech zárodku. Při ozáření
plodu v období 2.-6.měsíce gravidity se objevuje
riziko vývojových poruch a
mentálního postižení narozeného dítěte.
V posledním trimestru gravidity již nastupuje
relativně vyšší radiorezistence. Avšak každopádně
je třeba upozornit na to, že od 4.týdne ozáření
plodu vede k podstatně vyššímu riziku
stochastických účinků nádorového charakteru,
2-3-krát vyššímu než je tomu při ozáření
dospělých osob. Tyto nádory se mohou potom
manifestovat v dětství nebo v dospělosti.
× Pozdní účinky ozáření
se mohou projevit po několika měsících, letech až
desítkách let latence od ozáření. Vznikají buď jako deterministické
účinky po intenzívním ozáření, dlouhodobé či
opakované expozici menšími dávkami záření (nenádorová
pozdní poškození - pozdní radiotoxicita),
nebo jako stochastické účinky (nádorová a
genetická postižení). Pozdní deterministické účinky jsou
způsobeny poškozením tkání s pomalou obnovou efektorových
buněk a tedy s nízkou proliferační aktivitou kmenových
buněk. Poškození kmenových buněk ozářením se projeví až
při potřebě jejich mitózy pro doplnění buněk
efektorových, což zde bývá s odstupem řádově měsíců.
Pak teprve poškozené kmenové buňky hynou a v tkáni se začne
projevovat nedostatek efektorových buněk. Tkáně tohoto typu
(jako jsou pojivové tkáně, svalové tkáně, ledviny) s
pomalým buněčným dělením mají nízkou radiosenzitivitu a
pomalou reakci na ozáření. Účinky však přetrvávají
dlouho, někdy jsou i trvalé.
Kombinace časných a
pozdních radiačních účinků
Jednotlivé orgány jsou často tvořeny různými druhy
funkčně propojených tkání - rychle i pozdně reagujících,
v rámci jednoho orgánu. Při ozáření proto nejdříve
nastoupí časná akutní radiotoxicita, po jejím odeznění se
pak s časovým odstupem může projevit následná
(konsekvenční) pozdní radiotoxicita. Např. při ozáření
plic může po akutní radiační pneumonitidě postupně dojít
k rozvoji pozdní plicní fibrózy.
Mezi pozdní účinky záření zařazujeme následující druhy
radiačního poškození (první dva jsou
deterministické, druhé dva stochastické):
- Chronická
radiační dermatitida -
vyskytovala se zvláště u rentgenologů, kteří
prováděli skiaskopická rentgenová vyšetření bez
dostatečné ochrany.
- Zákal oční
čočky (katarakta) může
vzniknout po ozáření očí dávkami vyššími než
cca 4-8 Gy.
- Zhoubné nádory - jsou nejzávažnějšími pozdními
somatickými účinky stochastické povahy. Mohou vznikat
jako následek mutací, které vyústí
ve ztrátu kontroly nad dělením buněk a maligní
transformaci postižených buněk - §3.6 "Radioterapie", pasáž "Kancerogeneze".
- Genetické změny se projevují postižením potomstva
ozářených osob na základě mutací v zárodečných
buňkách.
Lokální radiační účinky
tkáňové a orgánové
Biologické radiační účinky jsme nejprve rozebírali na molekulárně-buněčné
a obecně tkáňové úrovni (viz výše
"Účinky záření na buňky", "Radiační
účinky během buněčného cyklu"). Ukázali jsme si různou citlivost buněk v
jednotlivých fázích buněčného cyklu a z toho plynoucí
rozdílnost radiosenzitivity pro buňky kmenové a efektorové,
jakož i pro různé tkáně a orgány. Analyzovali jsme dále
závislost biologických účinků na velikosti absorbované
dávky a jejím časovém průběhu ("Lineárně-kvadratický
model deterministického radiačního účinku"). Pak jsme se věnovali radiačním účinkům na
organismus především při celotělovém ozáření.
Častým případem radiační expozice však je
dominantní ozáření jen určité části
těla, určitého orgánu nebo tkáně. Zvláště v případě radioterapeutického
využití ionizujícího záření (§3.6
"Radioterapie") je exponována určitá
pečlivě vybraná část - nádorové ložisko (cílový objem),
přičemž určité dávky obdrží i okolní zdravé tkáně a
orgány. V těchto případech jsou velmi důležité specifické
aspekty radiační citlivosti a odezvy různých druhů tkání a
orgánů na různou prostorově-časovou distribuci
dávky. Z hlediska charakteru citlivosti na prostorové
rozložení radiační dávky v tkáních a orgánech je
důležité "organizační uspořádání" a
velikosti jednotlivých funkčních částí. Obecně jsou
organismy složeny z buněk, sdružujících se do tkání a
funkčních celků - orgánů. Orgány
se skládají z menších skupin buněk, které zajišťují
funkci v jednotlivých částech orgánu - z tzv. funkčních
podjednotek. Funkční podjednotky mívají různé
velikosti a jsou různě vzájemně propojeny a organizovány v
rámci daného orgánu, příp. jeho návaznosti na další
tkáně a orgány. Podle uspořádání funkčních podjednotek
můžeme biologické orgány rozdělit na dva základní typy:
¨
Sériový orgán
je tvořen řadou lineárně uspořádaných buněčných
struktur (funkčních podjednotek), které jsou funkčně řazeny
za sebou (sériově). Specializovaná
činnost buněk jednoho úseku funkčně navazuje na činnost
buněk předchozího úseku. Lokální poškození i jednoho
poměrně malého místa (úseku) může vést k
"výpadku" funkce celého navazujícího zbytku
orgánu. Příkladem seriového orgánu je mícha, zrakový nerv,
jícen, ureter, střevo a pod.
¨
Paralelní orgán
sestává z mnoha buněčných struktur (funkčních podjednotek)
zhruba stejné funkce, které zaujímají větší
prostor a jsou řazeny vedle sebe (paralelně),
pracují "společně". Lokální poškození menšího
objemu takové tkáně se neprojeví výrazně v činnosti
celého orgánu, zbylé buňky stačí funkčně pokrýt jeho
činnost pro organismus - tyto orgány mají značnou funkční
rezervu. Příkladem paralelních orgánů jsou játra,
plíce, ledviny, štítná žláza, slezina atd.

Při detailním pohledu je sériové a
paralelní uspořádání částečně kombinováno -
např. paralelně propojené části s lokálním sériovým
uspořádáním elementárních funkčních podjednotek. A
orgánové systémy či trakty (GIT, močové ústrojí) jsou
složitým sério-paralelním uspořádáním mnoha různých
částí a funkčních podjednotek.
Sériové a
paralelní orgány mají rozdílné radiobiologické
chování z hlediska prostorové distribuce radiační
dávky. Sériové orgány mohou poměrně dobře tolerovat dávku
rovnoměrně rozloženou na celý svůj objem, popř.
celotělovou dávku, ale jsou velmi citlivé k vysoké
lokální dávce, která je může "vyřadit z
činnosti". Opačně se chovají paralelní orgány, které
dobře tolerují i velmi vysokou lokální dávku na malý objem
(jehož likvidace sníží funkci jen nevýznamně), avšak poškozuje
je úhrnná dávka na celý jejich objem, resp.
záleží na celkovém objemu ozářené tkáně. Tento
rozdílný charakter radiační citlivosti sériových a
paralelních orgánů na prostorovou distribuci dávky má velký
význam v radioterapii, kde zvláště sériové
orgány často vystupují v roli tzv. kritických
orgánů, u nichž by se neměla překročit toleranční
dávka (viz §3.6 "Radioterapie").
Zdroje
ozáření ionizujícím zářením
Po celou dobu trvání a evoluce života na Zemi jsou všechny
organismy vystaveny ionizujícímu záření z přírodních
zdrojů - z kosmického záření (§1.5.,
část "Kosmické záření") a z přírodních
radionuklidů (§1.4., část "Přírodní
radionuklidy"). Stejně je tomu i po celou dobu existence člověka.
Od začátku 20.stol., po objevu rtg záření a radioaktivity,
přistupuje k přírodním zdrojům i řada umělých
zdrojů ionizujícího záření, které se stále
častěji využívají v mnoha oborech medicíny, výzkumu i
průmyslu. Podle svých fyzikálních a chemických vlastností
způsobují zdroje ionizujícího záření buď vnější
nebo vnitřní ozáření. Vnější ozáření
způsobují zdroje nacházející se vně organismu, vnitřní
ozáření je způsobeno zářením z radionuklidů,
nacházejících se v lidském těle. Způsob ozáření a
konkrétní dávky záření dále závisejí na výskytu a
pohybu jednotlivých zdrojů (přírodních i umělých) v
životním prostředí.
P
ř
í
r
o
d
n
í
---
U
m
ě
l
é
|
Zdroj
záření |
Efektivní
dávka
[mSv/rok] |
Podíl
[%] |
88%
-----
12%
|
| Radon (a jeho rozpadové produkty) |
2,1 |
48 |
| Zemské (terestrální) záření |
0,45 |
17 |
| Vnitřní ozáření přírodními
radionuklidy v těle |
0,25 |
9 |
| Kosmické záření (sekundární) |
0,4 |
14 |
| -------------------------------------------- |
------------- |
---- |
| Lékařská ozáření (diagnostika,
terapie) |
0,3 |
11 |
| Profesní ozáření |
0,002 |
0,08 |
| Technické a spotřební předměty |
0,005 |
0,02 |
| Jaderná energetika (mimo havárie) |
0,001 |
0,04 |
| Radioaktivní spad (jaderné zbraně a
havárie) |
0,005 |
0,02 |
| Přibližné hodnoty průměrné
radiační dávky z jednotlivých zdrojů záření
vztažené na 1 člověka za 1rok |
Průměrná roční dávka z ozáření z
přírodních zdrojů pro člověka činí zhruba 3,2 mSv, z
umělých zdrojů se odhaduje na cca 0,3 mSv/rok. V současné
době tedy v průměru zhruba 90% radiační zátěže
představují přírodní zdroje a 10% zdroje umělé; v každém
případě se v průměru jedná o velmi malé dávky
záření.
Přírodní
zdroje ionizujícího záření
V našem životním prostředí jsme neustále vystaveni
ionizující radiaci z kosmického záření a z
přírodních radionuklidů ve vzduchu, v obklopujících
předmětech, v půdě a horninách, stavebních materiálech i v
našich tělech. Přírodní zdroje způsobující radiační
dávku v živých organismech a člověku můžeme podle jejich
charakteru a významnosti rozdělit na tři složky:
- 1. Vnitřní
ozáření přírodními radioisotopy
V každém organismu je přítomno určité velmi malé
množství přírodních radionuklidů, které svým
ionizujícím zářením vyvolávají vnitřní
ozáření. Terestrální a kosmogenní
radionuklidy vstupují do těla přes potravu
kterou jíme, vodu kterou pijeme s vzduch
který dýcháme *). Chemické látky obsahující
radionuklidy pak vstupují do metabolismu,
některé se opět rychle vylučují
dýcháním a vylučováním (především močovými
cestami), jiné se vylučují pomaleji a mohou se hromadit
v určitých tkáních (především v kostech). Jedná
se především o radon a draslík 40K.
*) Veškerá
příroda (pozemská i vesmírná) obsahuje určité malé
množství radioaktivity, především
přírodních radioaktivních prvků. Sloučeniny
primárních a sekundárních radionuklidů
(radioaktivních rozpadových řad) se z hornin
při jejich erozi dostávají do půdy,
do vody a do vzduchu (především přes plynný radon). Při spalování uhlí se do
ovzduší dostávají některé přírodní radionuklidy (především radon 222Rn, polonium 210Po a olovo 210Pb), které se ve
větších hloubkách hromadí v důsledku rozpadu
primárních přírodních radionuklidů uranu a thoria.
Při sopečné činnosti je ve
vyvrhovaných oblacích sopečného kouře a prachu
obsaženo značné množství radionuklidů radonu,
polonia-210, olova-210 z velkých podzemních hloubek.
Rovněž sloučeniny kosmogenních radionuklidů
se z atmosféry dostávají do biosféry. Z půdy, vody a
vzduchu se přírodní radionuklidy dostávají do
rostlin a v potravním řetězci dále do živočichů i
člověka.
Radon a jeho rozpadové
produkty
Radon 222Rn je radioaktivní plyn, který vzniká
rozpadem rádia 226Ra (toto rádium je jedním z produktů
rozpadové řady uranu). 222Rn je a-zářič s poločasem rozpadu 2,8 dne a
rozpadá se na řadu dalších radioaktivních prvků
uranové rozpadové řady. Samotný radon, jakožto
inertní plyn, je po vdechnutí z velké části zase
vydechnut, avšak dceřinné produkty radonu (jako je 218Po) se
absorbují a zachycují ve vzduchu na prachových
částicích - při vdechování se usazují v plících
a průduškách a dlouhodobě tyto tkáně ozařují
zářením a o vysoké energii (cca 7MeV) a radiační
účinnosti.
Stromy -
radonové pumpy?
Radon je částečně rozpustný ve vodě, takže z
hornin přechází do podzemních vod. Stromy svými
kořeny nasávají tuto spodní vodu s rozpuštěným
radonem a přes listy či jehlice ji vypařují do
atmosféry. Stromy, zvláště ty s velkým a hlubokým
kořenovým systémem, mohou působit jako "radonové
pumpy", které vytahují radon z podzemí a
uvolňují jej do ovzduší. Odhaduje se, že takto
stromy odpovídají za asi 20-30% vzdušného radonu,
především v hustěji zalesněných oblastech (v
samotném dřevě stromů se isotopy rozpadových řad
uranu téměř neakumulují, vyskytuje se zde však
draslík 40-K a hlavně 14-C).
Ve volné
atmosféře se radon rychle rozptyluje, avšak v
uzavřených místnostech a prostorách se může
výrazně koncentrovat. Hlavním zdrojem
plynného radonu jsou dutiny v zemi (podloží),
minerály (obsahující uran a tím i radium) a stavební
materiál vytvořený z těchto minerálů. Riziko radonu
je geograficky velmi proměnlivé, u nás se zvýšený
"radonový index" vyskytuje na
Příbramsku a Jáchymovsku.
Množství radonu v obytných místnostech (pokud je zvýšený výskyt radonu na daném
území nebo v použitém stavebním materiálu) lze snížit některými technickými úpravami
- utěsněním trhlin v podlahách a sklepních
prostorách, izolačními nátěry zdiva, především
však odvětráváním prostorů pod
podlahami a v nejnižších místech (radon je těžký
plyn, hromadí se dole). Průměrná roční efektivní
dávka záření z radonu se odhaduje na cca 2,1 mSv,
avšak je velmi proměnlivá v závislosti na lokalitě
pobytu.
Další přírodní radionuklidy uvnitř
organismu
Dalším vnitřním radionuklidem je draslík
40K, který je spolu s běžným
neaktivním draslíkem obsažen v tkáních těla
(organismus dospělého člověka obsahuje cca 150g
draslíku, z čehož je asi 0,012% 40K o celkové aktivitě cca 4kBq). Dále jsou to,
v menší míře, kosmogenní radionuklidy uhlík 14C a tritium 3H a též
radionuklidy rozpadových řad uranu 238U a thoria 232Th - 226Ra, 222Rn, 210Po, 210Pb a
další; o radonu bylo však pojednáno výše v
samostatném odstavci. Celková dávka z těchto
vnitřních radionuklidů (mimo radonu) se odhaduje na
0,2 mSv/rok.
- 2. Terestrální
záření
V půdě, horninách, vodě i v atmosféře jsou
přítomny přírodní radionuklidy,
které svým zářením g (a částečně i
zářením b, pokud má vysokou energii) přispívají k
vnějšímu ozáření organismu. Jsou to především
primární radionuklidy thorium 232Th a uran 238+235U se svými rozpadovými produkty, a dále již
zmíněný izotop draslíku 40K. Průměrná dávka z tohoto vnějšího
zemského záření pro člověka se odhaduje na cca 0,45
mSv/rok.
- 3. Kosmické
záření
Významnou a permanentní složkou přírodního
radiačního pozadí je kosmické záření. Primární a
sekundární kosmické záření, včetně produkce
kosmogenních radionuklidů, je podrobněji popsáno v
§1.6 "Ionizující záření", pasáž "Kosmické záření".
Průměrná dávka ze sekundárního kosmického
záření pro člověka se odhaduje na 0,4 mSv/rok.
Individuálně však dávkový příkon výrazně
závisí především na místě v atmosféře, tj. na nadmořské
výšce: při zemi (0m): 0,03mSv/hod., ve výšce
2km: 0,1mSv/hod., ve vysokohorské výšce 6km: 1mSv/hod., ve
výšce 10km: 5mSv/hod., v 15km: 10mSv/hod. Sekundární
kosmické záření představuje významné radiační
riziko pro pracovníky letadel pohybujících se ve
výškách kolem 10km, primární kosmické záření
radiačně zatěžuje posádky kosmických sond.
- 4. Atmosférické
výboje
Menší množství X a gama záření vzniká při
atmosférických výbojích - blescích
mezi bouřkovými mraky a zemí (viz §1.6., část
"Zdroje ionizujícího záření", pasáž "Elektrické výboje v
atmosféře"). Jedná se o krátké záblesky
záření g, které díky svému sporadickému výskytu
nijak znatelně nepřispívají k radiační
zátěži ve srovnání s kontinuálním radiačním
pozadím - radonem, kosmickým a terestrálním
zářením (i pro letadlo, které se dostane do
bouřkových mraků, jsou jiná daleko vážnější
rizika...).
Umělé
zdroje ionizujícího záření
Ionizující záření z umělých zdrojů můžeme podle jeho
povahy a radiační významnosti rozdělit do tří kategorií:
- Lékařské
aplikace záření
Použití ionizujícího záření pro diagnostické
a léčebné účely v medicíně
je nejvýznamnějším ze všech uměle vytvořených
zdrojů záření. Jedná se především o X-záření v
rentgenové diagnostice a terapii, radioterapii
g-zářením a diagnostické a terapeutické
použití otevřených radionuklidů v nukleární
medicíně. Všechny tyto metody byly podrobně
popsány v jednotlivých kapitolách našeho pojednání
"Jaderná fyzika a fyzika ionizujícího
záření". Celková průměrná dávka z
lékařského ozáření se odhaduje na cca 0,3 mSv/rok
(je však vemi silně individuálně i geograficky
závislá). Podrobněji jsou dávky při jednotlivých
metodách diagnostického využití záření v
rentgenologii a nukleární medicíně uvedeny níže v
tabulce 5.7.1 v §5.7 "Radiační zátěž při
radiačních vyšetřeních".
- Technické a
spotřební předměty
Výrobky moderní technologie, se kterými se stále
častěji setkáváme i v běžném životě, mohou
emitovat určité malé množství ionizujícího
záření. Toto záření tam vzniká buď elektronickým
způsobem (obrazovky televizní, počítačové,
přístrojové), nebo mohou obsahovat radioaktivní
látky v uzavřené či otevřené formě (např.
požární hlásiče, radioaktivní svítící hmoty).
.......
- Jaderná technika
Jaderné reaktory, využívající štěpné reakce uranu
především k výrobě energie (viz §1.3.
"Jaderné reakce", pasáž "Štěpení atomových jader"), za normálního provozu v okolním
životním prostředí zvyšuje úroveň záření jen nepatrně
tím, že ve výpustích odchází do ovzduší a vody
jen velmi malé množství radioisotopů. Vliv jaderných
elektráren na životní prostředí se trvale kontroluje
monitorováním výpustí a celého okolí jaderné
elektrárny.
Radioaktivní
odpady z reaktorů
Jedním z hlavních problémů současné jaderné
energetiky je vyhořelé jaderné palivo,
které obsahuje vysoké množství řady radioisotopů,
často s velmi dlouhým poločasem rozpadu. Jejich únik
do biosféry je po dlouhou dobu potenciálním rizikem.
Vedle poměrně krátkodobých radionuklidů (jako je 131J s T1/2 8dnů) je
zde obsaženo velké množství např. 137Cs (T1/2 30roků), 90Sr (T1/2 28,8roků),
241Am
(T1/2 458roků), 239Pu (T1/2 2.104roků), 240Pu (T1/2 6.103roků) a řada dalších dlouhodobých
radionuklidů. S těmito nebezpečnými radioaktivními
odpady je možno nakládat v zásadě dvojím způsobem.
1. Ukládání těchto
odpadů na bezpečné úložiště,
které by mělo zajistit, aby se dlouhodobé radioisotopy
obsažené ve vyhořelém palivu nedostaly po dobu
několika tisíc let do biosféry. To není nikterak
snadné technicky zajistit - jsou kladeny vysoké
požadavky na těsnost a odolnost obalů vůči korozi,
úložiště musí být vhodné i z geologického
hlediska.
2. Přepracování
vyhořelého jaderného paliva, při němž je jednak
možno některé složky vyhořelého jaderného paliva
znovu využít, jednak převážnou část
dlouhožijících radionuklidů přeměnit
na jiné isotopy, které by byly buď stabilní, nebo
měly podstatně kratší poločasy rozpadu. Vyhořelé
jaderné palivo by tak přestalo být obtížným
odpadem, ale mohlo by se dokonce stát i důležitou surovinou.
V tomto směru by mohly být perspektivní tzv. transmutační
technologie s využitím neutronů
produkovaných ozařováním výkonnými urychlovači,
viz příslušnou pasáž v §1.3 "Jaderné
reakce".
Jaderné havárie
a jaderné zbraně
Shora uvedená příznivá radiační situace při
bezporuchovém chodu jaderných technologií se může
dramaticky změnit, pokud dojde k havárii
jaderného reaktoru, nebo ke zneužití jaderné
energie ve službách zločinu a války - zkoušce či
dokonce aplikaci jaderné zbraně. V
takovém případě (kromě dalších ničivých
účinků) dojde k rozsáhlé kontaminaci,
při níž se do ovzduší dostává velké množství
radioaktivních látek, které se postupně dostávají
(především s dešťovými srážkami) na zemský
povrch jakožto radioaktivní spad,
který dlouhodobě kontaminuje půdu a vodu.
Nadzemní zkoušky jaderných zbraní se prováděly v
50. a 60. letech, v r.1963 však byly zastaveny.
Poslední významnou radiační havárií, spojenou s
rozsáhlou kontaminací, byla havárie jaderné
elektrárny v Černobylu v r.1986. U reaktorů novější
konstrukce již taková havárie nehrozí. Průměrná
dávka záření z radioaktivního spadu tohoto původu
nepřesahuje cca 0,3% dávky z ostatních zdrojů.
- Profesionální
ozáření
K profesionálnímu ozáření osob ionizujícím
zářením začalo docházet prakticky okamžitě po
objevu rtg záření a radioaktivity, v době, kdy se o
rizicích a škodlivých účincích tohoto záření
ještě nevědělo, radiační dávky se neznaly a
neměřily, pracovníci se před zářením nijak
nechránili. Vysoké dávky záření nepochybně obržel
při svých pokusech s katodovými trubicemi již
W.C.Röntgen, paní M.Curieová při izolaci radia, a
mnoho jejich následovníků. Velmi vysoké
dávky záření, spojené s deterministickými
účinky a trvalým poškozením zdraví,
dostalo několik prvních generací rentgenologů,
kteří se nijak nechránili. Stejně tak mnoho
jaderných fyziků při experimntech ve 20.-40.letech;
došlo dokonce k řadě smrtelných radiačních nehod. V
průběhu 30.-50.let byly prostudovány a nezvratně
prokázány škodlivé biologické účinky
ionizujícího záření, což vedlo k postupnému
konstituování postupů a norem radiační
ochrany. Dodržování pravidel radiační
ochrany, spolu se zvýšením technologické úrovně
radiačních zařízení, přístrojů a metod, vedlo k
podstatnému snížení radiační zátěže
u pracovníků s ionizujícím zářením, často i na
prakticky nulovou hodnotu (úroveň přírodního
pozadí).
K ozařování pracovníků ionizujícím zářením
dochází především ze zdrojů umělých - rtg
přístroje, používání radionuklidů k diagnostice a
terapii, jaderné reaktory, urychlovače částic a pod.
Může to však být ozáření i ze zdrojů
přírodních, které jsou záměrně využívány -
např. u pracovníků uranových dolů, úpraven rud a
pod. Všechna tato ozáření osob při práci s
ionizujícím zářením jsou kontrolována a
usměrňována příslušnými normami a
předpisy radiační ochrany (viz
níže), pro pracovníky jsou stanoveny limity
dávek záření. Pro ověřování a optimalizaci
radiační ochrany slouží radiační monitorování
pracovníků, pracovního prostředí i radioaktivních
odpadů. Průměrná roční dávka radiačních
pracovníků z profesionálního ozáření se nyní
odhaduje na cca 1mSv.
5.3.
Cíle a metody ochrany před zářením
Základní cíle
radiační ochrany
Prokázané škodlivé deterministické účinky
silného záření *), jakož i riziko
škodlivých stochastických účinků slabého záření
(odhlédneme-li zde od shora zmíněných alternativních
možností účinků nízkých dávek záření), vede k nutnosti
ochrany před ionizujícím zářením. Tato radiační
ochrana či radiační hygiena
představuje systém technických a organizačních opatření k
omezení nežádoucího ozáření fyzických organismů
(především osob) a k ochraně životního prostředí před
tímto zářením.
*)Máme zde samozřejmě na mysli
škodlivé účinky záření na zdravou tkáň,
nikoli cílené deterministické účinky na patologická
ložiska v radioterapii, které jsou pro organismus prospěšné
(viz kapitola 3.6 "Radioterapie")!
Základní cíl radiační ochrany
můžeme tedy formulovat takto:
| Cílem
radiační ochrany je vyloučení deterministických
účinků ionizujícího záření a snížení
pravděpodobnosti stochastických účinků na rozumně
dosažitelnou úroveň. |
Riziko z ionizujícího záření je přídatné
k ostatním rizikům, kterým jsme během života
vystaveni - škodliviny v životním prostředí a potravinách,
kouření, genetické vlivy, infekční a jiné nemoci atd.
Ze statistického hlediska se tato rizika
někdy vzájemně srovnávají podle určitých nominálních
koeficientů rizik. Tyto nominální koeficienty rizik
jsou stanovovány statisticky z určité
přídatné četnosti výskytu onemocnění či úmrtí v
závislosti na rizikových faktorech. Přesnost takových
stanovení je však neurčitá a diskutabilní,
vystupuje zde řada faktorů a výběrových efektů,
často neznámých. V našem fyzikálně
zaměřeném pojednání o účincích záření a radiační
ochraně se proto těmito otázkami nezabýváme.
Specifická
povaha ionizačního ozáření organismu
Ve srovnání s většinou ostatních škodlivin, které na naše
organismy působí, má ionizující ozáření svá význačná
specifika:
¨
Ionizující záření není
postižitelné našimi smysly.
Pokud se člověk nachází v místě exponovaném ionizujícím
zářením, nijak to nepociťuje. A to ani při
velkých intenzitách *), kdy radiační dávka záhy
překračuje smrtelnou hodnotu! Pokud nemáme "po ruce"
vhodný radiometr, nedovedeme nijak posoudit nebezpečnost této
situace.
*) Při velkých intenzitách záření
může být varovným signálem ozón, který je cítit ve
vzduchu.
¨
Počáteční příznaky nemoci z
ozáření
se prakticky neliší od počátečních příznaků běžných
nemocí, jako je nachlazení nebo chřipka. Pokud není
podezření na ozáření, nemusí být radiační nemoc včas
rozpoznána a adekvátně léčena.
¨
Delší doba klinické manifestace
pozdních účinků záření
při dávkách do cca 3Gy, a zvláště stochastických
účinků, může vést k tomu, že případné zdravotní
potíže nebudeme spojovat s ozářením v minulosti.
¨
Nízká úroveň znalostí
z oblastí jaderné fyziky, radioaktivity a ionizujcího
záření v běžné populaci lidí. To vede k podcenění či
přecenění rizik záření a radiační ochrany, vzniku
různých desinformací a fám (jako je radiofobie a odpor proti
jaderné energetice).
Principy
radiační ochrany
Z obecného hlediska se při zajišťování cílů radiační
hygieny používají tři základní principy:
- Princip odůvodněnosti
Při činnosti vedoucí k ozáření ionizujícím
zářením je nutno zajistit, aby toto ozáření bylo
odůvodněno přínosem, který vyvažuje
(či lépe převažuje) rizika, která při této
radiační činnosti vznikají.
Objektivní posuzování odůvodněnosti radiačního
ozáření může být značně složité
a diskutabilní. Vstupuje zde do hry mnoho faktorů
"přínosů", "ztrát" a nákladů
(souvisí i s následujícím aspektem optimalizace), z
nichž některé ani nelze kvantitativně vyčíslit.
Přesto se někdy podobné vyčíslování provádí
(pomocí vzorce, v němž se od pozitivního výsledku
radiační činnosti odpočítávají "ztráty"
plynoucí z radiačního rizika, náklady na radiační
ochranu a příp. další položky), avšak podobná
analýza bývá v reálné situaci subjektivní,
často se porovnávají "jablka s hruškami"...
- Princip optimalizace
Při činnostech doprovázených ionizačním ozářením
je nutno dodržovat takovou úroveň radiační ochrany,
aby riziko škodlivých účinků bylo optimálně
nízké, nakolik je lze rozumně
dosáhnout z hlediska cílů aplikace,
technických a ekonomických možností.
Tento princip optimalizace
radiačního ozáření se někdy označuje zkratkou ALARA
("As Low As Reasonably Achievable"), dosažení
tak nízkých dávek, jaké jsou přiměřené
objektivním možnostem a potřebám. Princip
optimalizace je velmi důležitou a rozumnou
"střední cestou" mezi podceňováním rizika
na jedné straně a na druhé straně neodůvodněnými
hysterickými požadavky (plynoucími často z účelově
podněcované radiofobie) na zajištění absolutní
ochrany *) a nulových dávek, ať to stojí cokoli, bez
ohledu na možnou kontraproduktivnost i z hlediska
proklamovaných cílů. Nasměrování technických a
ekonomických prostředků do vhodných zdravotních a
sociálních programů může výrazněji zlepšit
zdraví a kvalitu života lidí (či dokonce zachránit
více lidských životů), než prostředky směrované
do přehnané, neúčelné a iracionální radiační
ochrany!
*) Tento maximalistický přístup
se někdy uvádí pod zkratkou ALAPA
("As Low As Possible Achievable") - dosažení
co nejnižších dávek, jak je to jen možné. Se
zkratkou ALAPA se vedle radiační ochrany můžeme
setkat i v řadě jiných oblastí medicíny a techniky,
někdy i ve znění "As Low As Practically
Achievable", nebo "As Low As Practically
Applicable" (pomineme-li jiné významy tohoto
slova, např. alapa = úvodní melodická část
indické rágy...).
V radiační diagnostice (RTG,
scintigrafii) to znamená, aby
obrazová data byla získána v dostatečné
kvalitě při co nejnižší radiační
dávce.
- Princip limitování
Při činnostech s ionizujícím zářením je třeba omezovat
ozáření osob tak, aby celková radiační
dávka za určitá období (většinou 1rok a 5let)
nepřesahovala stanovené limity.
Konkrétní hodnoty limitů a jejich vztah ke
skutečnému radiačnímu riziku prochází neustále vývojem.
Limity byly zavedeny v r.1956, určitým mezníkem bylo
doporučení ICRP z r.1977. Bylo zavedeno několik druhů
limitů ozáření - obecné limity pro obyvatelstvo,
limity pro radiační pracovníky,
limity pro těhotné ženy. V technických aplikacích se
dále zavádějí některé odvozené limity
(např. limity aktivity odpadních vod), jejichž
dodržení zaručuje nepřekročení limitů radiačních
dávek pro osoby za definovaných podmínek. Limity
obecně nemůžeme považovat za hodnoty oddělující
radiační neškodnost od radiačního poškození, ale
za hranici, nad níž je riziko stochastických účinků
z ozáření již nepřijatelné. Některé konkrétní
hodnoty radiačních limitů jsou uvedeny níže (oddíl
"Základní způsoby ochrany před zářením,
pasáž "Limity radiačních dávek").
Tyto obecné principy radiační ochrany
mají svou specifickou formu při lékařských aplikacích
ionizujícího záření, viz §5.7 "Radiační ochrana při radiační
diagnostice a terapii".
Součástí radiační ochrany je dále i
zajištění fyzické bezpečnosti zdrojů
ionizujícího záření, které by měly být zabezpečeny tak,
aby nemohlo dojít k nekontrolovanému ozáření nebo
kontaminaci prostředí - aby zdroje byly náležitě skladovány
a evidovány, aby nedošlo ke ztrátě či odcizení zdroje, aby
zářiče byly svěřovány jen osobám a organizacím, které
jsou pro příslušné činnosti vyškoleny a mají povolení.
Základní
způsoby ochrany před zářením
Úkolem radiační ochrany je snížení absorbované
dávky ionizujícího záření v organismu na co
nejnižší míru (rozumě dosažitelnou -
"ALARA") a tím podstatné omezení
rizika nežádoucích deterministických či
stochastických účinků záření. Obdržená dávka záření je určena
několika základními faktory: intenzitou, druhem a energií emitovaného
záření s nímž pracujeme, dobou expozice a
geometrickými podmínkami (vzdálenost, stínění). Jsou tedy tři základní způsoby ochrany před
vnějším ionizujícím zářením (+ čtvrtý způsob při
práci s otevřenými zářiči) :
- 1. Č a s
Absorbovaná dávka
záření je
přímo úměrná době
expozice, po kterou se nacházíme v poli
záření. Zkrácením doby
pobytu v exponovaném místě můžeme
tedy úměrně snížit obdrženou dávku záření.
Takže se zbytečně dlouho nezdržujeme v prostoru
s ionizujícím zářením a práce s radioaktivními
látkami je třeba promyšleně připravit a provádět
je pokud možno rychle.
- 2. Vzdálenost
Intenzita
záření a tím i dávkový příkon jsou nepřímo
úměrné druhé mocnině vzdálenosti od zdroje
záření (přesně platí pro bodový zdroj). Je proto
třeba se zdržovat co
nejdále od zdrojů záření (tedy i od
pacientů s aplikovanou aktivitou), při práci se
zářiči je užitečné držet je co nejdále od těla a
příp. používat vhodné manipulátory, pinzety a pod.
- 3. Stínění
Velmi efektivní ochranou je odstínění záření
vhodným absorbujícím materiálem. Jak bylo z fyzikálního hlediska ukázáno v
§1.6 "Ionizující záření", část "Absorbce záření v látkách", interakce záření s látkovým
prostředím vede k absorbci určitého množství
záření (někdy i veškerého záření) a tím k zeslabení
toku záření. Postavíme-li tedy záření do cesty
vhodný stínící materiál, můžeme
dosáhnout podstatného snížení intenzity záření,
někdy dokonce úplného odstínění záření.
Stínění by mělo být co nejblíže zdroji
záření, popř. ho obklopovat (např. lahvička s radioaktivní látkou se
umístí do olověného kontejneru).
Pro jednotlivé druhy záření se stínění provádí
následujícími způsoby:
Stínění záření gama a
X
Pro
záření gama a X jsou
nejvhodnějšími stínícími materiály
látky s velkou
měrnou hmotností (hustotou) – především olovo, ze stavebních materiálů pak
beton s příp. příměsí barytu a pod. Používají
se olověné (ojediněle i wolframové) kontejnery pro
přepravu a skladování zářičů, zástěny
z olověného plechu, tvarované olověné cihly atd. Pro účinné odstínění záření gama o
energii cca 100keV stačí vrstva olova tloušťky 2mm;
čím vyšší je energie fotonů záření gama, tím
silnější vrstvu stínění je nutno použít. Pokud je potřeba zachovat optickou
viditelnost, používá se olovnaté
sklo s vysokým obsahem kysličníku olova v
tavenině.
Tloušťka potřebného stínění závisí
na hustotě (a nukleonovém čísle) stínícího
materiálu, na energii záření g a na požadovaném zeslabení.
V tabulkách se někdy uvádí hodnoty tzv. polovrstvy absorbce, což je taková
tloušťka vrstvy stínícího materiálu, která
sníží intenzitu daného záření na polovinu (2
polovrstvy pak na 1/4, 3 polovrstvy na 1/8 atd. – stínící
účinek roste exponenciálně s tloušťkou stínění
podle shora uvedeného vzorce v §1.6). Polotloušťky
absorbce pro různé energie a materiály jsou uvevedeny
v tabulce v pasáži "Absorbce záření v látkách" §1.6.
Stínění záření beta
K odstínění záření b- stačí lehké materiály (jako je plexisklo)
tloušťky cca 5-10mm, nejlépe v kombinaci s následnou
tenkou vrstvou olova k odstínění
brzdného elektromagnetického záření vzniklého zabrzděním elektronů b v lehkém
stínícím materiálu. Olovo
samotné není vhodným stínícím materiálem pro
záření b, neboť v něm vzniká tvrdé a intenzívní
brzdné záření, k jehož odstínění by bylo nutno
použít zbytečně silnou vrstvu olova.
Pro odstínění pozitronového záření b+ je kromě vrstvy lehkého materiálu potřeba
použít poměrně silné vrstvy olova (nejméně cca 3
cm), abychom odstínili tvrdé záření gama o energii
511keV, vznikající při anihilaci pozitronů b+ s elektrony e-.
Stínění záření alfa
Záření a, vzhledem k jeho malé pronikavosti,
lze odstínit velmi snadno. Stačí tenká vrstva
(milimetrová) lehkého materiálu, třebas plastu.
Často není proti záření alfa potřeba stínit
vůbec, protože i ve vzduchu je dolet částic a jen
několik centimetrů, při vyšších energiích max.
desítky centimetrů. Pokud je zářič smíšený a+g,
stínění proti gama automaticky dokomale odstíní i
záření alfa.
Stínění neutronového
záření
Stínění proti neutronům je obecně složitějším
problémem než proti záření beta či gama. Jedná-li
se o rychlé neutrony, je třeba je
nejprve zpomalit, aby mohly být
účinně pohlceny vhodným absorbátorem.
Neutrony se nejúčinněji zpomalují průchodem látkami
bohatými na vodík, kde ztrácejí energii při
pružném rozptylu na jádrech vodíku (protonech). K asi
10-násobnému zmenšení počtu rychlých neutronů je
zapotřebí vrstva cca 20cm parafinu či plastu. Pro
absorbci takto zpomalených neutronů se pak využívá
jejich záchyt vhodnými jádry atomů.
Nejúčinnější absorbce probíhá v kadmiu, bóru, či
indiu. Absorbce neutronů v jádrech kadmia nebo boru je
doprovázena emisí záření gama
(jedná se o reakce (n, g) radiačního
záchytu neutronu), které je potřeba rovněž
odstínit, a to těžkým materiálem - olovem.
Stínění proti neutronům tedy obecně musí sestávat
ze tří vrstev: vrstva lehkého
materiálu bohatého na vodík (např. polyetylén),
vrstva kadmia nebo bóru, a nakonec vrstva olova.
Pozn.: Při stínění
neutronů je třeba pamatovat i na to, že při záchytu
neutronů v některých jádrech dochází ke vzniku radionuklidů,
kdy se z původně neaktivních materiálů mohou stát
zářiče b a g. Tyto radionuklidy pak "vnitřně" kontaminují
stínění a konstrukční materiály. Např. pokud je
neutronům vystavena ocel legovaná kobaltem 59Co, vzniká
záchytem neutronů známý radionuklid 60Co s
poločasem rozpadu přes 5 let!
- 4. Zabránění
kontaminace
Pracujeme-li s otevřenými
radionuklidy (ve formě roztoků,
prášků, aerosolů či plynů), přistupuje
k riziku
vnějšího ozáření dále nebezpečí
kontaminace radioaktivními látkami (§5.5, část "Radioaktivní
kontaminace") – může dojít jednak k povrchové kontaminaci těla, jednak k vnitřní
kontaminaci. Vnitřní kontaminace je
nejnebezpečnější, protože při ní je organismus
zářením zatěžován dlouhodobě a
"zevnitř" - radionuklid vstoupí do
metabolismu a podle své chemické povahy se může
hromadit v určitých "cílových"
orgánech, které jsou pak bezprostředně
vystaveny účinkům záření
(předchozí tři způsoby ochrany jsou zde pak již
bezpředmětné!). K vnitřní kontaminaci může
docházet zažívacím ústrojím, dýchacím ústrojím
nebo průnikem přes pokožku. Pro zabránění
kontaminace je tedy nutno dodržovat obecná pravidla hygieny, v kontrolovaném
pásmu nejíst, používat ochranné rukavice,
s těkavými radioaktivními látkami pracovat
v digestoři atd.
O problematice vnitřní
kontaminace bude podrobněji pojednáno v §5.5, pasáž
"Vnitřní kontaminace".
| Neopodstatněnost
radiofobie při práci se zářením : |
| Při erudované práci se
znalostí věci a dodržování zásad radiační
ochrany lze dosáhnout toho, že práce s
ionizujícím zářením není o nic
nebezpečnější a škodlivější než práce
s jakýmikoli jinými materiály, stroji a zařízeními. |
K praktické realizaci uvedených zásad
radiační ochrany může výrazně napomáhat používání ochranných
pomůcek při jednotlivých pracovních úkonech s
ionizujícím zářením. Jsou to jednak pomůcky
stínící - olověná pouzdra, kryty, nádobky či
kontejnery na zářiče, stínící stěny, zástěry, brýle a
pod. Dále pomůcky manipulační - pinzety,
pipety, dálkové manipulátory, dopravníky a pod. Při práci s
otevřenými zářiči jsou to pak pomůcky proti
kontaminaci - gumové rukavice, pláště, roušky,
neprodyšná obuv a další.
Limity radiačních
dávek
Jakákoliv dávka ionizujícího záření může být spojena
s určitým rizikem škodlivých účinků (aspoň
podle lineární bezprahové hypotézy...), takže je třeba dbát aby dávky byly
co nejnižší. Pro účely hodnocení a usměrňování expozice
záření byly stanoveny určité hraniční hodnoty dávek *) za
rok a za 5 let – tzv. limity (nejvyšší přípustné
dávky) pro pracovníky se zdroji ionizujícího záření,
které jsou stále ještě spojeny s velmi malou
pravděpodobností poškození zářením. Nynější hodnota ročního
limitu pro pracovníky byla stanovena 50 mSv, pětiletý limit 100 mSv
(5 po sobě jdoucích let). Základní
limity pro ostatní obyvatelstvo jsou stanoveny ve výši 1
mSv/rok.
*) Jedná se zde o přídavné
dávky k dávkám z přírodních zdrojů. Spontánní radiační
dávky z přírodních zdrojů se do limitů pro obyvatele ani
pro profesní ozáření radiačních pracovníků nezapočítávají
(započítávají se však v případech
cílených a profesních činností spojených se zvýšenou
expozicí z přírodních zdrojů - jako je práce v uranových
dolech nebo ve výškových letadlech).
...........
5.4.
Radiační monitorování a osobní dozimetrie
Radiační monitorování
je cílené měření veličin
charakterizujících záření za účelem zajištění
optimální úrovně ochrany osob a pracovního či životního
prostředí před škodlivými účinky ionizujícího záření.
Monitorování se provádí na pracovištích s ionizujícím
zářením a příp. i v okolí významnějších zdrojů
ionizujícího záření. Základními veličinami, měřenými
při radiačním monitorování, je radiační dávka
a dávkový příkon. Jejich přímé měření se provádí
pomocí tzv. dozimetrů, což jsou speciálně
upravené radiometry, cejchované v jednotkách dávky (Gray,
Sievert). Vedle toho se používají metody odvozeného
stanovení dávek na základě jiných veličin, např.
aktivity radionuklidů.
Referenční úrovně
Pro hodnocení výsledků měření při monitorování se
stanovují učité význačné hodnoty, jejichž dosažení
signalizuje určitou anomální radiační situaci a je příp.
pokynem pro zahájení příslušných opatření radiační
ochrany. Zavádějí se tři druhy referenčních úrovní:
- Záznamová
úroveň
Tato úroveň stanovuje nejnižší
hodnotu monitorované veličiny, od které má význam ji
hodnotit a zaznamenávat v dokumentaci. Jako záznamová
úroveň se většinou bere nejmenší detekovatelné
hodnota měřené veličiny, či hodnota pozadí. Tato
hodnota je závislá na druhu měřené veličiny,
konkrétních podmínkách měření a vlastnostech
měřících přístrojů používaných k
monitorování.
- Vyšetřovací
úroveň
Dosažení vyšetřovací úrovně je již příznakem ne
zcela běžné radiační situace na pracovišti a mělo
by být podnětem k šetření jeho
příčin a důsledků. Vyšetřovací úroveň se
zpravidla stanovuje jako horní mez obvykle se
vyskytujících hodnot, u osobních radiačních dávek
pak příp. jako 0,3-násobek příslušného limitu pro
radiační pracovníky.
- Zásahová
úroveň
Dosažení této úrovně již signalizuje mimořádnou
událost či radiační nehodu, spojenou se
zvýšeným radiačním rizikem, a je podnětem k
neprodlenému varování a podniknutím kroků k ochraně
osob a prostředí podle havarijního řádu
pracoviště.
Radiační monitorování se zpravidla skládá
ze tří částí: monitorování osob, monitorování
pracoviště, monitorování radioaktivních odpadů a příp.
monitorování okolí pracoviště s ionizujícím zářením.
Monitorování
osob - osobní dozimetrie
Osobní monitorování spočívá v měření osobních
dávek záření jednotlivých radiačních
pracovníků, ať již se jedná o zevní ozáření,
nebo příp. o vnitřní ozáření z
radioaktivní kontaminace. Monitorování zevního ozáření se
provádí pomocí osobních dozimetrů, které
radiační pracovníci nosí během všech prací s ionizujícím
záření a pobytu v kontrolovaném pásmu. Tyto dozimetry jsou
ve stanovených časových intervalech (zpravidla 1 měsíc)
centrálně vyhodnocovány, výsledkem jsou hodnoty dávek (v
mSv).
Pozn.: Je třeba
si uvědomit, že přímé měření absorbované dávky je velmi
obtížné, mimo laboratorní metody obecně dozimetrické
veličiny nejsou přímo měřitelné. Dávky se
stanovují nepřímo a přibližně, na základě určitých
modelových předpokladů. Z údajů na dozimetrech se odvozuje
povrchová dávka a dávka v určité hloubce.
Jsou používány následující druhy osobních dozimetrů:
- Osobní filmové
dozimetry
Filmové dozimetry jsou založeny na fotochemických
účincích ionizujícího záření (viz §2.2 "Fotografická
detekce ionizujícího záření"). Základem
filmového dozimetru je políčko fotografického
filmu, světlotěsně zabalené do černého
papíru (od běžného fotografického filmu se liší
tím, že má tlustší emulzi s vyšším obsahem
bromidu stříbra). Ionizující záření prochází
obalem filmu a ve fotoemulzi vytváří latentní obraz,
který se vyvoláním zviditelní. Optická hustota
zšednutí či zčernání filmu, kterou lze vyhodnocovat
fotometricky, je pak mírou integrálního
množství záření, které filmem prošlo
během expozice; indikuje tím i dávku
záření, která by byla absorbována v tkáni
vystavené této expozici.
Vlastní políčko filmu se vkládá do plastového
pouzdra (obr.5.4.1nahoře), opatřeného
několika malými obdélníčky měděných a olověných
plíšků o různých tloušťkách, které slouží jako
filtry pohlcující záření g v
závislosti na jeho energii. Tyto filtry slouží jednak
ke korekci závislosti zčernání na energii záření,
jednak porovnáním zčernání pod nestíněnou plochou
a pod jednotlivými filtry lze odhadnout druh a zhruba i
energii záření (samotný film
samozřejmě nemá spektrometrické vlastnosti). Filmový dozimetr nosí pracovníci na
referenčním místě (levá
kapsička na košili) a pravidelně
(1-krát za měsíc) je vyměňován, vyvoláván a fotometricky
vyhodnocován; s použitím vhodného
kalibračního faktoru je výslednou měřenou hodnotou efektivní
dávka v mSv.
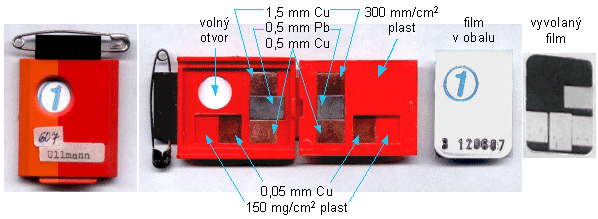
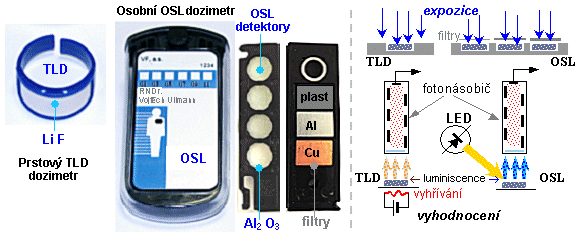
Obr.5.4.1. Nahoře: Filmový
osobní dozimetr. Dole:
Termoluminiscenční (TLD) a opticko-luminiscenční
(OSL) dozimetr.
- Termoluminiscenční
dozimetry, OSL dozimetry (obr.5.4.1
dole)- jsou popsané v §2.2 "Fotografická
detekce ionizujícího záření", pasáž "Termoluminiscenční
a fotoluminiscenční (OSL) dozimetrie".
- Osobní neutronové
dozimetry
- Elektronické
dozimetry s přímým
odečtem
Určitou nevýhodou výše uvedených integrálních
osobních dozimetrů je časová retardace
- obdrženou dávku zjistíme až po centrálním
vyhodnocení osobního dozimetru, většinou po několika
týdnech. Pro okamžité a průběžné měření osobní
radiační dávky slouží elektronické
dozimetry *) - viz §2.1 "Metodika detekce
ionizujícího záření",
obr.2.1.1. Tyto přístroje obsahují vhodný
elektronický detektor záření (většinou G.-M.
trubici, pro vyšší dávky příp. ionizační
komůrku) a vyhodnocovací elektroniku s číselným
displejem pro okamžitý odečet. Umožňují měřit jak
okamžitý dávkový příkon, tak sumární dávku. Lze
též zpravidla nastavit určitou signální
úroveň dávkového příkonu či dávky, při
jejímž překročení se spustí akustická
indikace. Díky miniaturním rozměrům
je lze nosit podobně jako ostatní osobní dozimetry.
*) Tyto dozimetry nahradily dříve
používané tužkové dozimetry s
ionizační komůrkou a elektrometrem, jehož vláknová
ručička umožňovala okamžitý odečet dávky.
Radiační monitorování
pracovního a životního prostředí
Pro zajištění optimální úrovně radiační ochrany a
radiační prevence je důležité sledování intenzity
ionizujícího záření a příp. přítomnost radioaktivní
kontaminace v prostorách pracovišť, jejich okolí i v
životním prostředí obyvatel - tzv. radiační
monitorování.
..........................
Měření dávky a dávkového příkonu v laboratořích,
vyšetřovnách a na lůžkových odděleních. Systém monitorovacího
programu pracovišť........................
5.5.
Otevřené radionuklidy. Vnější a vnitřní kontaminace
Uzavřené
a otevřené zářiče
Z hlediska materiálové povahy a technického provedení se
zdroje ionizujícího záření dělí na dvě skupiny:
- Uzavřený zářič
je takový radioaktivní zářič, jehož konstrukce
zabezpečuje (zkouškami ověřenou a osvědčením
doloženou *) těsnost a vylučuje únik
radioaktivních látek do okolí za předvídaných
podmínek použití a opotřebení. Uzavřenými zářiči
jsou např. různé etalony pro kalibraci
měřících přístrojů, radioisotopové ozařovače v
radioterapii, zdroje záření v průmyslu (např. v
defektoskopii).
*) Skutečnou uzavřenost
radioaktivního zářiče je třeba pravidelně
ověřovat otěrovými zkouškami,
popř. testováním dlouhodobé stálosti radioaktivity
(příp. rozdílnosti od korekce na rozpad).
Do kategorie uzavřených
zářičů lze v jistém smyslu "automaticky"
zařadit i elektronické zdroje záření - rtg
přístroje či urychlovače, kde žádné radioaktivní
látky nejsou.
Pozn.: U
urychlovačů vyšších energií však může být
situace složitější, protože takovéto
"uzavřené zdroje" mohou jadernými reakcemi aktivovat
původně neradioaktivní látky (§1.3
"Jaderné reakce") a vytvářet tak
otevřené zářiče.
Radiační ochrana při používání uzavřených
zářičů spočívá v ochraně před vnějším zářením.
- Otevřený zářič
nesplňuje tyto podmínky pro uzavřený zářič –
jsou to zejména radioaktivní
roztoky, plyny, aerosoly, prášky a
pod., které se dají dělit, porcovat či jinak
upravovat. V nukleární medicíně jsou otevřenými
zářiči všechny radioaktivní
preparáty pro in vivo a in vitro
vyšetření, jakož i pro radioisotopovou terapii.
Ve srovnání s
uzavřenými zářiči je u otevřených zářičů
radiační ochrana náročnější - může zde docházet
jak k přímému vnějšímu
ozáření ionizujícím zářením (stejně
jako u zářičů uzavřených), tak k následnému
ozáření v důsledku radioaktivní
kontaminace, vnější či vnitřní. Při vnitřní kontaminaci, kdy radionuklid vnikne
do vnitřního prostředí organismu, dochází k
přímému ozařování tkání a orgánů, z
bezprostřední blízkosti, často na buněčné úrovni.
Některé
radioaktivní látky jsou při metabolismu z těla rychle
vylučovány, jiné se v organismu na dlouhou dobu
vážou na cílové tkáně a orgány. Po vniknutí
radionuklidu do organismu se před (vnitřním)
ozářením nelze chránit shora
uvednými klasickými způsoby - časem, vzdáleností a
stíněním. Omezeně lze použít látky, které
zrychlují metabolismus a vylučování dané
radioaktivní látky (radionuklidu v příslušné
chemické formě) z těla. Problematika vnitřní
kontaminace je rozebírána níže v části "Vnitřní
kontaminace").
Pro klasifikaci zářičů podle aktivity
ve vztahu k radiohygienickým rizikům se zavádí tzv. zprošťovací
úroveň aktivity: je to taková hodnota celkové
aktivity (nebo měrné hmotnostní aktivity), při jejímž
nepřekročení se radiační rizika a radioaktivní kontaminace
považuje za zanedbatelnou (ve srovnání s přírodními zdroji
záření). Takový zářič nepodléhá předpisům radiační
ochrany a mohli bychom jej mít bez rizika, s trochou nadsázky,
třebas doma v obývacím pokoji...
Podle závažnosti radiačního rizika se
zdroje ionizujícího záření dělí na 5 kategorií:
Nevýznamné zdroje
(např. drobné uzavřené etalony pro spektrometrickou
kalibraci, ionizační hlásiče požáru, radioaktivní látky s
aktivitou nižší než je zprošťovací úroveň a pod.);
Drobné zdroje
(jako jsou silnější uzavřené zářiče a nízké aktivity
otevřené);
Jednoduché zdroje
(např. zařízení pro rentgenovou diagnostiku a
defektoskopická zařízení);
Významné zdroje
(např. uzavřené zářiče pro radioterapii, urychlovače,
vysoce aktivní otevřené zářiče); a nakonec
Velmi významné zdroje
(jako jsou jaderné reaktory nebo zařízení pro výrobu
radionuklidů).
Laboratorní práce s
otevřenými radionuklidy a jejich skladování, radioaktivní
odpady, aplikace radionuklidů pacientům.
Radiační hygiena při použití otevřených zářičů
- ochrana pracovníků před vnějším zářením
a vnitřní kontaminací.
Radioaktivní
kontaminace
Při manipulaci
s otevřenými radioaktivními látkami může dojít k jejich
úniku a následné kontaminaci (zamoření) předmětů,
pracovního prostředí a osob těmito radioaktivními látkami.
Kontaminace může být povrchová vnější a vnitřní.
Povrchová kontaminace
Nejčastěji dochází k povrchové
kontaminaci
pracovních ploch, pomůcek, oděvů nebo osob. Povrchová
kontaminace může vést k vyšším
dávkám záření především na kontaminované oblasti
kůže, v některých případech však může vyústit i ve
vnitřní kontaminaci, viz níže.
K průběžné kontrole povrchové kontaminace během práce a
po jejím skončení se používají především radiometry s velkoplošnými sondami, které by se
měly nacházet na všech exponovaných pracovištích a
v hygienických smyčkách.
Citlivou metodou kontroly kontaminace je i metoda stěrů, kdy štětičkou z vaty
namočenou ve vhodném rozpouštědle (lihobenzin) setřeme
příp. kontaminaci z definované plochy exponovaného místa a
pak ji ve zkumavce přeměříme studnovým scintilačním
detektorem.
Dekontaminace
Při kontaminaci
pracovního prostředí je nutno zamezit
šíření kontaminace, označit viditelně kontaminovanou
plochu, nahlásit tuto příhodu vedoucímu nebo
dohlížejícímu pracovníkovi a pod jeho vedením spolupracovat
při dekontaminaci. Při dekontaminaci je třeba
nejprve filtračním papírem nebo buničinou odsát co největší část aktivní tekutiny a dále
kontaminovanou plochu omývat a otírat
vhodným
čistícím či dekontaminačním prostředkem. Vzniklé odpady je nutno ukládat do igelitových
sáčků a kontaminované předměty odmořit nebo je uložit
v igelitových sáčcích k vyzáření. Kontaminovanou
vodu je nutno
vylévat do odpadu napojeného na vymírací jímky. Účinnost
dekontaminace se průběžně kontroluje přeměřováním
radiometrem. Nepodaří-li se zcela odstranit aktivitu, je třeba
dané místo označit a přikrýt ochranným papírem či
fólií; o dalším postupu a opětném obnovení provozu pak
rozhodne vedoucí či dohlížející
pracovník.
Při kontaminaci
osob musí
pracovník svléci kontaminované části oděvu nebo ochranných
pomůcek, prověřit kontaminaci povrchu těla a podle potřeby
provést očistu omýváním nebo
osprchováním.
Dále je nutno prověřit, zda nedošlo k vnitřní
kontaminaci
pracovníka. Při podezření na vnitřní kontaminaci a
překročení nejvyšší přípustné dávky záření je třeba
učinit potřebná zdravotnická
opatření
ve spolupráci s SÚJB a s hygienickými orgány, včetně dočasného
vyřazení pracovníka z prostředí s ionizujícím
zářením.
Rozsáhlejší radioaktivní
kontaminace je již radiační havárií - viz
následující §5.6.
Vnitřní kontaminace
Při manipulaci s vyššími aktivitami otevřených zářičů
může dojít k nežádoucímu průniku radioaktivních látek
dovnitř do organismu - k vnitřní kontaminaci a
následnému vnitřnímu ozáření.
Pozn.: Speciálním případem
"vnitřní kontaminace" je záměrná aplikace
radioaktivní látky - radioindikátoru, radiofarmaka
- do organismu za účelem diagnostiky nebo terapie
v nukleární medicíně ("Scintigrafie",
"Radioisotopová terapie").
Po proniknutí do organismu
radioaktivní látka vstoupí do metabolismu a může se distribuovat
v jednotlivých tkáních a orgánech v závislosti na svém
chemickém složení - část se hromadí v tzv. cílových
orgánech, zbytek se rozdělí v celém těle. Většina
radioaktivity je posléze metabolizována a po
určité době odchází ven z organismu (většinou močí, v menší míře stolicí, někdy i
potem či vydechovaným vzduchem). Část
radioaktivity však může zůstat trvale vázána
(např. jód ve štítné žláze, stroncium či plutonium v
kostech, cesium ve svalech,...) - dochází k její retenci
(lat. retineo, retentum = zadržet). Vzhledem k nehomogenní distruci
radioaktivních látek v cílových tkáních a orgánech může
být vnitřní ozáření organismu značně heterogenní
(viz níže "Stanovení
radiační dávky z vnitřní kontaminace. Metoda MIRD.").
Radioaktivní kontaminace se do organismu může
dostat v zásadě čtyřmi způsoby:
- Ingesce
Nejčastější příčinou vnitřní kontaminace,
zvláště při laboratoratorní práci, je požití
(ingesce) radioaktivní látky přes kontaminované ruce
či jiné předměty, které přicházejí do styku s
ústy.
- Inhalace
Při práci s radioaktivními plyny, parami či aerosoly
může radioaktivita proniknout při vdechování
(inhalaci) do plic, a odtud příp. stěnami alveol do
krve a dále do organismu.
- Přes kůži
Při kontaminaci povrchu těla jsou některé látky
schopné difundovat a proniknout do organismu i neporušenou
kůží (např. plutonium či fosfor), popř.
otevřeným poraněním na kůži.
- Cílená aplikace radiofarmaka,
většinou intravenózní nebo perorální - pro
diagnostiku nebo terapii v nukleární medicíně ("Scintigrafie", "Radioisotopová terapie").
Při proniknutí radioaktivní látky do
organismu požitím nebo vdechnutím přechází tato látka
poměrně rychle ze zažívacího ústrojí či plic do krve a
lymfy. Její další chování - distribuce, metabolismus,
setrvání či vyloučení z organismu - je dáno chemickými
vlastnostmi látky a rychlostí radioaktivní přeměny
radionuklidu.
Monitorování
vnitřní kontaminace
Zjišťování vnitřní kontaminace g-radionuklidy lze provést zevním měřením záření
gama pomocí citlivého scintilačního detektoru nad kritickými
(cílovými) orgány. Např. u 131I je to štítná žláza, takže
na pracovištích provádějících terapii štítné žlázy radiojodem
je třeba periodicky měřit aktivitu štítné žlázy u všech
pracovníků podílejících se na těchto terapiích. Speciální metodou měření vnitřní kontaminace je
použití celotělových detektorů záření,
osazených scintilačními nebo polovodičovými detektory,
které jsou instalovány na některých pracovištích s
vysokými radioaktivitami (jaderné reaktory, výroba
radionuklidů) a riziky vnitřní kontaminace - pracoviště
IV.kategorie. Tyto metody zevního monitorování
se uplatňují především u vnitřní kontaminace radionuklidy
emitujícími záření g, které proniká tkání ven z těla. U čistých
zářičů b lze zevní monitorování použít jen tehdy, pokud v
důsledku vysoké energie elektrony b vytvářejí v tkáni
tvrdší brzdné záření (např. 32P nebo 90Sr-90Y), které pronikne tkání z těla ven. U zářičů s
nízkou energií b má brzdné záření nízkou intenzitu a energii, z
těla ven nepronikne a zevní detekci nelze použít.
Další metodou monitorování vnitřní kontaminace je
měření aktivity vzorků krve a moči.
Stanovení
radiační dávky z vnitřní kontaminace. Metoda MIRD.
Při vnějším ozáření organismu dochází k
předávání energie záření tkáním a orgánům pouze po
dobu, kdy je tělo záření vystaveno. Pokud se radionuklid
dostane dovnitř organismu, zůstává tam deponován a
dlouhodobě jej ozařuje. Ozáření je heterogenní a mění se
s časem od okamžiku příjmu, jak se radionuklid v těle
pohybuje a distribuuje, je z něj vylučován a jak ubývá jeho
množství radioaktivní přeměnou. Je obecně složitou funkcí
času a prostoru.
Přesné stanovení radiačních dávek v
jednotlivých tkáních a orgánech při vnitřní radioaktivní
kontaminaci je proto obecně úkol velmi složitý a nesnadný.
Absorbovaná dávka závisí nejen na fyzikálních
charakteristikách radionuklidu (druhy a energie
emitovaného záření, poločas rozpadu), ale i na jeho chemické
formě (a to velmi podstatně!), normální či
patologické farmakokinetice - rychlosti
hromadění a vylučování látky v orgánech, na anatomických
faktorech (velikostech, rozmístění a hustotách
orgánů a tkání).
Podrobnější rozbor distribuce dávek ve
tkáních a orgánech bude uveden níže. Z hlediska rizika
stochastických účinků se pro přibližné a globální
posouzení radiační zátěže z vnitřní kontaminace
používá tzv. konverzní faktor radiační
kontaminace h [Sv/Bq]: je to koeficient, udávající efektivní
dávku v těle (resp. úvazek efektivní dávky),
způsobenou přijetím jednotkové aktivity 1Bq
(většinou se však používá 1MBq) dané radioaktivní látky
do organismu. Hodnoty konverzního faktoru závisejí nejen na
druhu radionuklidu, ale i na tom, v jaké sloučenině se
radionuklid nachází a na způsobu, jakým radionuklid do
organismu vnikl; nejčastěji se udávají hodnoty pro požití
(ingesci) hing a pro vdechnutí (inhalaci) hinh. Konverzní faktory
se udávají pro tzv. "referenčního člověka"
s anatomickými a fyziologickými charakteristikami typickými
pro průměrnou populaci, např. hmotnost 70kg. Přesnější
hodnoty dávek z vnitřní kontaminace se stanovují na základě
následujících modelů metody MIRD:
Radiační dávka D [Gy] v
orgánu, v němž je obsažena radioaktivní látka
(předpokládá se pro jednoduchost rovnoměrné rozložení), je
dána součinem dvou veličin
D
= S . AS :
¨
Kumulovaná aktivita AS
udává celkový počet radioaktivních přeměn, k nimž dojde v
uvažovaném orgánu za celou dobu přítomnosti radionuklidu.
Hodnotu kumulované aktivity AS stanovíme jako integrál či plochu pod křivkou
časové závislosti aktivity A v orgánu od času t=0
vstupu radionuklidu do jeho úplného vymizení (teoreticky do Ą): AS = 0ňĄA(t) dt
(prostřední část obr.5.5.1).
Vylučování (exkrece) dané
radioaktivní látky z orgánu (popř. celého těla) má
přibližně exponenciální časovou závislost
a jeho rychlost se charakterizuje tzv. efektivním
poločasem T1/2ef. Tento efektivní poločas je dán kombinací
fyzikálního poločasu rozpadu T1/2fyz
daného radionuklidu a tzv. biologického poločasu
T1/2biol, tj. doby potřebné k vyloučení poloviny
vstřebaného množství dané látky metabolismem. Efektivní
poločas potom je T1/2ef = T1/2biol.T1/2fyz/(T1/2biol+T1/2fyz). Pro kinetiku radionuklidů v tkáních a orgánech
bývá zpravidla dominantní biologický poločas exrece, který
je většinou podstatně kratší než poločas rozpadu
vlastního radionuklidu.
¨
Dávková konstanta S
představuje dávku vztaženou na jednotkovou aktivitu daného
radionuklidu v orgánu [Gy/Bq] (v praxi
[mGy/MBq]). Konstanta S v sobě
zahrnuje vliv všech druhů záření emitovaného daným
radionuklidem - částice b a a, záření g, charakteristické a brzdné X-záření, konvezní a
Augerovy elektrony.
Částice alfa a beta (jakož i konverzní a Augerovy
elektrony) se ve zdrojovém orgánu zcela absorbují a
přispívají jen k dávce v tomto orgánu, která pro tento
případ činí D = <Ea,b>. AS/m, kde <Ea,b> je střední energie [J] emitovaných částic a nebo b, AS kumulovaná
aktivita, m hmotnost daného orgánu či tkáně
(dávková konstanta je tedy v tomto případě S = <Ea,b>/m).
Základní vztah pro radiační dávku z homogenní distribuce
radioaktivity v látce byl odvozen výše v §5.1, pasáž "Radiační
dávka z radioaktivity".
Pronikavé záření gama a X může prozařovat i
do okolních tkání a orgánů (obr.5.5.1 vlevo). Jeho
příspěvek ke konstantě S závisí na energii
záření, vzdálenostech, velikosti a tvaru zdrojových a
terčových orgánů, částečně i na druhu tkáně mezi nimi.
Hodnoty dávkové konstanty pro
jednotlivé orgány a radionuklidy se stanovují pomocí
mikrodozimetrických metod zahrnujících modelování a simulaci
za pomoci fantomů; ve zjednodušené verzi se uvádějí v
tabulkách radiační ochrany (jedná se o průměrné hodnoty
vztažené na člověka hmotnosti 70kg).

Obr.5.5.1. Radiační dávky z distribuce radioaktivity uvnitř
organismu. Vlevo: Zdrojové a terčové orgány
v organismu. Uprostřed: Časová závislost
aktivity ve zdrojových orgánech. Vpravo:
Časová závislost pro stanovení dávek D metodou MIRD.
<E> je
střední energie [J] deponovaná v tkáni hmotnosti m na
jeden rozpad použitého radionuklidu (uvažují
se elektrony beta nebo částice alfa).
Pokud se tato střední energie uvádí v jaderných jednotkách
[eV], figuruje zde ještě přepočítávací faktor 10-19.
Obrázek zhruba simuluje situaci po
vniknutí radiojódu 131I do organismu. Radiojód se rychle vychytá ve
štítné žláze, pak se metabolizuje a vylučuje ledvinami do
močového měchýře, odkud periodicky při močení odchází z
organismu.
Tkáň či orgán, v němž potřebujeme
stanovit radiační dávku, se označuje jako terčový,
ostatní orgány a tkáně v těle jsou pro něj považovány za zdrojové
- levá část obr.5.5.1. Radiační dávka DT v terčovém orgánu T
se rovná součtu dávky z "vlastní"
kumulované aktivity AST obsažené v tomto
orgánu a dávkových příspěvků pronikajícího
záření z aktivit ASi kumulovaných v
okolních zdrojových orgánech:
DT = ST . ATS + i=1SN (Si.ASi ) ,
kde Si
jsou dávkové konstanty pro ozařování terčového orgánu z
aktivity ASi obsažené v
okolních orgánech "i" (které jsou zdrojovými pro
terčový orgán T; obecně lze každý orgán považovat
jak za terčový, tak zdrojový pro ostatní orgány). Konstanty
Si
zahrnují mimo jiné i absorbci záření v tkáních a úbytek
intenzity záření se vzdáleností. V prvním přiblížení
platí úměrnost Si ~ e-m.d/d2, kde m(Eg,r) je lineární součinitel zeslabení tkání hustoty r pro záření o
energii Eg, d je vzdálenost zdrojového orgánu od orgánu
terčového. Přesný výpočet by však měl zahrnovat integraci
přes celý prostor mezi zdrojovým a terčovým orgánem, jakož
i přes vlastní objem obou orgánů.
Komplexní metoda, zahrnující výše uvedené
fyzikální a biologické faktory pro stanovení radiačních
dávek v jednotlivých orgánech z vnitřní distribuce
radioaktivních látek, se označuje zkratkou MIRD
(Medical Internal Radiation
Dose). Základní metoda MIRD využívá
některé paušální údaje o anatomických poměrech v tzv.
"standardním člověku" hmotnosti 70kg. Upřesnění
těchto údajů lze dosáhnout použitím volummetrie na denzitních
obrazech rentgenové CT - tzv. voxelová metoda.
A upřesnění konkrétních údajů o distribuci a
farmakokinetice dané radioaktivní látky lze v principu získat
pomocí kvantitativní scintigrafie. Takto
zdokonalená, zatím nejkomplexnější a nejpřesnější metoda
stanovení radiačních dávek v orgánech a tkáních v 3D
radiofarmaceutické dozimetrii, má význam při plánování a
monitorování průběhu radionuklidové terapie v nukleární
medicíně - podrobnější rozbor je uveden v části "Radioisotopová terapie" kap.3 "Aplikace ionizujícího
záření". Je třeba upozornit, že vzhledem ke značné
variabilitě zvláště biologických faktorů, ani při
zahrnutí zmíněných komplexních metod nelze
dosáhnout vysoké přesnosti stanovení radiačních
dávek v orgánech - chyba se pohybuje kolem 30% i výše.
V praxi je pro výslednou radiační dávku v
terčovém orgánu dominantní dávka z vlastní
kumulované radioaktivity v orgánu, zatímco příspěvek z
ostatních vzdálenějších zdrojových orgánů je většinou
zanedbatelný. Platí to zvláště tehdy, když radioaktivní
látka je čistým zářičem b (či a), nebo podíl pronikavého g-záření není vysoký. A
tak je tomu v naprosté většině případů radiačně
významné vnitřní kontaminace, včetně aplikace radiofarmak v
nukleární medicíně.
5.6.
Radiační ochrana na pracovištích s ionizujícím zářením
Kategorie pracovišť, kontrolované
pásmo, ukládání a likvidace radioaktivních odpadů.
Uspořádání
pracovišť a jejich kategorie
Stavba,
uspořádání a vybavení pracoviště musí být provedeny tak,
aby byla zajištěna dostatečná radiační
ochrana
pracovníků, ostatních osob a životního prostředí.
V případě nehody musí být umožněna co nejrychlejší a
nejúčinnější dekontaminace osob i pracoviště. Projekty a
způsobilost pracovišť pro ionizující záření schvalují
pracovníci SÚJB.
Pracoviště se dělí podle
toho, zda jsou určena k práci s uzavřenými zářiči (jako
jsou rentgenologická nebo radioterapeutická pracoviště) nebo
se zářiči otevřenými. Podle závažnosti radiačního rizika
se pracoviště dělí do 4 kategorií, u pracovišť s otevřenými
zářiči je to podle
zpracovávaných aktivit (vyhláška č.184 SÚJB, §6, §40).
¨
Pracoviště I.kategorie
jsou pouze pro práci s nízkými aktivitami radionuklidů s malou radiotoxicitou (drobné zdroje IZ) a po
stavební stránce ani vybavením se neliší od běžných
chemických laboratoří.
¨
Pracoviště II.kategorie
zpracovávají střední aktivity otevřených radionuklidů,
mají kontrolované pásmo a jsou vybaveny ochrannými pomůckami
vč. digestoře, příp. je zde oddělená kanalizace aktivních
odpadů.
¨
Pracoviště III.kategorie
je určeno pro náročné práce se silnými uzavřenými
zářiči (urychlovače, ozařovače v radioterapii a průmyslu)
a s vysokými aktivitami otevřených radionuklidů (např.
terapie radiojódem, těžba a zpracování uranové rudy,
radiochemické provozy). Proto jsou kladeny značné požadavky
na jeho stavební úpravy i vybavení, aby v případě
kontaminace byla zajištěna co nejrychlejší a
nejúčinnější očista. V kontrolovaném pásmu by zde měly
být 3 typy místností: pro náročné práce s vysokými aktivitami
("horké" provozy), pro běžné laboratorní práce a měřicí
místnosti. Kromě toho
speciální místnosti či prostory pro skladování
radionuklidů a
radioaktivních odpadů. Podlahy a stěny laboratoří musí být
hladké a omyvatelné, podlahy dále vyspádované a opatřené
odpadem. Mělo by být též zajištěno intenzívní větrání
s filtrací aktivního vzduchu s vývodem nad střechu. Kapalné radioaktivní odpady se vedou do
vymíracích nádrží. Pracoviště musí být vybaveno
vhodným stíněním, manipulátory, digestořemi a přístroji
pro ochrannou dozimetrii. Kontrolované pásmo by zde mělo být odděleno od ostatních prostor hygienickými
smyčkami s radiometrem
pro kontrolu příp. kontaminace a s umývárnou.
¨
Do IV.kategorie
pracovišť
jsou zařazeny provozy jaderných reaktorů, výrobny radionuklidů a úložiště
radioaktivních odpadů o vysokých aktivitách a dlouhých
poločasech rozpadu. Vedle ozáření a kontaminace přímo na
pracovišti zde existuje i riziko kontaminace
životního prostředí, z
čehož plyne nutnost radiačního monitorování
okolí pracoviště.
Kontrolované
pásmo
Radiohygienicky kontrolovaným pásmem jsou nazývány ty prostory
pracoviště, kde se pracuje s ionizujícím zářením (radioaktivními
látkami nebo jinými zdroji ionizujícího záření) a kde je
třeba dodržovat režim ochrany osob před ionizujícím
zářením *). Vchody do kontrolovaného
pásma musí být označeny
varovnými znaky. Mají tam volný přístup jen poučení radiační pracovníci
vybavení ochrannými pomůckami a osobními dozimetry, jiné osoby jen v doprovodu
radiačních pracovníků a jejich pobyt se
eviduje.
*) Ve stávajících normách
radiační ochrany se specifikuje:
"Kontrolované pásmo se vymezuje všude tam, kde se
očekává, že za běžného provozu nebo za předvídatelných
odchylek od běžného provozu, by radiační dávka pracovníků
mohla překročit 3/10 limitu pro radiační pracovníky".
Na některých pracovištích, zvláště I.kategorie, se
zavádí tzv. sledované pásmo, což je prostor, kde za běžného
provozu radiačních zdrojů by radiační dávka mohla
překročit obecné limity pro obyvatelstvo.
Radiační
nehody a havárie
Při každé lidské
činnosti - v oblasti průmyslu, dopravy, zemědělství,
zdravotnictví, vědy a techniky, laboratorní práci, jakož i v
běžném životě, se občas něco "nepovede",
rozbije, pokazí - dojde k nehodě. To se samozřejmě může stát
i na pracovištích s ionizujícím zářením.
Pod radiační
nehodou
rozumíme neplánovanou událost, která zvýší ohrožení osob ionizujícím zářením. Na pracovištích s uzavřenými zářiči se jedná
především o nežádoucí ozáření osob. Na pracovištích s otevřenými
zářiči se zejména jedná o nekontrolovaný únik radioaktivní látky do pracovního prostředí
(např. rozlitím, rozstříknutím, rozbitím lahvičky
s radioaktivním roztokem a pod.) s následnou kontaminací pracovního či životního prostředí
nebo pracovníků. K takovým událostem může dojít při manipulaci
s otevřenými zářiči v procesu jejich přípravy,
transportu, skladování, aplikaci a
likvidaci.
Pro radiační nehody (zvláště drobnější) se někdy
používá i název mimořádná událost.
Rozsah radiační nehody či mimořádné události se rozlišuje
1.-3.stupněm závažnosti :
- 1.stupeň
Drobná radiační nehoda či mimořádná událost,
která má omezený a lokální dosah, k
jejímu řešení stačí běžné prostředky
obsluhujících pracovníků, nedochází k
deterministickým účinkům ozáření.
- 2.stupeň
Jedná se o závažnější ozáření
nebo kontaminaci pracoviště, které
však ještě nevyžaduje opatření k ochraně obyvatel
a životního prostředí a k jejímu zvládnutí
postačí prostředky pracoviště, příp. ve
spolupráci s dalšími odbornými pracovníky.
- 3.stupeň
Jedná se o závažnou radiační nehodu
spojenou s nebezpečným uvolněním radioaktivních
látek do životního prostředí, vyžadující
zavedení opatření k ochraně obyvatel
a životního prostředí. Nejzávažnější radiační
nehoda (3.stupně) se označuje též jako radiační
havárie. Při těžkých radiačních
haváriích může dojít i k letálnímu
ozáření osob nacházejících se v místě
nehody.
Pro hodnocení radiačních nehod u jaderných
reaktorů se též používá mezinárodní 7-stupňová
tabulka: 1.stupeň = odchylka od normálního provozu;
2.stupeň = porucha; 3.stupeň = vážná porucha; 4.stupeň =
havárie s účinky v jaderném zařízení; 5.stupeň = havárie
s účinky na okolí; 6.stupeň = havárie s vážnými
radioaktivními následky; 7.stupeň = velká havárie s
rozsáhlými radioaktivními následky.
Níže zmíníme několik
příkladů závažnějších radiačních nehod.
Jaderné
havárie a nehody s otevřenými zářiči
Jednou z typických situací, kdy může dojít k vážné
radiační nehodě s otevřenými zářiči, je neopatrná práce
se štěpným materiálem (především uran 235U nebo plutonium 239Pu), zvláště
pokud je ve vyšších koncentracích - je tzv. obohacený. Pokud
je k dispozici větší množství takového materiálu, může
dojít k překročení kritického množství a
spuštění řetězové štěpné reakce, při níž vznikne
velmi silný záblesk neutronového záření a záření
g, načež dochází k vysoké kontaminaci
štěpnými produkty. Osoby nacházející se v místě nehody
obdrží velmi vysoké dávky záření,
nezřídka letální. V laboratořích a jaderných provozech se
stalo několik nehod tohoto druhu.
V novější době se jednalo např. o havárii v závodě
na obohacování jaderných materiálů Tokai-Mura
v Japonsku 30.září 1999. Zde 3 pracovníci připravovali
jaderný materiál v roztoku oxidu uranu (obohaceného na více
než 18% 235U) a kyseliny dusičné. Nedopatřením přilili do
reakční kádě více roztoku uranu, čímž vzniklo
nadkritické množství. Modravý záblesk signalizoval
zapálení řetězové reakce. Dva pracovníci stojící
nejblíž zemřeli, třetí pracovník se léčil na akutní
nemoc ze záření.
Řada radiačních nehod vznikla u jaderných
reaktorů. Středně těžká havárie (stupeň 5)
vznikla 28.března 1979 v jaderné
elektrárně Three Mile Island na
říčním ostrově poblíž Harrisburgu v
Pennsylvánii v USA. Vlivem poruchy čerpadla sekundárního
chladicího okruhu došlo ke vzrůstu teploty a tlaku v
primárním okruhu, otevřel se přetlakový ventil a reaktor byl
nouzově zastaven. Pojistný ventil se však zablokoval v
otevřené poloze, tlak v primárním okruhu klesl, některá
náhradní čerpadla vodního chlazení selhala, zbylým teplem
začala voda vřít, praklo několik palivových článků. Do
okolí unikla radioaktivní voda, pára a plyny - bylo zamořeno
široké okolí elektrárny, bylo evakuováno několik tisíc
lidí. Podobně jako později v Černobylu, viníci nehodu
několik dní zcela tajili; na rozdíl od Černobylu se však
zainteresovaným kruhům i později skutečný rozsah havárie
podařilo utajit, takže spolehlivé údaje o
množství uniklých radioaktivních látek chybí.
Havárie v Černobylu
Dosud nejtěžší radiační havárie
(7.stupně) se stala 26.dubna 1986 v jaderné elektrárně v Černobylu
(princip činnosti jaderných reaktorů a jejich bezpečnost je
stručně diskutována v §1.3 "Jaderné reakce",
pasáž "Štěpení atomových jader"; průběh a příčiny černobylské havárie
jsou popsány v pasáži "Havárie jaderného reaktoru v Černobylu"). Při destrukci jaderného reaktoru došlo k rozsáhlé
kontaminaci životního prostředí radioaktivními
štěpnými produkty a k ozáření 232 osob vysokými
dávkami záření (jednotky až desítky Sv),
spojenými s deterministickými účinky a akutním poškozením
zdraví; v 31 případech se jednalo dokonce o účinky letální
(z toho 2 pracovníci byli usmrceni přímo při výbuchu
reaktoru, avšak i kdyby se tak nestalo, obdrželi by letální
dávku záření)! Dalších mnoho stovek osob obdrželo dávku
záření desítky až stovky mSv, u níž se dá očekávat
zvýšený výskyt stochastických účinků (min. o 1%; i když
se zatím nepotvrdilo...).
Přes veškerou závažnost a lokální tragičnost
černobylské havárie se však její důsledky naštěstí
ukázaly být podstatně menší, než se
zpočátku zdálo. A samozřejmě mnohonásobně menší
(přinejmenším 100-krát menší!), než tvrdily některé
propagandistické materiály, zmanipulované ať již z
politických důvodů (studená válka -
antikomunismus, antisovětismus), či z
pohnutek partikulárních zájmů (boj
proti jaderné energii, uhelná lobby a pod.). Černobylská havárie se však každopádně stala
určitým mezníkem v jaderné energetice a
radiační ochraně. Vedla k podstatnému zpřísnění
bezpečnostních předpisů a norem radiační ochrany nejen v
jaderné energetice, ale v celé oblasti aplikací ionizujícího
záření (vyústilo to až v přehnanou
byrokratizaci radiační ochrany - srov. pasáž "Byrokratické
požadavky radiační ochrany"v
§5.8). K tak rozsáhlé havárii, jaká
byla v Černobylu, patrně již nikdy nedojde!
Další nedávno vzniklá závažná jaderná
havárie, k níž došlo v Japonsku, je stručně popsána v
pasáži "Havárie v jaderné elektrárně Fukushima". Tuto havárii nikdo nezavinil, její příčinou
byla obrovská přírodní katastrofa. Formálně byla ohodnocena
rovněž stupněm 7, což však je zavádějící, neboť její
rozsah a závažnost je nesrovnatelně menší než u Černobylu.
U velkých radiačních havárií s
rozsáhlou radioaktivní kontaminací životního prostředí
jsou často hlavní zdravotní rizika a újmy u většiny
postižených obyvatel způsobeny ani ne tak radiací, jako
spíš stresem z evakuace a obavami plynoucími z nadhodnocení
rizik, z radiofobie...
Radiační
nehody s uzavřenými zářiči
I s uzavřenými zářiči může dojít k
vážným radiačním nehodám, pokud je jejich intenzita
záření (dávkový příkon) patřičně vysoká. Potenciálně
nebezpečnými zářiči z tohoto hlediska jsou zvláště silné
radioterapeutické ozařovače či průmyslové
zářiče např. pro defektoskopii či sterilizaci. Při
neopatrné manipulaci s takovými nechráněnými zářiči
může dojít k vnějšímu ozáření organismu
vysokými radiačními dávkami buď celotělově
(Ţ nemoc
z ozáření - někdy i letální, zvýšený výskyt
stochastických účinků), nebo lokálně (Ţ radiační
popáleniny).
Tragická radiační nehoda tohoto druhu se stala v
září r.1987 v městě Goiania
oblasti Goias v Brazílii, kde z radioterapeutického ozařovače
určeného k vyřazení byl neodborně a nekontrolovaně vyjmut
cesiový zářič 137Cs o aktivitě cca 50 000 GBq. Neznalí pracovníci jej
vzali domů, rozebrali a pak prodali do šrotu. Pracovníci
skladu odpadových surovin dále rozdělali zářič a jeho
jednotlivé části vzali domů (líbilo se jim modravé
světélkování!), dokonce si s nimi hrály i děti. Výsledkem
bylo 5 úmrtí na nemoc z ozáření, 20 osob mělo lokální
radiační popáleniny (většinou na rukách).
Další radiační nehody, některé s letálními
následky, vznikly při krádežích zářičů. Je dokonce
známo i několik případů kriminálního zneužití
zářičů nastražených proti osobám (vraždy či
pokusy o vraždu). Pachatelé a oběti těchto radiačních
úkladů jsou většinou osoby podílející se na špionážní
činnosti a organizovaném zločinu.
Řada radiačních nehod se stala přeexponováním
pacientů při radioterapeutickém ozařování v
důsledku chybné kalibrace ozařovače či chybě v ozařovacím
plánu. Vážná nehoda tohoto druhu se stala v prosinci r.1990
ve fakultní nemocnici v Zaragoze ve Španělsku, kde vinou
špatné kalibrace lineárního urychlovače došlo k
2-7-násobnému přeexponování ozařovaných pacientů, vlivem
čehož na nemoc z ozáření zemřelo 18 pacientů a dalších 9
utrpělo radiační poškození.
Je třeba s uspokojením konstatovat, že v
současné době k radiačním nehodám dochází poměrně zřídka.
Oblast aplikací ionizujícího záření je sledována,
koordinována a zabezpečena tak důkladně (někdy
snad až přehnaně byrokraticky...), jako
snad žádný jiný obor lidské činnosti. Pracují zde
většinou odborně fundovaní lidé, dobře obeznámení se
zásadami práce s radioaktivitou a ionizujícím zářením i s
principy radiační ochrany.
Radioaktivní kontaminační ("špinavá")
bomba
Takto se označuje zbraň, v níž je klasická výbušnina
kombinována s radioaktivními materiály. Jejím
účelem je radioaktivně kontaminovat okolí kolem
výbuchu rozmetáním radioaktiviních látek. Skládá se z
nálože chemické výbušniny s příměsí (nebo obalem) radioaktivních
látek. Výbuch klasické trhaviny rozpráší radioaktivní
látky do okolního prostředí. Rozsah kontaminace závisí
především na síle nálože a množství radioaktivního
materiálu, místě odpálení (výšce nad
zemí), okolním terénu (včetně městské zástavby),
rychlosti a směru větru. Kontaminace z prakticky proveditelné
"špinavé bomby" bývá rozptýlena pouze do několika
set metrů nebo max. několika kilometrů od místa výbuchu.
Může působit biologickými účinky
ionizujícího záření na osoby v postižené oblasti (zpravidla nikoli fatálními),
avšak hlavním záměrem je vyvolání hromadné radiofobní
paniky. Jsou zde též velké ekonomické náklady na
dekontaminaci a ztráty z přerušení výrobní činnosti. V
případě tohoto radiačně kontaminačního teroristického
útoku je potřeba uskutečnit v zásadě podobná radiohygienická
opatření jako při radiačních haváriích jaderných
zařízení ("Radiační nehody a
havárie", 3.stupeň závažnosti
radiační nehody, či 6.stupeň havárie jaderného reaktoru).
Jen některé radionuklidy, s dostatečně
dlouhým poločasem rozpadu, jsou vhodné pro účel
radioaktivní kontaminační bomby. Jsou to např. cesium-137, kobalt-60, iridium-192, stroncium-90, plutonium-238, americium-241, kalifornium-252, příp. polonium-210, radium-226. A samozřejmě vysoce účinná je štěpná
rozpadová směs radionuklidů ve vyhořelém palivu z
jaderných reaktorů (§1.3, pasáž "Štěpné produkty"). Je zde i otázka dostupnosti
dostatečně velkého množství (aktivity) vhodných
radionuklidů (např. americium-241, nebo
kalifornuim, ve větším množství není k dispozici...).
Vojenské využití radioaktivní kontaminační
bomby je prakticky nulové, avšak vznikly obavy, ža by se mohla
stát zbraní v rukou teroristů. Není to ale
naštěstí pro ně příliš snadné. Získání většího
množství vhodných radionuklidů je obtížné (na černém trhu, ze ztracených či odcizených
zdrojů v průmyslu, medicíně, výzkumu; regulerní zdroje jsou
přísně evidovány). Manipulace s vysoce
radioaktivními látkami je nebezpečná, vyžaduje odbornou
způsobilost, náročné laboratorní podmínky a radiační
ochranu. Individuální teroristé zde nemají šanci, mohlo by
se to snad částečně podařit u větších teroristických
organizací, které by si mohly zaplatit tým jaderných
odborníků. Reálné nebezpečí je však asi malé..?..
Včasné odhalení a prevence nelegální
přepravy radioaktivních materiálů a pokusů o přípravu
radiačně kontaminujících teroristických náloží je v
zásadě možné radiometrickým monitorováním pomocí
G.M., scintilačních či polovodičových detektorů
ionizujícího záření, především záření gama. Tyto
přístroje se instalují na letiště a hraniční přechody.
Radioaktivní odpady
Radioaktivní odpad je takový již
nevyužitelný*) materiál (látka či předmět) vzniklý při výrobě a
používání zdrojů záření, který obsahuje radioaktivní
látky. Podle výše uvedené klasifikace radioaktivních
zářičů jsou tyto odpady zářiče
otevřené.
Radioaktivní odpad může být potenciálně nebezpečný pro životní prostředí - může
způsobovat nežádoucí ozáření či kontaminaci.
*) Tato nevyužitelnost však může být relativní a podmíněná momentálním
stavem technologií. S vývojem nových technologií se může
původně obtížný odpad stát vítanou
surovinou
(viz např. pasáž "Jaderné
odpady" v
§1.3).
Jak lze
zlikvidovat radioaktivitu?
Je známo, že téměř všechny
škodliviny lze zlikvidovat spálením - při
vysoké teplotě nad cca 600°C se rozloží chemické vazby,
dojde k oxidaci a látka přestává být toxická (určitou
výjimkou jsou sloučeniny těžkých kovů, které je někdy
obtížné převést na neškodné sloučeniny). Pro
radioaktivní látky toto neplatí - vlastní radioaktivitu nelze zlikvidovat
spálením! - viz pasáž "Nezávislost
radioaktivního rozpadu na vnějších podmínkách"
v kap.1.2 "Radioaktivita". Běžným spálením pouze
rozložíme či změníme chemické vazby, avšak počet
radioaktivních atomů zůstává přesně stejný jako před
spálením - část jich unikne v plynné formě v dýmu, část
zůstane v pevné fázi v popelu. Ke zničení radioaktivních
jader bychom museli látku zahřát na teplotu několika
miliónů stupňů aby docházelo k jaderným reakcím. Tím
bychom sice mohli zlikvidovat stávající radioaktivní jádra,
avšak při jaderných reakcích by zase naopak z původně
neaktivních jader mohly vznikat nová radioaktivní jádra... V
§1.3 "Jaderné reakce" jsou diskutovány tzv. transmutační
technologie likvidace radioaktivních odpadů
ozařováním neutrony (ADTT), které mohou mít význam u dlouhodobých a vysoce
aktivních odpadů z jaderných reaktorů.
Pro manipulaci s radioaktivním odpadem a
jeho likvidaci je rozhodující především aktivita
a poločas rozpadu příslušných radionuklidů, dále
pak chemická forma. V závislosti na poločasu
rozpadu a radiotoxicitě je pro každý radionuklid (resp.
kategorii radionuklidů) stanovena tzv. uvolňovací
úroveň: je to taková hodnota aktivity (celkové nebo měrné hmotnostní či objemové
aktivity), pod jejíž úrovní je
ohrožení kontaminací již zanedbatelné a látka může být
uvedena do životního prostředí bez speciálních
radiohygienických opatření. Hodnota uvolňovací úrovně se
stanovuje na základě limitace možné radiační zátěže při
vnitřní kontaminaci daným radionuklidem, s použitím
konverzních faktorů ingesce a inhalace
(bylo analyzováno výše v pasáži "Stanovení
radiační dávky z vnitřní kontaminace. Metoda MIRD."). ........doplnit kategorie radionuklidů......
Podle
skupenství může být radioaktivní odpad pevný, kapalný nebo plynný
:
- Pevné
radioaktivní odpady
se shromažďují v řádně označených nádobách nebo igelitových sáčcích,
setříděných podle aktivit a poločasů ve speciální
vymírací místnosti, kde se skladují tak
dlouho, až jejich aktivita přirozeným rozpadem
poklesne pod stanovenou zprošťovací úroveň. Ve
vhodných intervalech se proměřují a pak
likvidují jako již neradioaktivní odpad, např.
spálením *). Dlouhodobé
radioaktivní odpady se "likvidují" jejich
převezením na centrální úložiště,
kde jsou uloženy v hermetických dlouhodobě odolných
nádobách.
*) Při tomto spalování se zde
jedná o likvidaci příp. nebezpečných chemických
látek. Opět připomínáme, že vlastní radioaktivitu
nelze zlikvidovat spálením!
- Kapalné radioaktivní
odpady
jsou vedeny (odděleně od
neaktivní kanalizace) do speciálních záchytných retenčních nádrží - "vymíracích jímek", odkud jsou do
kanalizace nebo čističky vypouštěny až po
dostatečném rozpadu (cca 10
poločasů rozpadu), dokud neklesne
jejich objemová aktivita pod uvolňovací úroveň. Pak
mohou být vypouštěny do veřejné kanalizace nebo
vodoteče; tam
se již dále samovolně smíchávají
a objemově ředí s vodou komunální kanalizace.
Je nutno dodržet limitní hodnotu pro objemovou aktivitu
odpadní vody z ústavů (např. pro 131I používaný pro terapii štítné žlázy
podle současné normy činí 450 Bq/litr), odvozenou od
uvolňovací úrovně daného radionuklidu. Je vhodné
pomalé kontinuální či frakcionované vypouštění odpadní vody z
vymíracích jímek, aby výsledná měrná (objemová)
aktivita vypouštěných odpadů byla pokud možno
podstatně nižší než uvolňovací úroveň. Některá
větší pracoviště s otevřenými radionuklidy mají
speciální automatizované systémy monitorování,
ředění a vypouštění odpadních vod.
U výpustí
radioaktivního odpadu je třeba průběžně provádět monitorování aktivity odpadní vody -
buď pomocí radiometrické detekční sondy instalované
ve výpusti, nebo pravidelným odběrem vzorků a jejich
měřením, nejcitlivěji ve studnovém scintilačním
detektoru.
Kapalné odpady dlouhodobých radionuklidů je třeba koncentrovat (minimalizace objemu, příp. převedení do
pevného skupenství) a pak v dobře uzavřených
nádobách dlouhodobě skladovat v centrálním
úložišti.
Z hlediska radiační ochrany je tedy
radioaktivní odpady nutno udržet
pod kontrolou tak dlouho, dokud jejich radioaktivita
neklesne v důsledku samovolného rozpadu na dostatečně nízkou
úroveň, aby nemohlo dojít k žádnému ohrožení biosféry.
Obtížným problémem to je pro vysoce
aktivní
odpady, obsahující radionuklidy s dlouhými
poločasy
rozpadu; do této kategorie patří především vyhořelé jaderné palivo ze štěpných jaderných reaktorů (§1.3, pasáž "Jaderné
odpady").
Další
možností je řízené pomalé dlouhodobé zavádění
radioaktivních látek do přírodního prostředí,
při splnění dvou podmínek:
1. Nesmí být překročena aktuální
uvolňovací úroveň radionuklidů, aby lokálně nedošlo k
možnosti zvýšené radiační zátěže v místě
vypouštění.
2. Celkové množství uvolněných
radioaktivních látek nesmí překročit "objemovou
kapacitu" distribučního volumu daných látek v
přírodě, aby v budoucnosti nedošlo ke zvýšení
přírodního radiačního pozadí.
5.7.
Radiační zátěž při radiační diagnostice a terapii
Radiační
expozice z diagnostických lékařských vyšetření je
obecně nízká a je
téměř vždy odůvodněna přínosem přesné
diagnózy případných zdravotních poruch a patologických
stavů. Tyto expozice jsou obvykle srovnatelné s dávkami,
které průběžně dostáváme z přírodního radiačního
pozadí všude kolem nás. Není žádný přímý důkaz o tom,
že by tyto nízké radiační dávky mohly být škodlivé *) -
navzdory hypotetické lineární bezprahové závislosti a řadě
víceméně zavádějících tabulek v literatuře o radiační
ochraně (jako jsou např. srovnání
radiace a kouření). Naproti tomu přínosy
medicínského vyšetření jsou nepochybné a mohou být
zdravotně velmi významné !
*) Otázky radiobiologického vlivu
nízkých dávek záření jsou diskutovány výše v §5.2,
část "Vztah dávky a biologického účinku", pasáž "Problematika velmi nízkých dávek -
jsou škodlivé či prospěšné?".
Terapeutické
využití radiace přirozeně vede k vyšším expozicím,
při nichž je nutné zvážit a optimalizovat rizika léčby
oproti možným přínosům. Avšak i zde, při správném
naplánování, optimalizaci a strategii, zdravotní
přínos bývá nepochybný.
I přes převažující zdravotní přínos
aplikací ionizujícího záření v medicínské diagnostice a
terapii je třeba otázkám radiační ochrany i zde věnovat
patřičnou pozornost !
Radiační
dávky a ochrana pacientů při diagnostických a terapeutických
výkonech
Medicínská diagnostika a terapie patří k
nejdůležitějším aplikacím ionizujícího záření; nejvíc
též přispívá k radiační zátěži obyvatelstva ze všech
uměle vytvořených zdrojů záření.
Metodika radiační ochrany při lékařských
aplikacích ionizujícího záření - v rtg diagnostice,
radioterapii a v nukleární medicíně - na obecné úrovni
vychází ze základních principů radiační ochrany uvedených
v §5.3 "Cíle
a metody ochrany před zářením",
má však svá význačná specifika. Především se zde nestanovují
závazné limity ozáření, aby nebyly omezovány
některé diagnostické a terapeutické výkony potřebné pro
zajištění zdraví či života pacientů. S trochou nadsázky
se používá slogan: "Každý pacient dostane
takovou radiační dávku, jakou si zaslouží ":
dávku potřebnou pro přesnou diagnostiku či účinnou terapii.
Místo limitů jsou stanovovány určité doporučené
hodnoty dávek, tzv. směrné hodnoty -
referenční úrovně, jako vodítko při provádění
konkrétních diagnostických nebo terapeutických metod (viz níže "Princip optimalizace").
Princip
odůvodnění lékařského ozáření
Radiační ochrana pacientů vychází ze základního etického
požadavku, aby riziko radiačního poškození při diagnostických nebo terapeutických výkonech bylo vyváženo (nebo lépe
pokud možno převáženo) očekávaným zdravotním
přínosem pro pacienta. Tento
základní požadavek při medicínské aplikaci ionizujícího
záření se v radiační ochraně nazývá princip
odůvodnění lékařského ozáření.
Princip
optimalizace
Dalším důležitým aspektem, který v praxi přispívá k
vyváženosti radiačního rizika a přínosu, je analýza
optimalizace radiační ochrany. Při RTG diagnostice použijeme takovou
nejnižší expozici, která zajistí kvalitní
a dobře hodnotitelné snímky, nikoli expozici vyšší. Při diagnostice v
nukleární medicíně je třeba aplikovat jen takové
nezbytně nutné množství - aktivity - radioaktivní látky (požadované kvality a čistoty), které zaručuje dostatečnou
diagnostickou informaci v obrazech při co nejnižší
radiační zátěži pacienta. Pro optimalizaci množství aplikované
radioaktivity různých radiofarmak u jednotlivých
vyšetřovacích metod byly vypracovány tabulky směrných
hodnot, nazývaných též diagnostické
referenční úrovně, které umožňují i
přepočet aplikované aktivity pro jednotlivé pacienty,
většinou podle hmotnosti pacienta (i nestandardní – např.
děti, osoby s nadváhou a pod.).
Radiační zátěž pacientů z RTG
vyšetření
Zdaleka nejčastější expozicí ionizujícím zářením (z umělých zdrojů) u lidí je rentgenová
diagnostika. V dřívějších dobách (asi do 60.-70.let 20.stol.), kdy
se skiagrafie prováděla na rentgenové filmy a skiaskopie přes
fluorescenční stínítka (zesilující
fólie a zesilovače obrazu ještě nebyly rozšířeny,
digitální flat-panely ještě neexistovaly), činily dávky z rtg vyšetření často mnoho
desítek mSv. Ostatně, tehdy se ani nestanovovaly...
S vývojem zesilovacích fólií, zesilovačů
obrazu a hlavně digitálních zobrazovacích elektronických
flat-panelů (viz §3.2, pasáž "Elektronické
zobrazení X-záření") se radiační dávky z rtg vyšetření značně snížily,
u prostých snímků představují jen desetiny až jednotky mSv.
Poměrně vyšší dávky (až desítky mSv) vznikají u CT
vyšetření větších oblastí (celého hrudníku, břicha,
celého těla), což je však vyváženo větší komplexností
diagnostické informace. Rovněž vysoké dávky vznikají při
komplikovaných intervenčních
RTG-navigovaných výkonech (zde jsou dávky
navíc značně variabilní, podle komplikovanosti výkonu a jak
snadno či obtížně se u daného pacienta "daří"
tento výkon realizovat).
Absorbovaná radiační dávka D
[mGy] při rtg vyšetření určité oblasti je v zásadě dána
součinem intenzity X-záření (ta je dána proudem rentgenkou
[mA]), expozičního času [s] a příslušných koeficientů :
D = G . mA s .
Součin proudu I a expozičního času t udává elektrické
množství Q - celkový náboj elektronů -
který protekl rentgenkou během expozice Q = I . t [mA.s] - [miliCoulomb] .
Elektrické množství Q určuje celkový počet fotonů
X-záření emitovaných rentgenkou, a tedy i sílu signálu při
RTG zobrazení.
Koeficient G v sobě zahrnuje řadu faktorů, jako je
účinnost produkce X-záření rentgenkou, jeho energii danou
napětím [kV] na rentgence, filtrace, vzdálenost, absorbční
koeficienty tkáně. Měří se pomocí fantomů, nejčastěji
vodou plněných "akvárií" (pro planární rtg), nebo
válců průměru 16cm (hlava) či 32cm (hrudník) pro CT,
opatřených ionizačními komůrkami, termoluminiscenčními
nebo polovodičovými detektory. Pravděpodobnost vzniku
biologických stochastických účinků je úměrná této absorbované
radiační dávce [mGy] a velikosti
(objemu) ozářené oblasti [cm3]. Tato velikost - objem - je přibližně úměrný
ozářené ploše [cm2] u planárního zobrazení, nebo délce [cm] CT
skenované oblasti.
V planární rtg diagnostice se
toto kvantifikuje pomocí veličiny plošné dávky
DAP (Dose Area Product) [Gy.cm2], což je součin
vstupní dávky X-záření a velikosti - plochy S -
ozářeného pole: DAP = D . S. Efektivní dávka
Def [mSv]
pro pacienta, vyjadřující stochastické účinky záření na
organismus jako celek, se pak vypočítá jako součin :
Def = EDAP . DAP ,
kde koeficient EDAP (regionálně normalizovaná efektivní dávka)
[mSv Gy-1
cm-2] v
sobě zahrnuje zprůměrované tkáňové (orgánové)
váhové faktory wT pro struktury v ozařované oblasti (§5.1 "Základní veličiny dozimetrie",
pasáž "Efektivní dávka"). Konkrétní hodnoty DAP při RTG vyšetřeních se
měří pomocí tenkých planparalelních ionizačních komůrek,
namontovaných na výstupní kolimátor RTG přístroje - tzv. DAP
metry či KAP metry (§3.2, pasáž "Radiační
zátěž při RTG vyšetření").
Typické expozice při planárním rtg snímkování v projekci
AP jsou přibližně: hlava 25mAs, DAP=1Gy.cm2; hrudník 30mAs,
DAP=0,6Gy.cm2; břicho 60mAs, DAP=1,8Gy.cm2; pánev 60mAs, DAP=2Gy.cm2.
Při tomografickém
CT vyšetření rentgenka kruhově obíhá kolem
zobrazované oblasti a ozařuje ji ze všech stran v podstatě
rovnoměrnou dávkou uvnitř každého řezu. Vyšetřovaná
oblast se dá z hlediska dávky aproximovat válcovým tvarem
o určitém průměru a délce. U CT se proto dávka D
měří ionizační komorou uvnitř akrylátového válcového
homogenního fantomu průměru 16 cm pro hlavu a 32 cm pro tělo
a kvantifikuje se pomocí dávkového indexu CTDI (CT
Dose Index) [mGy], s příp. korekcí na rychlost posunu (pitch
faktor) u spirálních přístrojů. Tato hodnota dávky
stanovená ve středu řezu se považuje za objektivní
indikátor (index) dávky v tkáni. Pravděpodobnost
vzniku biologických stochastických účinků je zde opět
úměrná absorbované radiační dávce [mGy] a
velikosti ozářené oblasti, úměrné délce
scanu [cm]. V rtg CT diagnostice se toto vyjadřuje pomocí výsledné
délkové dávky DLP (Dose Lenght Product)
[mGy.cm], což je součin absorbované dávky D a
délky L ozářené oblasti: DLP = D
. L (= CTDI . L). Efektivní dávka
Def [mSv]
pro pacienta, vyjadřující stochastické účinky záření na
organismus jako celek, se pak vypočítá jako součin :
Def = EDLP . DLP ,
kde koeficient EDLP (regionálně normalizovaná efektivní dávka)
[mSv mGy-1
cm-1] v
sobě zahrnuje zprůměrované tkáňové (orgánové)
váhové faktory wT pro struktury v ozařované oblasti (§5.1 "Základní veličiny dozimetrie",
pasáž "Efektivní dávka").
Typické dávkové parametry u CT
zobrazení při napětí 120kV a expozici 200-400mAs jsou
přibližně: hlava CTDI=45mGy, DLP=640mGy.cm; hrudník
CTDI=15mGy, DLP=400mGy.cm; břicho, pánev CTDI=17mGy,
DLP=700mGy.cm.
Pomocí speciálních tělo
modelujících antropomorfních fantomů, empirických
dat a počítačových simulací byly pro základní
vyšetřované oblasti lidského těla stanoveny následující
přibližné hodnoty koeficientů EDAP
a EDLP :
| Vyšetřovaná
oblast : |
hlava |
krk |
hrudník |
břicho |
pánev |
| EDAP
[mSv Gy-1 cm-2] : |
0,04 |
0,07 |
0,15 |
0,18 |
0,20 |
| EDLP
[mSv mGy-1 cm-1] : |
0,0023 |
0,0054 |
0,017 |
0,017 |
0,019 |
| Tab.5.7.1. Přibližné hodnoty koeficientů EDAP
a EDLP pro základní snímkované oblasti. |
Pozn.: Radiační
dávka u planárního RTG zobrazení (na rozdíl od CT) pro
jednotlivé vyšetřované oblasti je výrazně závislá na
použité geometrické projekci. V naší ilustrativní tabulce
jsme pro EDAP uvedli přibližné hodnoty pro předo-zadní projekci
AP.
Současné počítačově
řízené rtg přístroje (především CT) si samy stanovují a
ve výsledkovém protokolu (ve formátu
DICOM) zaznamenávají hodnoty DAP, CTDI a
DLP při snímkování konkrétního pacienta. Efektivní dávku
Def [mSv]
pak můžeme snadno stanovit vynásobením hodnoty DAP nebo DLP
příslušným koeficientem EDAP či EDLP; v případě vyšetřování více oblastí je
celková dávka Eef dána součtem přes všechny vyšetřované části
těla pacienta. Tato jednoduchá metoda stanovení efektivní
dávky z rtg vyšetření je zcela postačující
pro účely radiační hygieny - ani složitější metody
neposkutují validnější výsledky. Ostatně, jak bylo uvedeno
v §5.1, samotný koncept efektivní dávky je
jen zprůměrovaným, hrubým a zjednodušeným "kvalifikovaným
odhadem" složitých a individuálně závislých
procesů biologických účinků záření...
Z hlediska optimalizace radiační ochrany byly
pro RTG vyšetření stanoveny směrné hodnoty - diagnostické
referenční úrovně - doporučených expozic pro
planární skiagrafické snímky a CT zobrazení :
| Planární
skiagrafické snímky |
CT zobrazení |
| Vyšetřovaná
oblast |
Vstupní
dávka
[mGy] |
DAP
[mGy.cm2] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Břicho
AP |
5,2 |
2900 |
| Pánev
AP |
4,5 |
2000 |
|
| Vyšetřovaná
oblast |
CTDI
[mGy] |
DLP
[mGy.cm] |
| Hlava |
65 |
1100 |
| Krk |
21 |
500 |
| Hrudník |
15 |
500 |
| Páteř |
32 |
550 |
| Břicho |
19 |
750 |
| Pánev |
25 |
860 |
|
| Tab.5.7.2. Diagnostické referenční úrovně doporučené expozice pro
planární skiagrafické snímky a CT zobrazení |
Radiační
zátěž pacientů z radionuklidových vyšetření
je v zásadě dána aplikovanou aktivitou [MBq]
radioindikátoru (přímá úměrnost), poločasem
rozpadu použitého radionuklidu, druhem a
energií emitovaného záření a farmakokinetikou
radioindikátoru - stupňem akumulace
radiofarmaka v jednotlivých tkáních a orgánech, jakož i
rychlostí jeho biologického vylučování
(exkrece), či rezidenční dobou setrvání
radiofarmaka v tkáni. Tyto závislosti jsou značně složité a
individuální, v plné komplexnosti se je snaží řešit výše
rozebírabá metoda MIRD,
obr.5.5.1.
Na základě této metody, jakož i empirických
stanovení a odhadů, byly sestaveny tabulky přepočítávacích
koeficientů - konverzních faktorů h
[mSv/MBq] pro jednotlivá radiofarmaka, které umožňují
prostým vynásobením aplikované aktivity A [MBq]
přibližně stanovit efektivní dávku Def [mSv] pro pacienta: Def = h . A . Hodnoty konverzních faktorů h (efektivní dávky/1MBq) a
směrné hodnoty - diagnostické referrenční úrovně
- doporučené aplikované aktivity (normované
na váhu pacienta 70 kg) pro některá
častěji používaná radiofarmaka ve scintigrafii jsou vedeny v
následující tabulce :
| Radionuklid |
Chemická
forma |
Efektivní
dávka
h [mSv/MBq] |
Druh
vyšetření |
Aplikovaná
aktivita [MBq] |
| 99mTc |
| pertechnát TcO4 |
| fosfáty |
| DMSA |
| MAG 3 |
| HIDA |
| makroagregáty |
| MIBI, tetrofosmin |
| HMPAO |
| leukocyty |
| protilátky |
|
| 1,2 . 10-2 |
| 5,8 . 10-3 |
| 8,7 . 10-3 |
| 7,3 . 10-3 |
| 1,5 . 10-2 |
| 1,1 . 10-2 |
| 6.9 . 10-3 |
| |
| |
| 9,8 . 10-3 |
|
| štítná žláza |
| skelet |
| ledviny statické |
| ledviny dynamické |
| játra dynamická |
| perfuze plic |
| perfuze myokardu |
| perfuze mozku |
| záněty |
| nádory |
|
| 200 |
| 800 |
| 150 |
| 250 |
| 250 |
| 200 |
| 800 |
| 800 |
| 600 |
| 800 |
|
| 131I |
jodid |
24 |
štítná žláza |
15 |
| 123I |
| jodid |
| ioflupan, IBZM |
| MIBG |
| |
|
|
| štítná žláza |
| mozek-receptory |
| nádory |
| |
|
|
| 111In |
| leukocyty |
| protilátky |
| DTPA |
| octreotid |
|
| 3,9 . 10-1 |
| 2.2 . 10-1 |
| |
| 5,4 . 10-2 |
|
| záněty |
| nádory |
| cisternografie |
| nádory neuroedokrin. |
|
|
| 67Ga |
citrát |
|
záněty, nádory |
300 |
| 18 F |
FDG, FLT, FMISO, ... |
2,5 . 10-2 |
nádory |
750 |
| Tab.5.7.3. Diagnostické referenční úrovně doporučené aplikované aktitivity
pro nečastější vyšetření scintigrafické
diagnostiky a dávkové konverzní faktory h pro
používaná radiofarmaka... |
Pozn.: V
zákonitostech radiační zátěže je podstatný rozdíl
mezi rentgenovou diagnostikou a nukleární medicínou. Při
RTG vyšetření je zdrojem ionizujícího záření přístroj a
radiační dávka závisí m.j. na počtu prováděných
snímků, či na rozsahu oblasti snímané při CT. U
scintigrafie není zdrojem záření diagnostický přístroj,
ale samotný pacient, resp. jeho vyšetřovaný orgán. Můžeme
tedy pořídit libovolný počet scintigrafických snímků,
aniž by se změnila radiační zátěž pacienta. Radiační
zátěž pacienta je zde determinována již při
aplikaci radiofarmaka - jeho druhem (radionuklidem a
chemickou formou) a aplikovanou aktivitou.
Určitou možností, jak snížit
radiační zátěž u pacienta po aplikaci radiofarmaka,
je ovlivnění jeho biokinetiky - zvýšená hydratace s
doporučením k častějšímu močení (příp.
podání diuretika) pro urychlené
vyloučení radioaktivní látky z organismu, nebo aplikace
vhodných preparátů, omezujících navázání radiofarmaka na
určitý orgán (jodid draselný KI pro
ochranu štítné žlázy při aplikaci radiofarmak značených 131I nebo 99mTc).
Typické
hodnoty radiační zátěže pacientů z radiační diagnostiky
Průměrná
radiační zátěž pro nejčastejší metody RTG diagnostiky (vlevo) a
radioisotopové diagnostiky v nukleární medicíně (vpravo) je
uvedena v následující tabulce 5.7.4 (vychází
se z materiálů IAEA). Jedná se o přibližné průměrné
hodnoty za předpokladu, že jsou dodrženy směrné hodnoty
energie, intenzity a doby expozice u rtg diagnostiky a směrné
hodnoty aplikované radioaktivity u metod nukleární medicíny (zde se u uvedených metod vesměs jedná o radiofarmaka
značená 99mTc, jen poslední řádek pozitronová
emisní tomografie PET nádorových onemocnění odpovídá 18F-FDG) :
| Rentgenová diagnostika |
Radioisotopová diagnostika |
| Druh vyšetření
|
Ef. dávka
[mSv] |
| Snímek plic |
0,05 |
| Páteř |
0,4 |
| Břicho |
1 - 3 |
| Urografie |
2,1 |
| Mamografie |
0,5 |
| Angiografie |
3 - 9 |
| CT hlava |
2 |
| CT tělo
(hrudník, břicho) |
7 - 10 |
|
| Druh vyšetření |
Ef. dávka
[mSv] |
| Statická scintigrafie ledvin |
1,5 |
| Dynamická scintigrafie ledvin |
2,5 |
| Dynamická cholescintigrafie |
2,3 |
| Scintigrafie skeletu |
3,5 |
| Perfúzní scintigrafie plic |
1,2 |
| Scintigrafie štítné žlázy |
2,2 |
| Scintigrafie perfuze myokardu |
5 |
| PET - nádorová diagnostika |
7 |
|
| Tab.5.7.4. Přibližná radiační zátěž pro
nejčastější metody rentgenové a radioisotopové
diagnostiky |
Standardní typické
hodnoty efektivních radiačních dávek při RTG a
radioisotopové diagnostice jsou seřazeny podle veliklosti ve
sloupcovém diagramu na obr.5.7.1. Úplně nejnižší radiační dávky (téměř zanedbatelné) jsou u zubního
RTG snímkování (0,008mSv u
intraorální RTG a 0,015mSv u OPG). Podobně velmi
nízké
dávky jsou u kostních ortopedických snímků
končetin a
RTG snímků plic (cca
0,05-0,07 mSv). Tyto
nízké efektivní dávky jsou zde způsobeny dvěma okolnostmi:
1. Pro získání dostatečně kvalitních
snímků stačí poměrně nízká expozice (cca
20mAs), vedoucí k
absorbované dávce zlomky mGy;
2. Ve
snímkovaných oblastech se nenacházejí vysoce radiosenzitivní
tkáně a orgány (s vysokým tkáňovým
faktorem wT), ale jen poměrně
radiorezistentní tkáně s wT<0,1 .
Značně vyšší radiační dávky jsou u CT vyšetření, kde rentgenka rotuje kolem
vyšetřované oblasti a průběžně ji prozařuje; vyšší
radiační dávka je zde však vyvážena
podstatně
podrobnějším diagnostickým zobrazením. Radiační dávka
záleží na velikosti snímkované oblasti (u
CT hlavy cca 2mSv, CT břicha až 10mSv). A úplně nejvyšší
dávky, až
desítky mSv, vznikají při komplikovaných intervenčních RTG-navigovaných výkonech (na
diagramu poslední sloupec vpavo - zde jsou dávky navíc
značně variabilní, podle komplikovanosti výkonu a jak snadno
či obtížně se u daného pacienta "daří" tento
výkon realizovat...).
Všechny tyto hodnoty diagnostických radiačních
dávek spadají do oblasti velmi nízkých dávek
podle obr.5.2.3 vlevo, kde stochastické účinky jsou nejen
velmi malé, ale mají i hypotetický charakter (jak bylo diskutováno výše v pasáži "Problematika
velmi nízkých dávek - jsou škodlivé či prospěšné?")..?..
Poznámka k tabulce a diagramu:
Konkrétní hodnoty radiačních dávek jsou v praxi
značně variabilní, cca +- 50%. V tabulce a diagramu
jsou zprůměrované zaokrouhlené hodnoty, víceméně
orientační (nemusí proto přesně
souhlasit číselné hodnoty efektivních dávek), v závislosti na použitých přístrojích a
nastavení jejich parametrů, či hodnotách aplikované aktivity
radiofarmak. Některá pracoviště akcentují nižší expozice
a "šetří" radiofarmaky (kvalitu
obrazů upravují sekundární filtrací při vyhodnocování), jiná pracoviště používají vyšší expozice a
aplikují více aktivity radiofarmak (za
účelem kvalitnějších primárních obrazů či kratší doby
vyšetření)... Celkově lze říci, že s
technickým vývojem přístrojové elektroniky a
počítačových vyhodnocovacích procedur se radiační dávky
postupně snižují.
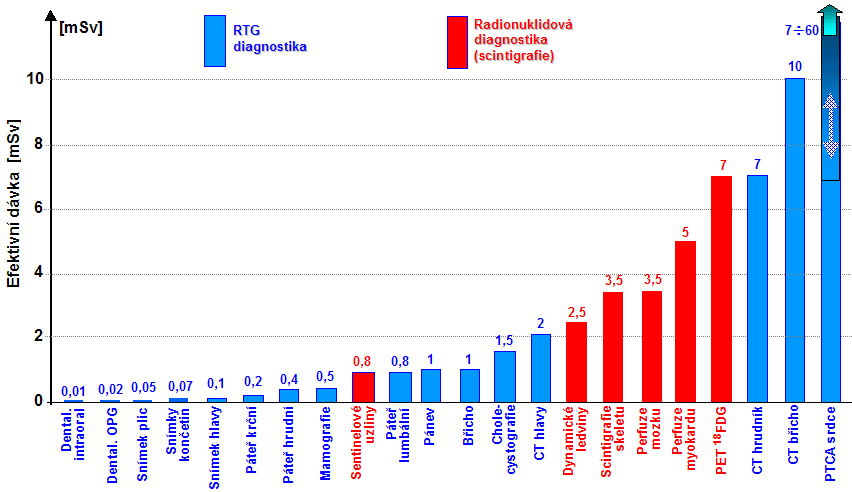
Obr.5.7.1 Diagram přibližných typických hodnot radiačních
dávek pacientů při nejčastějších RTG a scintigrafických
diagnostických vyšetřeních. Modré sloupce znázorňují RTG
diagnostiku, červené radionuklidovou scintigrafickou
diagnostiku v nukleární medicíně.
Při radiační terapii
jsou dávky v cílových tkáních samozřejmě značně vysoké
- desítky Gy, kanceroletální tumorová dávka,
ale i v okolních zdravých tkáních mohou dosahovat jednotky Gy
- toleranční dávka. Avšak i zde, při správném
naplánování, optimalizaci a strategii, zdravotní
přínos bývá nepochybný (je
podrobněji rozebíráno v §3.6 "Radioterapie",
pasáž "Fyzikální a radiobiologické faktory
radioterapie").
Při terapeutických
aplikacích radionuklidů se aplikuje přesně stanovené
množství radioaktivity – stanovuje se buď podle ověřených
empirických vzorců, nebo paušálně podle dané diagnózy a
požadovaného terapeutického efektu (podrobnněji §3.6 "Radioterapie", pasáž
"Radioisotopová terapie"). Aktivita každé radioaktivní látky
aplikované pacientovi (zvláště pak
terapeutické aplikace) musí být změřena na správně kalibrovaném a metrologicky ověřovaném měřiči
aktivity. Hodnota aplikované aktivity se zapisuje
v dokumentaci o diagnostice
či terapii; je to důležitý údaj pro posouzení
účinku terapie a radiační zátěže.
......................
Radiační riziko
stochastických účinků - rozdělení radiofarmak podle
radiačního rizika. Posouzení přijatelnosti radiačního
rizika v kontextu ostatních rizik pracovního a životního
prostředí.
Aplikace radiofarmak dětem - volba aktivity, radiační
zátěž u dětí ve srovnání s dospělými osobami. Aplikace
radiofarmak ženám v reprodukčním věku a v období gravidity.
....doplnit?
U těhotných
žen se provádí radiodiagnostické úkony spojené
s ozářením jen v nezbytně nutných případech, přičemž
se volí co nejšetrnější metody
s ohledem na ochranu plodu. .......... doplnit?
5.8.
Organizační a legislativní zajištění radiační ochrany
Každý, kdo užívá zdrojů
ionizujícího záření, je povinen v mezích své působnosti
činit všechna potřebná opatření k ochraně zdraví
svého, svých spolupracovníků i ostatních osob. Základním
legislativním rámcem pro práci s ionizujícím zářením je
v současné době tzv. "Atomový zákon"
o mírovém využívání jaderné energie a ionizujícího
záření (původní zákon č. 18/1997, poslední
novelizace je č. 263/2016 Sb.) a související
normy a předpisy. Je to především vyhláška SÚJB č.
184/1997 - poslední novelizace vyhláškou SÚJB č.422/2016,
dále vyhlášky SÚJB č. 146/1997 a SÚJB č. 214/1997.
Atomový zákon stanovuje nejobecnější pravidla pro práci se
zdroji ionizujícího záření. Zejména jsou důležité cíle
radiační ochrany – vyloučení deterministických účinků a
omezení stochastických účinků na rozumné minimum, dále
principy práce s IZ – zdůvodnění a optimalizace radiační
činností (riziko versus profit), limitování, přírodní
zdroje, lékařské expozice...
Postupné
zlepšování a inovace předpisů v oblasti radiační ochrany
probíhají zejména na základě odborných doporučení
Mezinárodní komise pro radiační ochranu
ICRP.
Pro dohled a koordinaci celého komplexu
opatření pro bezpečné používání zdrojů ionizujícího
záření se zřizují centrální ústavy a úřady pro
radiační ochranu. U nás byl zřízen Státní úřad
jaderné bezpečnosti (SÚJB). Kromě legislativní
činnosti SÚJB posuzuje projekty pracovišť se zdroji
ionizujícího záření, vydává příslušná povolení a
vykonává inspekční činnost na těchto pracovištích.
Na
každém pracovišti s ionizujícím zářením je kromě toho
ustaven dohlížející pracovník radiační ochrany,
který se přímo na místě zabývá otázkami radiační
ochrany a vede příslušnou dokumentaci. Dohlížející
pracovník se účastní kursů a seminářů pořádaných SÚJB
a dalšími organizacemi a odbornými společnostmi. Na
větších pracovištích nukleární medicíny (jako je KNM FNsP
Ostrava) je zřízen Technicko-fyzikální úsek (TFÚ),
který spolu s ostatní fyzikální a technickou problematikou
pracoviště po odborné stránce zajišťuje i metodiku ochrany
před zářením. V některých velkých zdravotnických
ústavech je zřízeno centrální Oddělení lékařské
radiační fyziky a hygieny, které koordinuje veškeré
otázky aplikace záření a radiační ochrany.
Soubor
hlavních zásad, opatření a metodika měřících postupů pro
zajištění optimální úrovně radiační ochrany na
konkrétním pracovišti, jsou sepsány v tzv. Monitorovacím
programu pracoviště (co se měří, jak často se měří,
kde se měří, jak a čím se měří, interpretace výsledků
měření a jejich dokumentace). Součástí monitorovacího
programu je stanovení referenčních úrovní – záznamová,
vyšetřovací, zásahová.
Dalším
souvisejícím materiálem je Program zabezpečování kvality
pro diagnostickou a terapeutickou činnost pracoviště, což je
soubor kontrolních a adjustačních činností pro zajištění
správné funkce přístrojů a potřebné kvality radiofarmak;
toto je podmínkou přesných a spolehlivých výsledků
měření a vyšetření. S problematikou ochrany před
zářením to souvisí prostřednictvím optimalizace mezi
přínosem a riziky aplikace ionizujícího záření: čím jsou
validnější výsledky diagnostiky a lepší účinky terapie,
tím více převažuje zdravotní profit pacientů nad rizikem
nežádoucích účinků ionizujícího záření – a naopak.
Soubor
opatření včetně postupů dekontaminace a kontrolních
měření při radiačních haváriích a jiných mimořádných
událostech na pracovišti jsou shrnuty v Havarijním řádu
pracoviště. Rovněž v Provozním řádu pracoviště je
obsažena řada konkrétních zásad pro správnou a bezpečnou
práci se zdroji ionizujícího záření.
Jelikož organizační a legislativní
problematika je značně vzdálena profesnímu zaměření autora
(fyzika), k podrobnostem bude vhodné odkázat přímo na
www-stránky SÚJB: http://www.sujb.cz .
Pro
podrobnější popis problematiky radiační ochrany (zvláště
v oblasti otevřených zářičů a nukleární medicíny)
můžeme dále odkázat na práce odborníků zabývajících se
radiační ochranou, např. :
Hušák V.: .............
Hušák V., Pašková Z.: Radiační ochrana v nukleární
medicíně. In: Principy a praxe radiační ochrany. SÚJB, Praha
2002
............. - doplnit
Některé aspekty jsou stručně zmíněny
i v sylabu "Radiační ochrana".
Osobní
poznámka autora: Zbytečná
byrokracie v radiační ochraně
Jak bylo již výše zmíněno, v současné době je oblast aplikací
ionizujícího záření z hlediska radiační ochrany
sledována, koordinována a zabezpečena tak důkladně,
jako snad žádný jiný obor lidské činnosti. To je jistě
třeba kvitovat velmi pozitivně. Jako fyzik,
pracující více než 40 let v oblasti jaderné a radiační
fyziky, bych si k tomu však dovolil drobnou kritickou
poznámku :
Zdá se mi, že toto celkově velmi kvalitní
pojetí radiační ochrany je v posledních letech někdy
realizováno a interpretováno snad až přehnaně
byrokraticky... Bazíruje se občas na nevýznamných
detailech, požadavky důležité v oblastech vysokých aktivit a
radiačních intenzit se mechanicky přenášejí
na malá pracoviště (jako jsou
nukleární medicíny), kde žádná radiační
rizika fakticky nehrozí. Enormně narostlo množství
úředních "papírů" a dokumentů a jejich rozsah.
Akcentují se a široce popisují úkoly, pravomoci, podpisy irelevantních
osob - různých těch statutárních zástupců,
ředitelů, náměstků a dalších úředníků, kteří s
radiační činností nemají nic společného a často ani neví
o její podstatě a existenci...
Za tuto situaci jistě nemohou odborníci a
pracovníci koordinující radiační ochranu (snad s výjimkou ojedinělých případů servilní
snahy být "papežtější než papež" a horlivě
zmnožovat irelevantní předpisy...).
Souvisí to s obecnějším trendem k hierarchickému
uspořádání západní společnosti, růstem byrokracie
a nahrazováním skutečného práva formální justicí -
zapomíná se na zlaté pravidlo "litera
zabíjí, duch oživuje".
V oblasti aplikací záření, jakož i radiační
ochrany, pracují téměř výhradně odborně fundovaní
lidé, dobře obeznámení se zásadami práce s
radioaktivitou a ionizujícím zářením. Tito pracovníci erudovaně
vykonávají svou odbornou práci a realizují
radiační ochranu "tak jak se má", podle
svého nejlepšího vědomí a svědomí. Jim by se měla
dát větší důvěra, bez zbytečných "buzerací" a
enormní administrativní zátěže..!..
Ostatně, s podobným byrokratickým
přístupem se nyní setkáváme i u předpisů a
požadavků pro přípravu a rozplňování radiofarmak
na pracovištích nukleární medicíny (§4.8,
část "Radionuklidy a radiofarmaka", poznámka "Radiofarmaka - byrokracie").
Vojtěch Ullmann


















