
Scintigrafická diagnostika a radionuklidová terapie v nukleární medicíně
| AstroNuklFyzika ® Jaderná fyzika - Astrofyzika - Kosmologie - Filosofie | Fyzika a nukleární medicína |
4.
Radioisotopová scintigrafie
4.1.
Podstata a metody scintigrafie. Pohybový
scintigraf.
4.2. Scintilační kamery
4.3. Tomografická scintigrafie
4.4. Hradlovaná scintigrafie
4.5. Fyzikální parametry scintigrafie -
kvalita zobrazení a fantomová měření
4.6. Vztah scintigrafie a ostatních
zobrazovacích metod
4.7. Matematická analýza a
počítačové vyhodnocování v nukleární medicíně
4.8. Radionuklidy a
radiofarmaka pro scintigrafii
4.9. Klinická
scintigrafická diagnostika v nukleární medicíně
4.1. Podstata a metody scintigrafie
Radionuklidy v
nukleární medicíně
Nukleární medicína je obor zabývající se
diagnostikou a terapií pomocí otevřených
radioaktivních látek - radiofarmak -
aplikovaných do vnitřního prostředí organismu; těmito
metodami in vivo se budeme zabývat v
této kapitole. Při vyšetření in vitro
se radiofarmakum neaplikuje pacientovi do těla, ale používá
se při radiochemické analýze odebraných vzorků jeho krve;
pacient nepřichází do kontaktu s radioaktivní látkou,
pracuje se pouze se vzorkem plasmy nebo jiné tělní tekutiny (radioisotopové metody in vitro jsou stručně
nastíněny v §3.5 "Radioisotopové
stopovací metody", pasáž
"Radioimunoanalýza - radiosaturační analýza"; nyní již většinou nejsou součástí
nukleární medicíny, ale laboratorní biochemie).
Metody nukleární medicíny jsou založeny na dvou základních
vlastnostech radionuklidů :
1. Emise pronikavého ionizujícího
záření při radioaktivních přeměnách jader (podrobný fyzikální výklad v §1.2 "Radioaktivita");
2. Shodné chemické chování
isotopů Ţ radioaktivní isotopy reagují chemicky stejně jako
stabilní isotopy téhož prvku (§3.5
"Radioisotopové stopovací
metody").
Radioaktivní atomy a jejich molekuly -
sloučeniny "označené" radioaktivními prvky - se v
organismu distribuují stejně jako kdyby byly neradioaktivní,
avšak při radioaktivních přeměnách příslušných jader je
průběžně emitováno pronikavé záření. Toto záření je
umožňuje "zviditelnit" - sledovat, indikovat,
"stopovat" *) - a měřit jejich množství
detekčními přístroji při diagnostice, nebo
svými radiobiologickými účinky toto záření může být
využíváno k léčebným účelům.
*) Odtud obecný název indikátorové
nebo stopovací (tracer) metody, které
se používají nejen za pomoci radionuklidů a nejen v
medicíně, ale i v laboratorních a průmyslových aplikacích (§3.5 "Radioisotopové
stopovací metody").

Scintigrafická diagnostika a
radionuklidová terapie v nukleární medicíně
Ústřední metodou nukleární medicíny je radioisotopová
diagnostika in vivo: aplikujeme vhodnou (bio)chemickou
látku s navázaným radionuklidem - tzv. radioindikátor
či radiofarmakum - do organismu. Tato látka
vstoupí do metabolismu a distribuuje se v
organismu podle svého chemického složení - farmakokinetiky
- daného radioindikátoru. Fyziologicky či patologicky se
hromadí v určitých tkáních a orgánech, přeskupuje se a
následně vylučuje. Chemická skladba radiofarmaka určuje jeho
začlenění do kinetiky nebo do určitých metabolických
procesů - cílený vstup (targeting)
do relevantních tkání, orgánů, buněk či sub-buněčných
elementů, včetně následného vylučování. Zabudovaný
radionuklid svým vyzařováním pak umožňuje buď zevní detekci
a zobrazení distribuce této látky (zářením g u scintigrafie),
nebo sledování jeho množství v odebraných vzorcích
(biologických tekutin, většinou krve
nebo moči) - konkrétní metody těchto
vyšetřovacích metod jsou podrobně popisovány níže v
části "Klinická
scintigrafická diagnostika v nukleární medicíně". V případě terapie pak
záření radionuklidu vykonává biologické účinky
na buňky tkáně, v němž se radiofarmakum akumuluje (např. likviduje nádorové buňky - §6.6 "Radioterapie",
část "Radioisotopová terapie").
Radioindikátory v nukleární medicíně jsou
aplikovány v nepatrném stopovém množství,
cca 10-9-10-12 gramu (piko- či nanomolární koncentrace v tkáních), takže samy nemohou (bio)chemicky
ovlivnit funkci vyšetřovaných orgánů, ani nemohou
způsobovat nějaké vedlejší či toxické účinky na
organismus *). Mohou pouze způsobovat radiační
zátěž, kterou se optimalizací aplikovaných aktivit
snažíme mimimalizovat.
*) Jedinou výjimkou z
této biochemické bezpečnosti jsou radiofarmaka na bázi myších
monoklonálních protilátek. U nich se mohou u
určitého malého procenta pacientů vyskytovat alergické
reakce, způsobené přítomností tzv. HAMA
protilátek (je diskutováno níže v
části "Radionuklidy a radiofarmaka pro scintigrafii").
Nejznámějším příkladem
je aplikace radioaktivního jodidu sodného NaI131, který se jako
každý jód vychytává (akumuluje) ve štítné žláze. Zevní
detekcí záření gama emitovaného při radioaktivních b-přeměnách jader
131I pak
lze změřit akumulaci tohoto jódu nebo zobrazit jeho distribuci
ve štítné žláze - §4.9.1 "Thyreologická radioisotopová diagnostika"; v případě potřeby záření b může při
aplikaci vyšších aktivit vykazovat biologické účinky na
buňky, využívané v terapii.
Byla vyvinuta řada druhů radiofarmak
s afinitou k ledvinám, játrům, kostem, myokardu, některým
nádorovým či zánětlivým tkáním, signálním receptorům,
pro jejichž funkci je daná látka indikátorem
(§4.8 "Radionuklidy
a radiofarmaka pro scintigrafii"). Míra lokální akumulace radiofarmaka záleží na
intenzitě místních metabolických a funkčních dějů v
orgánech a tkáních. Případné poruchy funkce lze pomocí
scintigrafického zobrazení lokalizovat, analyzovat a příp. i
kvantifikovat.
Nebo se radionuklid vstřikne do krevního oběhu
a sleduje se dynamika jeho průchodu
srdcem, plícemi a velkými cévami - v tomto případě bez
metabolické vazby na konkrétní orgán či tkáň (§4.9.4, část "Dynamická radiokardiografie" a "Radionuklidová
hradlovaná ventrikulografie",
příp. §4.9.8, část "Perfúzní scintigrafie mozku"); opět s možností
analýzy a kvantifikace.
"Molekulární
zobrazení"
S rozvojem organické chemie, biochemie a
buněčné biologie byla vyvinuta některá radiofarmaka,
jejichž značené molekuly mají afinitu ke zcela určitým
specifickým druhům buněk či procesům na subcelulární
úrovni. Pomocí scintigrafie a vhodného radiofarmaka tak lze
cíleně vyšetřit nejen funkci určitého orgánu či tkáně,
ale selektivně postihnout i zcela určitý typ metabolické nebo
transportní cesty, např. enzymové či receptorové vazby nebo
reakce antigenu s protilátkou. Pro tento účel byla vyvinuta a
stále se vyvíjení speciální radiofarmaka (jak pro
diagnostiku, tak pro terapii), která jsou charakterizována
svými účinky na molekulární úrovni. S
trochou nadsázky se tyto metody lokálního měření a
zobrazení fyziologické odezvy označují jako "biochemie
in vivo".
Pozn: Název "molekulární
zobrazení" samozřejmě neznamená, že
bychom snad zobrazovali přímo samotné molekuly (to bohužel
nedokážeme), ale zobrazujeme takovou distribuci
radioindikátoru, která je důsledkem a odrazem specifických
biochemických reakcí na molekulární úrovni.
Scintigrafie
Průchod a distribuce radioindikátoru tedy odráží konkrétní
fyziologický či patologický stav nebo funkci
příslušných orgánů a tkání. Pro jeho posouzení v
nejjednodušších případech stačí prosté změření
intenzity záření g
vycházejícího z určitého místa (např. ze štítné žlázy - pro stanovení její
akumulace) kolimovanou detekční sondou.
Pro komplexnější diagnostiku však potřebujeme změřit -
zmapovat - zobrazit - celou distribuci
radioindikátoru, včetně lokálních detailů a
anomálií. K tomu slouží důležitá metoda zvaná scintigrafie
či gamagrafie :
| Scintigrafie : |
| Scintigrafie či gamagrafie je fyzikálně-elektronická metoda zobrazení distribuce radioindikátoru v organismu na základě zevní detekce vycházejícího záření gama |
Terminologická poznámka:
Výstižnější název gamagrafie -
zobrazování pomocí záření gama - se bohužel používá
poměrně zřídka; převládl méně přesný název scintigrafie
pocházející z toho, že technicky se zde nyní používají scintilační
detektory. V budoucnu budou scintilační detektory
pravděpodobně vytlačeny detektory polovodičovými (viz níže "Alternativní fyzikální a technické principy
gamakamer"), čímž název "scintigrafie" již ztratí
opodstatnění. Ze setrvačnosti bude však název scintigrafie
nepochybně přetrvávat.
Scintigrafie či scintigrafické vyšetření se v
"hantýrce" nukleární medicíny často též nazývá
scintigrafická studie. Pochází to z dob, kdy
scintigrafie byla nová experimentální výzkumná metoda,
umožňující studovat fyziologické
děje v organismu.
Ve většině textu této
kapitoly (§4.1-4.8) se budeme zabývat fyzikálními
principy scintigrafického zobrazení a technickými
řešeními přístrojů pro gamagrafické zobrazení. Klinické
využití scintigrafie v nukleární medicíně je shrnuto v
posledním §4.9 "Klinická
scintigrafická diagnostika v nukleární medicíně". A o terapeutickém využití
radionuklidů je pojednáváno v §3.6 "Radioterapie",
část "Radioisotopová terapie".
Druhy scintigrafie
Než se budeme zabývat
konkrétními fyzikálně-elektronickými metodami pro realizaci
scintigrafického zobrazení, stručně si uvedeme rozdělení
(klasifikaci, kategorizaci) scintigrafických metod. Z hlediska časového
lze scintigrafii rozdělit na dva druhy :
Z hlediska prostorového-geometrického můžeme scintigrafii rozdělit opět do dvou kategorií :
Z hlediska komplexnosti a interpretace scintigrafického vyšetření můžeme rozlišovat dvě základní kategorie :
Radiační
zátěž při scintigrafickém vyšetření
Při každé interakci ionizujícího záření s organismem se
část tohoto záření absorbuje v tkáních a způsobuje radiační
zátěž; u diagnostických aplikací (mírné) riziko
nežádoucích stochastických účinků. V zákonitostech
radiační zátěže je podstatný rozdíl mezi
rentgenovou diagnostikou a nukleární medicínou. Při RTG
vyšetření je zdrojem ionizujícího záření přístroj
(rentgenka umístěná mimo tělo pacienta) a radiační dávka
závisí m.j. na počtu prováděných snímků, expozičních
časech či na rozsahu oblasti snímané při CT (§3.3,
pasáž "Radiační zátěž pacientů
při RTG vyšetření").
U scintigrafie není zdrojem záření diagnostický
přístroj, ale samotný pacient, resp. radionuklid
distribuovaný uvnitř jeho těla ve vyšetřovaných tkáních a
orgánech. Můžeme tedy již pak pořídit libovolný počet
scintigrafických snímků, v různých projekcích, s různou
akviziční dobou, aniž by se změnila radiační zátěž
pacienta.
Radiační
dávka obdržená pacientem v souvislosti se scintigrafickým
vyšetřením je dána již při podání
radiofarmaka do organismu. Závisí především na hodnotě aplikované
aktivity [MBq] - přímá úměrnost. Výrazně též
závisí na druhu aplikovaného radiofarmaka.
Chemická forma určuje míru a rychlost akumulace radiofarmaka v
různých tkáních a orgánech a rychlost jeho vylučování.
Radionuklid použitý ke značení určuje poločas radioaktivní
přeměny a druh emitovaného záření. V případě čistých
gama-radionuklidů (jako je 99mTc) je radiační zátěž poměrně nízká, neboť
většina pronikavého záření g prochází tkání a
odnáší svou energii ven. Při vlastní scintigrafii však
velikost radiační zátěže pacienta vůbec nezávisí
na akviziční době. Pacient je kontinuálně slabě
zatěžován radiací (s klesajícím
dávkovým příkonem) i po odchodu z
pracoviště nukleární medicíny - při následném pobytu na
jiném zdravotnickém pracovišti, nebo doma... Doba, za kterou
radioaktivita prakticky vymizí z těla,
závisí na fyzikálním poločasu rozpadu radionuklidu a
biologickém poločasu vylučování radiofarmaka; pro
radioindikátoy značené 99mTc (cca 100-300 MBq) to bývá zhruba za 2-3 dny.
Sumárně jsou otázky radiační zátěže
diskutovány v §5.7 "Radiační zátěž
při radiační diagnostice a terapii".
Základní
principy scintigrafického zobrazení
Jak scintigrafického
zobrazení dosáhnout ?
Mohl by vzniknout nápad využít k tomu fotografii:
Záření g je přece elektromagnetické vlnění stejné
fyzikální podstaty jako světlo. Chceme-li zobrazit nějaký
předmět pomocí světla (odraženého či aktivně
emitovaného), využijeme zákonitostí geometrické
optiky a promítneme pomocí spojné čočky
(objektivu fotoaparátu) obraz daného předmětu na citlivou
fotografickou vrstvu a určitou dobu exponujeme - fotochemickou
reakcí vznikne latentní obraz, který se po vyvolání stává
viditelným obrazem různé hustoty zrníček stříbra ve
fotografické emulzi - viz obrázek vlevo.
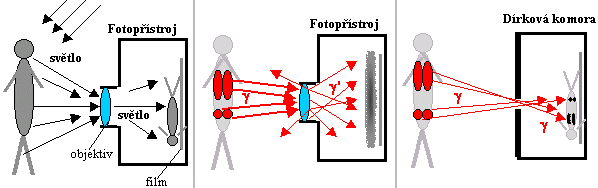
Obr.4.1.1. Porovnání možností fotografického zobrazení ve
viditelném světle a v záření gama.
Bylo by velmi příjemné, kdyby takto
jednoduše šlo pacienta "vyfotografovat" v záření g - na obrázku
uprostřed.. Bohužel to však není možné! Záření g se při dopadu na
čočku objektivu nebude lámat jako světlo. Jak bylo uvedeno v
§1.3, záření g interaguje s každou látkou, a tedy i s materiálem
čočky v objektivu, třemi způsoby:
1. Fotoefekt - zde přicházející foton
zanikne a tedy vůbec na citlivou vrstvu nedoletí Ţ není
použitelné pro zobrazení.
2. Comptonův rozptyl - zde by sice
některé rozptýlené fotony g' mohly dopadnout na citlivou vrstvu a vyvolat tam
fotochemickou reakci, avšak úhel rozptylu je v podstatě
náhodný a pokaždé jiný, nezávisle na úhlu dopadu.
Comptonovsky rozptýlené záření nevytvoří tedy žádný
obraz, ale jen víceméně monotónní zšednutí či zčernání
filmu. Tedy ani Comptonův rozptyl není použitelný pro
fotografické zobrazení v záření gama *).
*) Toto tvrzení není však zcela
absolutní, platí jen pro fotografické zobrazení. Na konci
§4.2 bude ukázáno, že Comptonova rozptylu záření g lze v principu
využít k elektronické kolimaci v zatím
experimentálních tzv. Comptonových kamerách.
3. Tvorba e-e+-párů
(pokud by primární záření g mělo energii >>1MeV) - zde
primární foton g zaniká a sekundární fotony anihilačního záření
se sice rozlétají vždy v protilehlých směrech *), avšak
pokaždé pod jiným úhlem v prostoru Ţ totéž, co u Comptonova
rozptylu.
*) Této skutečnosti se využívá k
elektronické kolimaci u pozitronové emisní tomografie
(PET) - viz §4.3, část "Pozitronová emisní tomografie PET".
Ke stejným závěrům bychom dospěli, kdybychom se místo
čočky pokusili k zobrazení v záření g použít dutého
zrcadla. Pouze nejjednodušší zobrazení pomocí dírkové
komory na obr.4.4.1 vpravo funguje i pro záření
gama, používá se v kolimátorech typu Pinhole
(jsou popsány níže v části "Scintigrafické
kolimátory").
Pro záření g tedy neplatí
zákony lomu či odrazu Ţ pro záření g neexistuje žádná refrakční
ani reflexní optika! Žádným způsobem
nedovedeme cíleně ovlivnit směr pohybu fotonů záření g *). Pouze pro
měkké X-záření za určitých okolností ještě jakž takž
funguje reflexní zrcadlová optika, avšak jen pro
velmi malé úhly dopadu-odrazu - viz
dodatek "Rentgenové dalekohledy" na konci §3.2.
*) Fyzikálně vzato dovede směr pohybu fotonů g ovlivnit (díky
své univerzálnosti) jen gravitace. Takové gravitační
čočky gigantických rozměrů se sice hojně
vyskytují ve vesmíru (viz §4.3, pasáž
"Gravitačná čočky. Optika černých děr." v knize "Gravitace, černé díry a
fyzika prostoročasu"), v laboratorních podmínkách na Zemi však
realizovatelné nejsou; i kdybychom dovedli vyrobit miniaturní
černé díry s požadovanými vlatnostmi, kvalita
jejich zobrazení by nebyla příliš dobrá a hlavně by nás
okamžitě zahubily svou gravitací a kvantovým
vyzařováním (§4.7."Kvantové
vyzařování a termodynamika černých děr" v téže knize).
Jedinou možností jak
dosáhnout zobrazení v záření g je kolimace
- odstínění záření g ze všech nežádoucích
směrů a propuštění pouze záření z potřebného směru.
Vzniká tak kolimační projekce v záření
gama. Takto se zářením g "nakládá" většina metod scintigrafie -
viz níže "Scintigrafické kolimátory". Výjimkou jsou speciální metody
využívající tzv. elektronické kolimace
pomocí koincidenční detekce dvou nebo několika primárních
či sekundárních fotonů. Tyto principy se využívají
především u pozitronové
emisní tomografie, nebo u zatím
experimentálních Comptonových kamer (viz část "Comptonovy kamery" a "Gamakamery pro vysoké energie") či Comptonových
teleskopů v astrofyzice - jakýchsi "dalakohledů bez
čoček a zrcadel".
Pohybový
scintigraf
Historicky prvním druhem
přístrojů umožňujících provádět scintigrafické
zobrazení distribuce radioaktivity byl pohybový
scintigraf nazývaný někdy též scanner.
První přístroj tohoto druhu sestrojil v r.1951 B.Cassen se
svými spolupracovníky, jejich hlavním výrobcem v 60. a
70.letech byla firma Picker (obr.4.1.2
vpravo). Jedná se v principu o jednoduché
zařízení, schématicky znázorněné na obr.4.1.2 :

Obr.4.1.2. Pohybový scintigraf.
Vlevo: Principiální schéma pohybového
scintigrafu (dole uprostřed je ukázka
scintigramu štítné žlázy). Vpravo:
Scintigraf Picker 500i na KNM Ostrava.
Na společném masívním rameni
posunovaném elektromotorkem je na jednom konci upevněn kolimovaný
scintilační detektor *) a na druhém konci elektromagnetické
pisátko. Detektor se rovnoměrným meandrovitým
pohybem posunuje nad měřeným objektem W, záření
g (které
je detekováno pouze z oblasti přesně pod kolimátorem v jeho
ose) se převádí na elektrické impulsy, které se (po zesílení a amplitudové diskriminaci, příp.
redukci nadměrné četnosti) vedou do
cívky elektromagnetického pisátka. Na každý impuls se z
cívky elektromagnetu vymrští ferromagnetické jádro
opatřené na konci pisátkem (razníkem), které přes barvící
pásku natiskne na papír značku (čárku).
Každá čárka představuje, podle nastavení redukce, sto či
tisíc impulsů nebo pod. Čím vyšší je radioaktivita místa,
nad nímž se kolimovaná sonda právě nachází, tím větší
frekvenci impulsů bude sonda vysílat do cívky elektromagnetu a
tím hustěji bude tedy pisátko při svém pohybu nad papírem
vyťukávat čárečky obrazu. Výsledkem je zobrazení neviditelné
distribuce radioindikátoru pomocí viditelné hustoty
čárek na papíře (obr.4.1.2 uprostřed) - vzniká
scintigrafický obraz W*. Kromě papíru se u některých přístrojů záznam
scintigramů prováděl i na fotografický film,
což umožňovalo lépe rozlišit detaily v četnosti impulsů.
*) Pro zvýšení detekční účinnosti se
používaly poměrně velké scintilační krystaly o průměru
až 15cm, opatřené mnohootvorovými fokusovanými
kolimátory. Na plochu krystalu tak bylo z ohniska ve
vyšetřovaném místě soustřeďováno záření g z poměrně
velkého prostorového úhlu.
Výhodou pohybového scintigrafu byla jednoduchost
a snad též to, že poskytoval obraz v měřítku 1:1. Měl
však některé zásadní nevýhody. Je to v
prvé řadě velmi nízká účinnost měření:
detekována je vždy jen pranepatrná část fotonů g pouze z místa,
nad nímž se detekční sonda právě nachází - záření ze
všech ostatních míst uniká bez užitku. Dále, sonda se nad
pacientem pohybuje poměrně pomalu a snímání
scintigrafického obrazu trvá značně dlouho. Pokud se
distribuce radioindikátoru mění s časem během měření,
nejsme schopni tyto změny zachytit a zobrazit - pohybový
scintigraf neumožňuje dynamickou scintigrafii.
Z těchto důvodů se pohybové scintigrafy již asi od konce
80.let nepoužívají (nejdéle
se používaly pro scintigrafii štítné žlázy, obr.4.2.1
uprostřed dole) - byly zcela nahrazeny scintilačními
gamakamerami.
| Scintilační kamera je přístroj, který snímá fotony záření g současně z celého zorného pole, převádí je na elektrické impulsy a pomocí nich pak vytváří scintigrafický obraz distribuce radioindikátoru v tomto zorném poli. |
Princip
scintilační kamery
Scintilační kamery, neboli gamakamery,
jsou dosud nejdokonalejšími zařízeními pro
scintigrafické zobrazování distribuce radioaktivity. Jedná se
o zařízení značně složité jak svým principem, tak
technickou konstrukcí.
První scintilační kameru
zkonstruoval H.O.Anger v r.1958. V počátečních experimentech
používal jednootvorový kolimátor a scintilace v tenkém
krystalu většího průměru exponoval na fotografickou desku.
Rozhudující zdokonalení dosáhl tím, že ke krystalu
přiložil fotonásobiče (původně 7 fotonásobičů), které
snímaly záblesky ve scintilačním krystalu a převáděly je
na elektrické impulsy, které se elektronicky vyhodnocovaly.
První scintilační kamery s 19 fotonásobiči začala vyrábět
firma Nuclear Chicago v r.1964, zanedlouho pak firma Picker
(přední výrobce pohybových scintigrafů); později v Evropě
firmy Intertechnique, Philips, Gamma, v Japonsku Toshiba.
Principiální schéma Angerovy scintilační
kamery je na obr.4.2.1 :

Obr.4.2.1. Principiální schéma
scintilační kamery (analogové).
Pozn.: Pro
názornost jsou zakresleny jen dva fotonásobiče F1 a F2. Ve
skutečnosti je fotonásobučů větší počet - min. 19 (u
starších kamer s menším zorným polem), 32, 64 i více.
Detekce
záření g a stanovení místa jeho vzniku
Mějme (modelový) vyšetřovaný objekt W, v němž
jsou tři lokalizovaná ložiska A, B,
C zvýšené koncentrace g-radioindikátoru. Z
každého místa depozice radioaktivity se izotropně na všechny
strany emituje záření g, které díky své pronikavosti vychází z objektu W
ven. Aby mohlo pomocí tohoto záření g vzniknout zobrazení, je
nutno nejdříve provést jeho kolimační projekci.
Dosáhneme toho tak, že vycházejícímu záření g dáme do cesty olověnou
desku, provrtanou velkým množstvím drobných
rovnoběžných otvorů. Tímto kolimátorem
mohou projít pouze ty fotony g, které se pohybují přesně ve směru osy otvorů.
Ostatní fotony, které jdou "šikmo" se pohltí na
olověných přepážkách mezi otvory. Kolimátor tak vytvoří rovinnou
projekci distribuce radioindikátoru do modře
označené roviny na obr.4.2.1. Zde je umístěn tenký
velkoplošný scintilační krystal. Každý foton
záření g, který projde kolimátorem, vyvolá v krystalu
scintilační záblesk velkého počtu fotonů (viditelného)
světla. Scintilace v krystalu jsou snímány a na elektrické
impulsy převáděny soustavou fotonásobičů,
opticky přilepených na krystal *). Na obr.4.2.1 jsou pro
jednoduchost nakresleny jen dva fotonásobiče - F1
a F2.
*) Obecný princip
scintilačních detektorů a fotonásobičů, jejich vlastnosti a
konstrukce, jsou podrobně rozebírány v §2.4 "Scintilační
detektory".
Sledujme nyní
"osud" jednotlivých fotonů g vyzářených z nitra
vyšetřovaného objektu W. Především, každý foton g', který letí v jiném
směru něž přesně kolmo k čelu kolimátoru (tj.
rovnoběžně s osami otvorů), je pohlcen na
přepážkách mezi otvory kolimátoru, na krystal nedopadne a není
detekován. Foton gA, který vyletí
"správným směrem" z místa A,
proletí otvorem kolimátoru a vyvolá v místě A´
v krystalu scintilaci, jejíž fotony se v krystalu šíří
všemi směry. Na fotonásobič F1, který je
blízko místa A´ scintilace, dopadne z tohoto
záblesku poměrně velký počet fotonů, takže impuls na jeho
výstupu bude mít vysokou amplitudu, zatímco vzdálený
fotonásobič F2 obdrží jen nepatrnou porci z
těchto fotonů a jeho impuls bude velmi nízký. U fotonu gB
z místa B nastane scintilace zhruba uprostřed
mezi fotonásobiči F1 a F2,
takže i amplituda jejich impulsů bude přibližně stejná. U
fotonu gC (vyzářeného z ložiska C),
který dopadne a vyvolá scintilaci poblíž fotonásobiče F2,
dostane mnohem více světla fotonásobič F2,
než fotonásobič F1, a takový bude i poměr
amplitud jejich impulsů.
Obecně tedy, nejvíce světla se dostane do
fotonásobiče, který je nejblíže *) místu
záblesku (místu interakce fotonu g s krystalem) - na jeho výstupu proto vznikne impuls, jehož
amplituda je větší než amplituda impulsů ze
vzdálenějších fotonásobičů, na jejichž fotokatody dopadne
méně světla z daného záblesku. Lokalizace poloh záblesků
se tedy provádí jakousi elektronicko-geometrickou "triangulací",
stanovuje se jako "těžiště" signálů z
fotonásobičů.
*) Největší porci světla dostane
fotonásobič tehdy, když scintilace vznikne přímo pod
středem fotokatody. Ze scintilací ve vzdálenějších místech
dopadne na fotokatodu méně fotonů fotonů, takže výstupní
signál má nižší amplitudu.
Vidíme tedy, že porovnáním
amplitud impulsů z jednotlivých fotonásobičů lze vypočítat
polohu záblesku v krystalu, a tím i místo v
těle pacienta, odkud byl foton g vyzářen. Impulsy z
jednotlivých fotonásobičů (kterých je větší počet - 16 (u starších kamer s menším krystalem), 32, 64 i více), jsou vedeny na elektrický obvod
zvaný komparátor (jeho
základem je odporová matrice), kde se
provádí porovnávání amplitud impulsů a vytvářejí se
výsledné souřadnicové impulsy X
a Y - ty již nesou přímou informaci o poloze
scintilace v krystalu a tím i o poloze místa v
organismu, z něhož byl příslušný foton gama
vyzářen. Tyto impulsy X a Y
se po zesílení vedou na vychylovací destičky osciloskopické
obrazovky, kde určují polohu záblesku na stínítku (tak tomu bylo u starších analogových
gamakamer používaných v 60. a 70. letech).
Amplitudový
analyzátor
Kromě souřadnicové analýzy se impulsy ze všech
fotonásobičů vedou ještě na sumační obvod
- z pohledu tohoto obvodu se celá scintilační kamera chová
jako jeden velký scintilační detektor záření g. Tyto sumační
impulsy, jejichž amplituda je úměrná energii
absorbovaného záření g, se pak vedou na amplitudový analyzátor
*) (selektor impulsů podle
amplitudy) - pro každý záblesk je tak
určena nejen jeho poloha (souřadnicové
impulsy X,Y) ale i energie fotonu g, který tento
záblesk vyvolal. Okénko analyzátoru se
nastavuje tak, aby propustilo pouze impulsy odpovídají fotopíku
- totální absorbci záření g v krystalu. Pokud má
použitý radionuklid více energií záření g, nastaví se
okénko zpravidla na "hlavní" (nejsilnější)
fotopík, popř. se použije měření ve více okénkách,
nastavených na jednotlivé fotopíky.
*) Princip a úloha amplitudového
analyzátoru při spektrometrii záření je popsána v §2.4
"Scintilační
detektory", pasáž
"Zpracování výstupních impulsů ze scintilačního
detektoru".
Pro správné radiometrické měření na
každém spektrometrickém přístroji je totiž
základní
podmínkou nastavení okénka analyzátoru na fotopík záření
gama použitého radionuklidu. U scintilační kamery je, kromě
detekční účinnosti, správné nastavení okénka analyzátoru
nutné pro potlačení comptonovsky rozptýleného záření a
zajištění sladění fotonásobičů pro dosažení dobré
homogenity zorného pole (viz níže
pasáž "Nepříznivé vlivy u scintigrafie a jejich
korekce", část
"Comptonovský rozptyl záření g).
U starších typů gamakamer se nastavení okénka
analyzátoru na fotopík provádělo ručně, u moderních
digitálních kamer je realizováno automatické
nastavení a doladění okénka analyzátoru - tzv. Peaking
(píkování) či Auto Peak (automatické
doladění píku). Na základě porovnání četnosti
impulsů v dolní a horní polovině okénka se toto okénko
analyzátoru automaticky naladí na střed fotopíku
(viz obrázek) :

Vznik
analogového scintigrafického obrazu
Impulsy za amplitudovým analyzátorem, označované jako Z
(nijak nesouvisejí se souřadnicí
třetího rozměru!) jsou uniformní
"trigrovací impulsy" - říkají: "Ano, teď byl
zaregistrován 'správný' foton záření g a souřadnicové impulsy X
a Y jsou platné". Impulsy Z se vedou na
mřížku osciloskopické obrazovky; zde zruší na okamžik
záporné předpětí, čímž se oblak elektronů vydá od
katody, zaostří a urychlí se v "elektronovém děle"
a letí směrem ke stínítku obrazovky. Na urychlovacích
destičkách se mezitím již objeví souřadnicové impulsy X
a Y, čímž se elektronový paprsek vychýlí
patřičným směrem, dopadne do patřičného místa (A*,
B* či C* - v závislosti na
místě emise fotonu g A, B či C)
stínítka obrazovky, kde vyvolá světelný záblesk.
Jelikož záblesky postupně přicházejí na stínítko
obrazovky jako by tam "pršely", říká se těmto
analogovým obrazům někdy "vypršené obrázky".
Tímto
způsobem se neviditelná distribuce radioindikátoru
ve vyšetřovaném objektu W, přes fyzikálně-elektronickou detekci neviditelného
záření gama, zobrazuje ve formě hustoty viditelných
záblesků v odpovídajících místech obrazovky -
vzniká scintigrafický obraz W*. Radioaktivní
struktury (léze) A,B,C ve vyšetřovaném objektu se zobrazí
jako místa A*,B*,C*
se zvýšeným počtem záblesků na obrazovce.
Popsaná scintilační kamera podle obr.4.2.1 poskytuje analogové scintigrafické obrazy na stínítku osciloskopu. Tento obraz je zde přítomen jen po dobu snímání fotonů g kamerou, po skončení snímání ("odchodu pacienta") tento obraz mizí. Abychom jej uchovali, fotografoval se z obrazovky fotoaparátem, jehož závěrka byla otevřená po dobu střádání impulsů. Často se též používal tzv. perzistentní oscilosklop, na jehož stínítku záblesky nemizely okamžitě, ale po nastavitelnou dobu zde setrvávaly a teprve potom plynule slábly až zmizely.
Digitální
scintigrafické obrazy
Výše popsaný fotografický způsob záznamu (analogových)
scintigrafických obrazů má nevýhodu v tom, že jej nelze
dodatečně upravovat (třebas zesilovat tmavá podexponovaná a
zeslabovat světlá přeexponovaná místa) a hlavně jej nelze
kvantifikovat. Proto s rozvojem stolních
minipočítačů v 60.letech byla snaha doplnit (a později i
nahradit) osciloskopické zobrazování analogových
scintigrafických obrazů jejich digitalizací a
střádáním do paměti počítače. Schéma činnosti
takové gamakamery vybavené akvizičním počítačem je na
obr.4.2.3 :

Obr.4.2.3. Vpravo:
Vznik digitálního scintigrafického obrazu AD-konverzí
analogových souřadnicových impulsů X,Y, jejich střádáním
v obrazové matici paměti počítače a zobrazením na obrazovce
monitoru.
Vlastní scintilační kamera a příslušné
elektronické obvody pro zesilování, komparaci, sumaci a
amplitudovou analýzu impulsů jsou identické jako na obr.4.2.2.
Jen osciloskopická obrazovka v pravé části je zde nahrazena
speciálním obvodem - tzv. analogově digitálním
převodníkem ADC (Analog-to-Digital
Converter) a pamětí počítače.
Vlastní proces konverze je spuštěn trigrovacím
impulsem Z, který oznamuje že byl detekován validní
foton záření g. Amplitudy souřadnicových impulsů X a Y potom
ADC-konvertor převede na digitální (číselnou) informaci -
bitovou kombinaci - a pošle je na odpovídající adresu buňky
v počítači. V paměti počítače je vyčleněna určitá sekvence
buněk pro zápis těchto digitalizovaných impulsů;
tyto buňky jsou softwarově uspořádány do tzv. obrazové
matice - bývá to 64x64, 128x128, 256x256 buněk
(vyjímečně i 512x512 buněk, u kamer s obdélníkovým polem
pak ani obrazová matice není čtvercová). Každá buňka v
obrazové matici topograficky odpovídá
určitému místu v zobrazovaném objektu W. Zorné
pole gamakamery je tak rozděleno mřížkou na malé čtverečky
- pixely (picture element), kterým odpovídají jednotlivé adresy ve vymezené
části paměti akvizičního počítače.
Před začátkem akvizice jsou obsahy všech
buněk vynulované. Přijde-li z ADC-konvertoru digitalizovaný
impuls na některou buňku, její obsah se zvýší o 1.
Tak postupně fotony záření g, převedené na elektrické
impulsy a zdigitalizované, osazují buňky v obrazové matici
paměti počítače, podle místa vyzáření, stále rostoucími
hodnotami jejich obsahu - střádá se digitální
scintigrafický obraz tvořený číselným
obsahem buněk obrazové matice v paměti počítače.
Číselný obsah každé této paměťové buňky (pixelu)
je přímo úměrný radioaktivitě
odpovídajícího místa v organismu, resp. jeho sloupcové
projekce z celé hloubky zobrazované oblasti. Obrazová matice z
paměti počítače je pak elektronicky zobrazována
("mapována") na obrazovku monitoru počítače.
FRAME mode , LIST mode
Shora popsaný způsob kumulativního explicitního záznamu
scintigrafického obrazu do paměti počítače se nazývá frame
mode ("obrazový způsob"). Pro speciální účely (u fázových dynamických
studií a u iterativních metod tomografických - §4.3, část "Počítačová
rekonstrukce SPECT",
"Rekonstrukce obrazů PET", "TOF - časová lokalizace místa
anihilace") se někdy používá i tzv. list mode
("seznamový způsob"), kdy se do paměti sekvenčně nahrává jen seznam
hodnot souřadnic X a Y po sobě následujících
přicházejících impulsů (spolu s
časovými značkami) a vlastní obrazy se
vytvoří dodatečně až po skončení akvizice.
Digitální
scintilační kamery
S rozvojem elektroniky, především konstrukcí rychlých a
miniaturizovaných ADC-konvertorů a mikroprocesorů, se
digitalizace scintigrafického signálu již neomezuje jen na
konverzi analogových souřadnicových impulsů X,Y podle
obr.4.2.3. U současných tzv. digitálních kamer
má již každý fotonásobič na svém výstupu
svůj analogově-digitální konvertor ADC.
Výpočet souřadnic scintilací v krystalu neprobíhá v
analogovém komparátoru, ale v digitálním mikroprocesoru,
který již přímo "osazuje" příslušné adresy v
obrazové matici počítače příslušnou numerickou informací.
Kromě toho je zesílení předzesilovače každého
fotonásobiče přes DAC-převodník řízeno přímo z
počítače, což umožňuje přesnější a operativní kalibraci
kamery - adjustaci (tuning) a nastavení
příslušných korekcí pro homogenitu a linearitu.
Konstrukční uspořádání scintilačních
kamer
Detektor gamakamery
Velkoplošný scintilační krystal gamakamery s přitmelenými
fotonásobiči (jejich počet bývá 19 až
cca 100) a příslušnou elektronikou je
vestavěn ve speciálním robustním pouzdru
(jakémsi "hrnci"), zajišťujícím světlotěsnost
a radiační stínění proti vnějšímu
ionizujícímu záření. Kovové pouzdro též odstiňuje
fotonásobiče proti vnějšímu magnetickému poli. Ve spodní
části pouzdra kamery je mechanismus pro připevnění kolimátoru,
který musí být těsně přiložen ke krystalu. Kolimátory
jsou výměnné, při manuální výměně bývají připevněny
pomocí šroubů, u automatické výměny jsou kolimátory
uchyceny pomocí speciálních motoricky ovládaných držáků.
U SPECT kamer bývají v tomto místě i dotykové senzory
pro mechanickou ochranu pacienta a detektoru při pohybu kamery
vůči pacientovi.
Stojan a gantry pro
upevnění detektorů
Celý detektor kamery je pak namontován na speciálním stojanu
opatřeném elektromotorky pro mechanický pohyb kamery
- posun ve vertikálním, popř. i horizontálním směru a
natáčení detektoru. U tomografických kamer SPECT je stojan
proveden v prstencovém uspořádání jako tzv. gantry,
umožňující pomocí elektromotorku rotaci kamery
kolem vyšetřovaného objektu. Na gantry jsou namontovány
většinou dva detektory, které se mohou úhlově natáčet
kolem osy lehátka - "dvouhlavá" kamera. Další
elektromotorky zajišťují radiální posun
detektorů směrem do centra a od centra, aby bylo možno
nastavit vždy co nejmenší vzdálenost mezi povrchem těla a
čelem kolimátoru.
Vyšetřovací
lehátko
Pod detektorem kamery je umístěno lehátko pro
vyšetřovaného pacienta - kolmo ke stojanu, nebo vjíždí do
gantry. Manuálně nebo motoricky umožňuje horizontální posun
v dostatečně velkém rozsahu (až 2m), aby aby bylo možno projíždět s celým pacientem
pod kamerou nebo skrze gantry a snímat obrazy různých částí
těla. V menším rozsahu (cca 60cm) bývá realizován i vertikální posun. Lehátko by
mělo by být dostatečně robustní (nosnost
min. 180kg) a stabilní, zajišťovat
mechanické polohování s možností aretace. Nosná deska
lehátka bývá u SPECT kamer z materiálu s nízkou absorpcí
gama a RTG záření (při snímání
zepředu i zezadu skrz lehátko). Při
odsunutém lehátku a kolmo natočeném detektoru kamery je
možno scintigrafická vyšetření pacientů provádět i vsedě
či ve stoje.
Pro uskutečnění celotělové
scintigrafie (whole body) je pomocí
elektromotorku lehátko s pacientem pomalu posouváno
v podélném směru, takže jednotlivé části těla pacienta se
postupně dostávají do zorného pole a jsou snímány detektory
kamery; v akvizičním počítači se skládá celotělový
scintigrafický obraz - "klouzavá" celotělová
scintigrafie.
Auto-Body-contouring
Pro dosažení co nejlepšího rozlišení by gamakamera (čelo
kolimátoru) měla být přiložena co nejblíže
povrchu těla pacienta (trigonometrická
analýza je provedena níže v §4.5, část "Prostorové
rozlišení"). Užitečnou opto-elektronickou pomůckou pro
zajištění optimální kvality scintigrafického zobrazení u
celotělových a SPECT vyšetření je tzv. auto-contouring
či body-contouring: při posunu lehátka a
rotaci kamery jsou s použitím elektronických snímačů polohy
detektory kamery na gantry pomocí elektromotorků automaticky
posunovány tak, aby "kopírovaly" tělo pacienta a
čelo kolimátoru bylo stále co nejblíže povrchu těla
pacienta (automatická
"konturace" těla).
Auto-contouring je
realizován pomocí dvou řad infračervených LED diod a
dvou řad protilehlých fotodiod, umístěných
ve dvou lištách nasazených na protilehlé okraje detektorů
kamery. Elektronické obvody regulují radiální polohu
gamakamer tak, aby byly přerušeny infračervené paprsky z
vnější řady, ale nikoli z vnitřní řady (bližší k čelu
kolimátoru). Vzdálenost detektoru je tak neustále udržována
v rozmezí mezi oběma řadami LED<-->fotodiod, cca 10 mm.

Obr.4.2.4. Konstrukční uspořádání scintilační kamery.
Vlevo: Odkrytý detektor
scintilační kamery - kolimátor, krystal, soustava
fotonásobičů a elektronických obvodů.
Vpravo: Ukázka sestavené planární
kamery s jedním detektorem (nahoře) a tomografické
kamery SPECT se dvěma detektory na gantry (dole).
V levé části obr.4.2.4 je rozebraný
detektor menší starší kamery (PhoGamma
Nuclear Chicago, s 19 fotonásobiči),
vyjmutý ze stínícího obalu. Dole vidíme kolimátor, nad ním
je tenký kruhový scintilační krystal, k němuž jsou přes
světlovodné bloky opticky přitmeleny fotonásobiče. V horní
části detektoru je příslušná elektronika, především
předzesilovač pro každý fotonásobič, adjustační obvody, u
digitálních kamer pak i analogově-digitální konvertory a
mikroprocesory pro stanovení souřadnicových impulsů.
Novější scintilační kamery mají větší krystal
obdélníkového tvaru, osazený větším počtem
fotonásobičů.
V pravé části obr.4.2.4 je ukázka dvou instalovaných
kamer. Nahoře je menší planární kamera s jedním detektorem
na jednoduchém stojanu (PhoGamma HP z
r.1973, s vyhodnocovacím zařízením Clincom; vlevo vedle
stojanu kamery je umístěn stojan s výměnnými kolimátory), dole je větší tomografická kamera SPECT (z r.2002) se dvěma dektory
("hlavami") upevněnými na gantry *) a motorickým
posuvem lehátka pro celotělovou scintigrafii.
*) Ojediněle byla používána i jiná
konstrukční uspořádání detektorů scintilačních kamer
(samotné detektory kamer Angerova typu jsou přitom u různých
typů a výrobců řešeny téměř identicky; jiná
alternativní technická řešení jsou zmíněna níže). Místo
klasického kruhového gantry byly detektory upevněny na
speciálních ramenech, jejichž pohyby byly
elektronicky řízeny pomocí servomotorků.
Výhodou zde snad byla větší flexibilita různých poloh
detektorů (včetně možnosti současného nezávislého
snímání dvou pacientů každým detektorem zvlášť). Vedle
"univerzálních" kamer byly někdy používány i
speciální jednoúčelové kamery s pevnou
konfigurací detektorů, např. 3 nebo 4 detektory spojené do
trojúhelníku nebo čtverce, určené pro scintigrafii srdce
(myokardu) nebo mozku. Všechny tyto složitější konstrukční
uspořádání gamakamer se však nakonec neosvědčily
a brzy se přestaly používat...
Elektronické obvody
scintilační kamery byly shora (v části
"Princip
scintilační kamery") popsány jen rámcově a zjednodušeně, spíše z
fyzikálního hlediska. Scintilační kamery jsou vybaveny řadou
dalších elektronických obvodů pro adjustace a pro korekce
fyzikálně-elektronických vlivů. Důležité jsou např.
obvody pro korekci souřadnicových impulsů X,Y
- tvaru a velikosti obrazu, zvláště korekce závislosti
velikosti obrazu na energii detekovaného záření gama -
aby měřítko zobrazení nebylo na této energii závislé.
Scintigrafické
kolimátory
Primárním "optickým členem"
scintilační kamery, kterým jako prvním prochází záření g, je kolimátor
*). Z hlediska gama-zobrazování má kolimátor analogickou
funci jako optický objektiv při fotografování. Jeho
úkolem je provést co nejdokonalejší projekci
distribuce radioaktivity ve vyšetřovaném objektu pomocí
záření g do roviny velkoplošného scintilačního krystalu. Na
vlastnostech kolimátoru proto do značné míry závisí
konečná kvalita scintigrafického obrazu.
Obecně je kolimátor speciální clona ze
stínícího materiálu (většinou olova, někdy wolframu), vymezující
směr fotonů dopadajících na scintilační krystal a
též zorné pole kamery. Nejčastěji je to deska s větším
počtem hustě a rovnoměrně rozmístěných otvorů
- kanálků - určitého tvaru, velikosti a
směru. Bez zeslabení procházejí kolimátorem (a na krystal
dopadají) pouze fotony letící ve směru osy
otvorů kolimátoru, nebo jen s malou odchylkou, tedy téměř kolmo
k čelu kolimátoru a k povrchu krystalu. Ostatní fotony jiných
směrů jsou absorbovány v olověných
přepážkách (septech) mezi otvory, na krystal
nedopadají a nejsou detekovány.
*) Z obecného hlediska radiační fyziky a
detekce záření bylo o kolimátorech pojednáno v §2.1 "Metodika
detekce ionizujícího záření",
odstavec "Stínění, kolimace a filtrace detekovaného
záření" a v §3.1 "Jaderné a radiační
metody", pasáž "Kolimace
ionizujícího záření").
Ve scintigrafii mají kolimátory úlohu zobrazovací.
U pozitronové emisní tomografie se místo mechanických
kolimátorů k zobrazení používá koincidenční elektronická
kolimace - viz níže "Pozitronová emisní
tomografie PET".
Kolimátory u
scintilačních kamer jsou většinou výměnné
- je k dispozici několik typů kolimátorů s jednoznačně
definovanými vlastnostmi, podle kterých se řídí jejich
použití. Kolimátory se rozlišují podle počtu, velikosti a
konfigurace otvorů, podle energie záření g pro niž jsou
optimalizovány, podle rozlišovací schopnosti a citlivosti
(účinnosti detekce). Zobrazovací vlastnosti kolimátorů jsou
podrobněji rozebírány v §4.5 "Fyzikální
parametry scintigrafie".
Zde si uvedeme stručný přehled základních
typů kolimátorů - obr.4.2.6. Nejdříve se budeme zabývat
kolimátory s paralelními otvory - kanálky -
kolmými ke scintilačnímu krystalu kamery, které jsou zdaleka
nejčastěji používaným typem - zde obraz objektu vytvářený
v detektoru má stejnou velikost 1:1 jako zobrazovaný
objekt, nezávisle na vzdálenosti zdroje od kolimátoru (na této vzdálenosti však výrazně závisí prostorová
rozlišovací schopnost zobrazení, viz níže).

Obr.4.2.6. Vlevo: Zkladní druhy
kolimátorů scintilačních kamer (krystal gamakamery je v
pozici nahoře, těsně nad kolimátorem). Vpravo:
Ukázka robustního kolimátoru pro vysoké energie HE a
subtilního kolimátoru pro nízké energie LE HR (a UHR).
Kolimátory
podle energie
Tím nejzákladnějším kritériem, podle něhož se kolimátory
rozdělují, je energie záření g
pro jejíž scintigrafické zobrazení jsou kolimátory
optimalizovány. Podle této energie gama záření mají
kolimátory různou tloušťku přepážek mezi
otvory *), dostatečnou k absorbování záření dané energie.
*) Tloušťka
přepážek
Při optimalizaci konstrukce kolimátoru pro
požadovanou energii fotonů gama se vychází z požadavku, aby
záření gama procházelo pouze otvory, zatímco v
přepážkách (septech) mezi nimi bylo účinně absobováno.
Pokud by záření gama ve větší míře pronikalo i
přepážkami, degradovalo by to zobrazovací vlastnosti
kolimátoru, především kontrast zobrazení (je diskutováno v §4.5, pasáži "Prozařováni
septy kolimátoru",
obr.4.5.3). Pro úplné pohlcení fotonů
gama by byla potřeba velká tloušťka přepážek, což by
vedlo k velmi nízké detekční účinnosti. Jako postačující
kritérium pro dosažení rozumé úrovně prozařování septy,
bez významnějšího zhoršení kontrastu obrazu, se bere prozařování
5%. Podle trigonometrické analýzy na obr.4.5.3b v
pasáži "Prozařováni
septy kolimátoru" to vede k podmínce pro transmisní faktor e-m.s.L/(2d+s)<0,05,
kde d je průměr otvorů, L jejich délka, s tloušťka přepážek a m je lineární
absorpční koeficient materiálu kolimátoru (olova) pro
požadovanou energii gama. To dává omezení pro tloušťku
přepážek kolimátoru s > (6.d/m)/[L-(3/m)]. Optimální je co nejmenší
tloušťka přepážek, jakou dovoluje prozařování -
aby septa zastiňovaly co nejmenší plochu detektoru a účinnost
(světelnost) kolimátoru byla co nejlepší.
Absorpční koeficient materiálu kolimátoru
(olova) silně závisí na energii gama, na
níž tedy závisí potřebná tloušťka
přepážek. Pro nízké energie kolem 150keV, kde pro olovo je m » 21,4cm-1, např. u
kolimátoru s otvory průměru 2mm a délky 25mm vychází
potřebná tloušťka přepážek s»0,3mm (tenká olověná fólie). Pro
vyšší energie kolem 400keV, kde je m » 2,5cm-1, jsou potřebné podstatně tlustší
přepážky s»4,5mm.
Podle energie gama máme 4
základní typy kolimátorů (obr.4.2.6 vlevo) :
V poslední době byl ještě zkonstruován :
Vhodná volba kolimátoru podle energie
emitovaného záření gama má zásadní vliv na kvalitu
scintigrafického obrazu. Pro nízké energie, jako je 140keV 99mTc, použijeme
kolimátory Low Energy, které poskytují nejlepší
rozlišení. Pokud bychom zde použili robustní kolimátor HE
pro vysoké energie, dostali bychom zobrazení s horším
rozlišením a nižší detekční účinností, na němž by
kromě toho byly rušivě vidět olověná septa mezi otvory
kolimátoru *). Můžeme též použít kolimátor Pinhole
(viz níže "Kolimátory se
speciální geometrií"), který
poskytuje kvalitní zobrazení, ovšem s nižší detekční
účinností. Pro vyšší energie, jako je 364 keV 131I, jsou kolimátory Low
Energy naprosto nepoužitelné, výrazné prozařování
mezi septy zcela degraduje obraz do beztvaré
"mazanice" (je diskutováno v
§4.5, pasáži "Prozařováni septy
kolimátoru"). Bezpodmínečně zde musíme použít kolimátor High
Energy (na obraze jsou pak též
vidět otvory a přepážky kolimátoru)
nebo Pinhole. Pinhole je jediný typ kolimátoru, který
je v širokém rozmezí nezávislý na energii.
*) Tuto rušivou strukturu otvorů a sept kolimátoru HE lze
potlačit silnějším vyhlazením obrazu (cca 4x S9), za cenu horšího rozlišení - obrázky vpravo.

Scintigrafické obrazy fantomu štítné žlázy, naplněného 99mTc (nahoře)
a 131I (dole),
zobrazené pomocí kolimátorů Pinhole, Low Energy
HR a High Energy HE. Rušivé zobrazení otvorů a
sept kolimátoru HE lze potlačit silnějším vyhlazením
(filtrací) obrazu - obrázky vpravo.
Kolimátory podle
rozlišení a citlivosti
Dalším kritériem rozdělení kolimátorů je jejich
požadované rozlišení a citlivost
(účinnost - "světelnost"). Toto se ovšem týká jen
kolimátorů pro nízké energie LE;
u robustních kolimátorů pro vysoké a střední energie
nemůžeme vzhledem k tlustým přepážkám mezi otvory (a tím pádem i malé hustotě otvorů) dosáhnout ani dobrého rozlišení, ani vysoké
citlivosti. Podle rozlišení a citlivosti se tedy
nízkoenergetické kolimátory dále rozdělují na :
Počet otvorů
kolimátorů
závisí na typu kolimátoru a jeho velikosti (ploše) zorného
pole kamery. U nynějších planárních/SPECT kamer má zorné
pole velikost kolem 55 x 45
cm. Celkový počet otvorů pro základní typy
kolimátorů pak činí přibližně :
HE - 8000 otvorů ; ME - 15 000
otvorů ; LEAP - 80 000 otvorů ; LE HR(UHR) - 140
000 otvorů.
Otvory mají většinou hexagonální tvar.
Prostorová rozlišovací
schopnost gamakamery
Prostorová rozlišovací schopnost kamery je určena dvěma
složkami: vnitřním rozlišením detektoru a rozlišením
kolimátoru (podrobnější rozbor je
v §4.5, část "Prostorové rozlišení"). Rozlišovací schopnost kolimátoru
je dána průměrem otvorů a jejich délkou.
Kolimátory HR s úzkými a dlouhými otvory (délka otvorů je dána tloušťkou kolimátoru) mají lepší rozlišení než tenší kolimátory HS s
většími a kratšími otvory. Prostorová rozlišovací
schopnost gamakamery výrazně závisí na vzdálenosti
zobrazované struktury od čela kolimátoru. Z každého otvoru
paralelního kolimátoru si můžeme nakreslit pomyslný kužel
vymezující oblast, ze které záření gama může projít
tímto otvorem do detektoru kamery (záření
z míst mimo tento kužel je pohlceno olověnými septy
kolimátoru). Se vzdáleností od
kolimátoru se tento detekční kužel rozšiřuje,
čímž se výrazně zhoršuje geometrické
prostorové rozlišení obrazu, promítaného kolimátorem na
scintilační krystal gamakamery (trigonometrická
analýza je provedena níže v §4.5, část "Prostorové
rozlišení", zde pro
názornost odtud uvádíme jen základní obr.4.5.2 :).

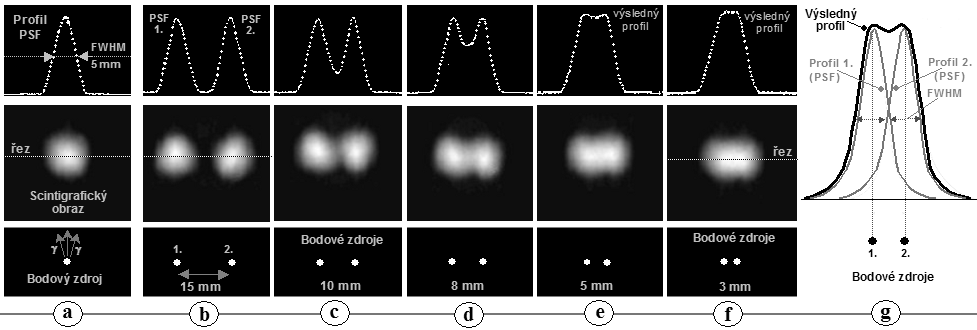
Obr.4.5.2. Zhoršování polohové rozlišovací
schopnosti gamakamery s rostoucí vzdáleností h od čela
kolimátoru. Obraz bodového zdroje se s rostoucí vzdáleností
stále víc "rozmazává", PSF se rozšiřuje a
prostorová rozlišovací schopnost FWHM se zhoršuje - obr.d). Zhoršování prostorového rozlišení je doprovázeno
snižování jasu obrazu, avšak celkový počet impulsů je ve
všech obrazech stejný a plocha (integrál) pod funkcí PSF je rovněž stejná pro všechny
vzdálenosti.
Gamakamera (čelo
kolimátoru) by proto měla být
přiložena co nejblíže povrchu těla
pacienta. U kolimátorů s jiným uspořádáním otvorů (viz níže) je geometrická
situace složitější, avšak v zásadě platí stejné pravidlo
zhoršování prostorového rozlišení pro větší
vzdálenosti od čela kolimátoru.
Detekční účinnost
scintilační kamery
Detekční účinnost (citlivost) kamery je dána účinností
(světelností) kolimátoru a vnitřní detekční
účinností detektoru (podrobněji je rozebíráno v §4.5, část "Detekční účinnost
(citlivost) gamakamery"). Účinnost (prostupnost, světelnost) kolimátoru
je dána průměrem otvorů a jejich délkou,
ale v obráceném poměru než u rozlišení. Čím jsou otvory
větší a kratší, tím vyšší je detekční účinnost.
Účinnost či světelnost kolimátorů je obecně velmi
malá - kolem 1-2%.
Je zajímavé, že u gamakamer při použití paralelních
kolimátorů detekční účinnost (citlivost) nezávisí
na vzdálenosti h zobrazovaného zdroje od čela
kolimátoru! Zobrazení bodového zdroje v širokém rozmezí
vzdáleností 0-30cm od čela kolimátoru na obr.4.5.2 d) sice
ukazuje zhoršování prostorového rozlišení a snižování
jasu obrazu, avšak celkový počet impulsů je ve všech
obrazech stejný, plocha (integrál) pod funkcí PSF je stejná pro všechny vzdálenosti. Toto
překvapivé chování je způsobeno specifickými
vlastnostmi geometrické kolimace u paralelních
kolimátorů. Názorně si to můžeme představit podle
schématického nákresu na obr.4.5.2 b) takto: Se vzdalováním
zdroje od čela kolimátoru počet fotonů dopadajících na
jednotlivé otvory klesá kvadraticky jako 1/h2. Avšak počet
otvorů, kterými záření může projít k detektoru, se
kvadraticky zvyšuje úměrně h2. Tyto dva
protichůdné trendy se vzájemně ruší,
takže celkový procházející tok fotonů - účinnost
kolimátoru - se nemění se vzdáleností
mezi zdrojem a kolimátorem.
Pozn.: U
speciálních kolimátorů konvergentních či Pinhole
tato zákonitost neplatí, detekční účinnost se
výrazně mění se vzdáleností - roste nebo klesá
(viz §4.5, pasáž "Zobrazovací vlastnosti speciálních
kolimátorů").
Tato nezávislost citlivosti na vzdálenosti u
paralelních kolimátorů však platí jen za situace bez
látkového absorbujícího prostředí - ve vakuu či ve
vzduchu. Při praktické scintigrafii se ale mezi
zobrazovanými strukturami s distribuovanou radioaktivitou v
organismu a gamakamerou nachází tkáňové prostředí,
s nímž gama záření interaguje, což vede k absorpci
a zeslabení gama záření. Toto zeslabení
záření gama absorbcí, nazývané též atenuace,
se na scintigrafických obrazech projevuje arteficielním
snížením počtu impulsů ze struktur uložených ve
větších hloubkách, ve srovnání se strukturami blíže
povrchu. V takovém případě již neplatí
tvrzení, že detekční účinnost (citlivost) nezávisí na
vzdálenosti zobrazovaného zdroje od čela kolimátoru.
Detekční účinnost se zde se vzdáleností - hloubkou -
zobrazovaného zdroje výrazně snižuje!
Kolimátory se speciální
geometrií
Kromě kolimátorů s paralelními otvory - kanálky - se pro
některé speciální účely používají i kolimátory s jinak
geometricky uspořádanámi otvory (obr.4.2.6. uprostřed) :
Zobrazovací vlastnosti kolimátorů jsou
podrobněji rozebírány v §4.5 "Fyzikální
parametry scintigrafie".
Zde si pro přehlednost duplicitně uvedeme jen grafy závislosti
prostorového rozlišení a detekční účinnosti (citlivosti)
gamakamery se základními kolimátory na vzdálenosti :
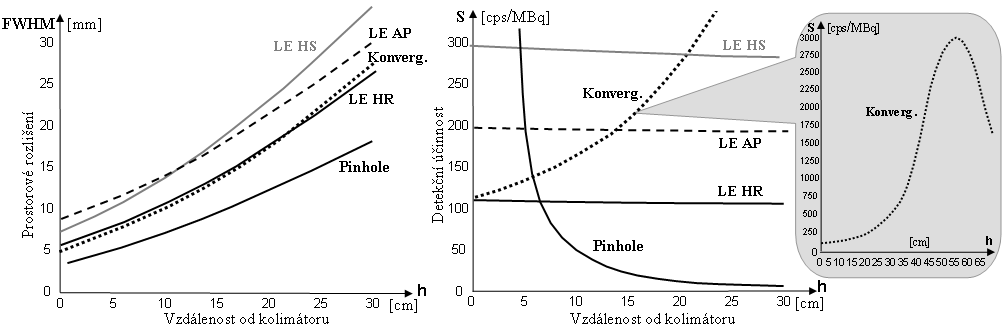
Obr.4.5.6. Závislosti prostorového rozlišení FWHM (vlevo)
a detekční účinnosti S (vpravo)
gamakamery na vzdálenosti zdroje od čela různých druhů
kolimátorů..
Zobrazovací vlastnosti
nejdůležitějších typů kolimátorů s různým geometrickým
uspořádáním otvorů jsme testovali pomocí lineární
pravoúhlé mřížky (její
konstrukce je popsána v práci "Fantomy a
fantomová měření v nukleární medicíně", obrázek "Mřížka")
:

U kolimátoru s paralelními otvory (jako je LE
HR, vlevo) dostáváme všude lineární
zobrazení mřížky, přičemž pro větší vzdálenosti od
čela kolimátoru se zhoršuje prostorové rozlišení
(rozmazaná mřížka). U konvergentního
kolimátoru (jako je SmartZoom s konvergentní středovou
částí) se s rostoucí vzdáleností obraz středové části zvětšuje.
U kolimátoru Fan Beam (který je konvergentní
v transverzálním směru, v axiálním směru je paralelní) se
s rostoucí vzdáleností oka mřížky zvětšují jen v
transverzálním směru, v axiálním zůstávají
stejné. Nejvýraznejší závislost na předmětové
vzdálenosti vykazuje kolimátor Pinhole:
těsně u čela dostáváme obraz mnohonásobně zvětšený,
s rostoucí vzdáleností se zoom zmenšuje a pro vzdálenosti
nad cca 20cm je obraz již zmenšený. Z
obrázků je dále vidět obecný trend zhoršování
rozlišovací schopnosti (a tím i kontrastu v obraze) se
vzdáleností od čela kolimátoru.
Scintigrafické obrazy
a jejich hodnocení
Celý proces scintigrafické diagnostiky je schématicky
znázorněn na obr.4.2.5. Po aplikaci radioindikátoru
dochází k jeho distribuci v určitých
částech organismu (vychytávání v
cílových tkáních a orgánech, nebo průtok radioindikátoru
cévami a srdečními dutinami), tuto
distribuci pomocí zevní detekce vycházejícího záření g zobrazujeme
scintilační kamerou, v počítači vznikají digitální scintigrafické
obrazy, které jednak hodnotíme vizuálně,
jednak můžeme pomocí křivek matematicky analyzovat
vyšetřované procesy a počítat kvantitativní
parametry funkce jednotlivých orgánů. Nakonec
nastupuje interpretace všech těchto dílčích
údajů a výsledků, která spolu s s výsledky dalších metod
vyústí ve vyslovení diagnózy v závěrečném
protokolu.

Obr.4.2.5. Schématické
znázornění celého procesu scintigrafického vyšetření - od
aplikace radioindikátoru pacientovi a jeho vychytávání v
cílových tkáních a orgánech, přes proces scintigrafického
zobrazení gamakamerou, vizuální hodnocení obrazů,
matematickou analýzu a kvantifikaci, až po interpretaci a
stanovení diagnózy.
Metodikou matematické analýzy a počítačového vyhodnocování scintigrafických studií se budeme podrobněji zabývat níže v kapitole 4.7 "Matematická analýza a počítačové vyhodnocování v nukleární medicíně".
Nepříznivé
vlivy u scintigrafie a jejich korekce
U scintigrafie se vyskytují některé nepříznivé
a rušivé jevy, které mohou zhoršovat kvalitu
zobrazení a vést tak v krajním případě dokonce k nesprávné
interpretaci scintigrafických vyšetření ve smyslu falešně
negativních či falešně pozitivních
nálezů. Uvedeme zde šest základních nepříznivých vlivů,
které se projevují obecně u každé scintigrafie,
tj. u planární scintigrafie i u tomografické scintigrafie
SPECT. Další nepříznivé a rušivé jevy, specifické pro
SPECT (jako je nestabilita osy rotace či artrefakty vzniklé
při rekonstrukci) a PET (náhodné falešné koincidence) budou
zmíněny níže v §4.3.
 |
| Obr.4.2.7.
Objemové a aktivitní zkreslení na obrazech
lézí různé velikosti (vlevo) a měrné
aktivity (vpravo). Vlevo: Obrazy zdrojů o stejné měrné aktivitě, ale různé velikosti, se jeví různě jasné. Vpravo: Obrazy zdrojů stejné velikosti, ale různé měrné aktivity, se jeví různě velké. (měřeno na kameře PhoGammaLFOV, FWHM=6mm) |
Tyto nežádoucí efekty
se výrazně projevují u malých lézí,
menších než 2.FWHM (dvojnásobek rozlišení),
zatímco u lézí větších než cca 3-4.FWHM jsou
prakticky zanedbatelné (projevují se pouze na okrajích
obrazu lézí). Zvláště negativně se jev uplatňuje u
malých negativních lézí - malých
okrsků snížené koncentrace radioindikátoru na
pozadí vyšší koncentrace radioaktivity. Zde efekt
prozařování z okolí dovnitř obrazu léze může
zcela zahladit viditelnost takové malé
léze, která zaniká ve statistických fluktuacích;
říkáme, že taková léze není detekovatelná
(viz níže "Kvalita scintigrafického obrazu -
detekovatelnost lézí",
obr.4.2.9).
Celkově lze říci, že vlivem
"rozmazání" obrazu u pozitivních
("horkých") lézí dochází k poklesu
pozorované aktivity (počtu impulsů v obraze), u
negativních ("studených") lézí zase k
jejímu nárustu. Společným výsledkem
je snížení kontrastu obrazu (viz též níže "Kvalita
scintigrafického obrazu - detekovatelnost lézí").
Korekce
aktivitního zkreslení
Byly vypracovány metody korekce tohoto zkreslení
zobrazení aktivity - tzv. Partial Volume Correction
(PVC), které je žádoucí používat při
kvantitativní analýze obrazů, jako je stanovení SUV
(viz níže "Kvalita scintigrafického
obrazu - detekovatelnost lézí").
Teoreticky by se daly použít rekonstrukční algoritmy
na základě znalosti odezvové funkce bodového zdroje
PSF (point spread function) - výše zmíněná metoda resolution
recovery, ta však při vyšších
statistických fluktuacích selhává. V praxi se někdy
používá prostého násobení korekčními
koeficienty, které udávají poměr skutečné
objemové aktivity léze ke zdánlivé aktivitě v
obraze. Tyto koeficienty jsou výrazně závislé na
velikosti zobrazovaného objektu a na prostorové
rozlišovací schopnosti scintigrafického zobrazení;
jejich konkrétní hodnoty se stanovují na základě fantomových
měření. V literatuře jsou tabelovány nebo
graficky vynášeny hodnoty inverzních korekčních
koeficientů, tzv. obnovovacích koeficientů
RC (recovery coefficient)
v závislosti na průměru kulové léze pro různé
hodnoty rozlišení FWHM. Pro správné použití této
metody korekce je třeba znát skutečnou
velikost zobrazované léze, což je prakticky
dostupné pouze u hybridních systémů, kombinujících
scintigrafii s anatomickým CT zobrazením (viz níže
§4.3 "Tomografické kamery", pasáž "Fúze obrazů, hybridní
tomografické systémy").
Pro malé léze velikosti cca 1cm při rozlišení FWHM @ 8mm činí
korekční koeficient 1/RC@5, pro menší léze
nebo horší rozlišení (jaké bývá ve větších
hloubkách pravidlem) je jeho hodnota ještě mnohem
vyšší. Vede to k velké chybě korekce,
která je při hodnotách korekčního koeficientu
blížících se ~10 již prakticky nepoužitelná.
Nepoužitelná je samozřejmě i výše zmíněná metoda
resolution recovery.
Pokud je velikost
zobrazované léze menší než prostorové rozlišení
kamery, projeví se rozdíly v objemu této struktury
pouze v počtu nastřádaných impulsů v pixelech
daného místa obrazu (jas či intenzita zobrazené
léze). Tohoto efektu se někdy využívá pro posouzení
změn tloušťky srdeční stěny u SPECT myokardu.
Pozn.: Efekt objemového
(velikostního) a intenzitního zkreslení se projevuje
nejen u scintigrafie - nastává všude tam, kde
zobrazení vykazuje konvoluční rozmazání.
A to je, ve větší či menší míře, prakticky u
všech zobrazovacích metod...

Obr.4.2.8. Vliv registrovaného počtu fotonů na kvalitu obrazu
z hlediska statistických fluktuací (šumu)- kvalita snímků se
zlepšuje s rostoucím počtem fotonů.
Nahoře: Fotografický portrét
exponovaný s různým počtem fotonů světla (počítačové zpracování obrázků provedl
Ing.J.Juryšek).
Dole: Gamagrafický obraz fantomu (Jasczak, naplněný radionuklidem 99mTc) nastřádaný scintilační kamerou s různým počtem
fotonů g v obraze.
 |
| Comptonovsky rozptýlené záření při scintigrafii |
Pokud dojde shodou
okolností k rozptylu fotonu v tkáni pod takovým
úhlem, že tento rozptýlený foton projde otvorem
kolimátoru a je detekován krystalem kamery (na obrázku a), může pak docházet k detekci těchto fotonů
záření g´ z falešného místa - je
detekován foton gama zdánlivě přicházející z
jiného místa, než odkud byl původně vyzářen při
radioaktivní přeměně (k
podobnému efektu "falešné lokalizace" může
dojít i při Comptonově rozptylu záření g v
materiálu samotného scintilačního krystalu). Tyto náhodně přicházející rozptýlené
fotony g´ by arteficielně snižovaly kontrast
scintigrafického obrazu. Naštěstí však tyto
falešné rozptýlené fotony g´ mají nižší
energii než "pravé" přímé a
primárně detekované fotony g (část energie byla při rozptylu v látce
předána elektronu e-), takže většinou
nepadnou do fotopíku (na obrázku b). Pečlivým nastavením okénka
analyzátoru na fotopík daného záření g můžeme
proto comptonovsky rozptýlené záření g´ do
značné míry eliminovat.
Účinnější potlačení compton. rozptýleného
záření lze dosáhnout užším okénkem,
příp. jeho mírně asymetrickým nastavením směrem k
vyšší energii - ovšem za cenu snížení detekční
účinnosti (eliminace i části
primárních fotonů) a rizika
mírného zhoršení homogenity zorného pole kamery (v úzkém a asymetrickém okénku nenusí být
sladění odezvy jednotlivých fotonásobičů tak
dokonalé).
Korekce na
rozptyl g - Scatter correction
Určitá malá část Comptonovsky rozptýlených fotonů
(rozptýlených pod malým úhlem) však přesto zasahuje
energeticky i do oblasti fotopíku a může být
detekována. Některé typy scintilačních kamer
používají speciální elektronické procedury pro korekci
či eliminaci těchto zbylých
rozptýlených fotonů. Impulsy pro každý
pixel obrazu se registrují ve dvou či třech
energetických oknech (DEW - Dual
Energy Window, TEW - Three Energy Window; místo slova
"Energy" se někdy používá
"Photopeak" a zkratky se píší DPW či TPW): 1. okno těsně před fotopíkem (s vysokým
zastoupením rozptýleného záření), 2. hlavní
centrální okno fotopíku, 3. okno těsně za
fotopíkem. Pro tato energetická okénka vznikají tři
odpovídající obrazy. Interpolací počtů impulsů
registrovaných v pomocných oknech před a za fotopíkem
se pro každý pixel stanoví frakce rozptýlených
fotonů odpovídající hlavnímu okénku fotopíku
- vznikne "rozptylový obraz",
který se odečítá od hlavního obrazu v základním
okénku.
Byly zkoušeny i
komplikovanější metody korekce rozptylu s větším
počtem okének analyzátoru, či s různými
korekčními maticemi homogenity pro různá okénka;
při podstatně větší složitosti však výsledky
nebyly prokazatelně lepší než u základní TEW
metody. Pro tomografickou scintigrafii SPECT jsou
vyvíjeny algoritmy pro získání (modelování) 2D či
3D distribuce rozptylu, s implementací do
rekonstrukčních procedur typu MLEM, OSSEM (níže §4.3
"Tomografická scintigrafie"...., oddíl "Počítačová
rekonstrukce SPECT",
pasáž "Iterativní rekonstrukce").
Autorská
poznámka - zkušenosti s korekcí
na rozptyl :
Na našem pracovišti jsme výše uvedené metody korekce
na rozptyl gama záření zkoušeli pomocí fantomových
měření. S fantomem bodových zdrojů 99mTc,
umístěných v rozptylujícím vodním prostředí, jsme
pořizovali scintigrafické obrazy s různým nastavením
okénka analyzátoru - centrálním na fotopík a různě
posunutým dolů a nahoru. Takto získané obrazy před a
za fotopíkem jsme pak interpolovali a odečítali je od
obrazů s centrálním okénkem. Výsledný efekt byl prakticky
neodlišitelný od prostého nastavení vhodné
modulace jasu a kontrastu (úrovní LT a UT) v zobrazení
nekorigované obrazové matice. K metodán korekce na
rozptyl jsme proto na našem pracovišti nukleární
medicíny poměrně skeptičtí...
Dalším zdrojem falešných impulsů
může být tzv. pile-up efekt
kumulativní elektrické odezvy dvou kvant g,
detekovaných téměř současně (viz §2.4, část
"Scintilační
spektra radionuklidů").
To se projevuje u vysokých četností (toků) fotonů g. Ve
většině případů padnou tyto impulsy mimo fotopík a
nejsou detekovány. Pokud však dojde k pile-up efektu u
dvou současných Comptonovsky rozptýlených fotonů,
výsledný impuls může svou amplitudou padnout do
fotopíku - je detekován a může přispívat k
degradaci kontrastu scintigrafického obrazu.
Fyzikální
parametry scintigrafie
Rozlišení, detekční účinnost, homogenita a další
parametry scintilační kamery jsou definovány a rozebírány
níže v §4.5 "Fyzikální parametry
scintigrafie - kvalita zobrazení a fantomová měření". O způsobech jejich měření a testování je
pojednáno v práci "Fantomy a
fantomová měření v nukleární medicíně".
Chyby a úskalí
korekčních metod - korekční artefakty
Je třeba si uvědomit, že žádné korekční metody nejsou
"samospasitelné", ale mohou mít svá úskalí. Chyby
korekčních metod můžeme rozdělit do dvou kategorií:
Podkorigování, překorigování a korekční artefakty mohou vést k podobnému zhoršení kvality (či dokonce k riziku nesprávné interpretace) scintigrafických studií, jako je tomu u nekorigovaných studií. Zkušenost ukazuje, že pro správnou interpretaci nálezů je třeba pečlivě porovnávat obrazy bez korekce a obrazy s korekcí "cvičeným okem" erudovaného odborníka, který musí vzít v úvahu i konkrétní anatomické a poziční okolnosti u daného pacienta.
Kvalita
scintigrafického obrazu - rozpoznatelnost lézí
Výše uvedené nepříznivé vlivy způsobují, že
scintigrafický obraz není zdaleka věrný a dokonalý - přes
užitečnou informaci se překrývají rušivé statistické
fluktuace (šumy), obraz je neostrý a
často málo kontrastní. Tato nedokonalá
kvalita vede k tomu, že některé subtilnější struktury
vyšetřovaného předmětu nejsou na scintigrafickém obrazu
viditelné - říkáme, že takové léze nejsou
detekovatelné. V diagnostické praxi nukleární
medicíny je optimální takový scintigrafický
obraz, který kromě objektivně měřitelných fyzikálních
parametrů vyhovuje i lidskému subjektivnímu zrakovému
vnímání hodnotícího lékaře. Jaké parametry
vyšetřovaného objektu a jeho obrazu tedy rozhodují o objektivním
zobrazení a co nejlepší rozpoznatelnosti
lézí?
Základní zákonitosti vyplývají z vlastností
scintigrafického zobrazení a ze statistické analýzy
výsledných obrazových dat. V levé části obr.4.2.9 je
znázorněno scintigrafické zobrazení jednoduché struktury
(léze) kruhového tvaru velikosti (průměru) d
a měrné aktivity A, obklopené
homogenním prostředím - pozadím - o měrné aktivitě B.
Výraznost léze vůči pozadí můžeme charakterizovat jako kontrast
objektu Cobj = (A-B)/B (příp. ´100[%]). Scintigrafickým zobrazením vznikne obraz, na němž
je léze zobrazena jako struktura A* a pozadí jako konstantní (více či drobně zvlněná)
plocha B* (v závislosti na statistických
fluktuacích).

Obr.4.2.9. Analýza kontrastu a statistických fluktuací
scintigrafického zobrazení lézí (fantomová
měření na kameře PhoGamma LFOV).
Srovnáme-li originální objekt s jeho
scintigrafickým obrazem, vidíme dva hlavní rozdíly:
¨ 1. Rozmazání a snížení kontrastu
Vlivem nedokonalého prostorového rozlišení se ostré kontury
původního objektu A rozostřily a
snížil se rozdíl mezi maximem v obraze A* a pozadím B* - kontrast
obrazu Cimg = (A*max-B*)/B* je nižší
než kontrast objektu Cobj: Cimg<Cobj. Za předpokladu léze kruhového tvaru a Gaussovského
konvolučního rozmazání (odezvová
funkce bodového zdroje PSF kamery má tvar Gaussovy křivky s
pološířkou FWHM) je vztah mezi
kontrastem předmětu a obrazu dán exponenciálním výrazem:
Cimg = Cobj . e-(FWHM/d)2 ,
kde FWHM je rozlišení kamery a d je velikost (průměr)
léze. Pro velké léze (d>4.FWHM) se kontrast zobrazením
téměř nezmění (Cimg @Cobj). U lézí malých
rozměrů, srovnatelných nebo menších než rozlišení FWHM
kamery, je však degradace kontrastu velmi výrazná, Cimg «Cobj (při typickém rozlišení kamery 10mm
se kontrast léze velikosti 1cm sníží téměř 3-krát, u
léze 5mm více než 30-krát!).
¨ 2. Statistické fluktuace - šum
Vlivem kvantových stochastických zákonitostí radioaktivního
rozpadu, emise a detekce kvant záření g, vykazují všechny části
scintigrafického obrazu statistické fluktuace
- přes obraz objektu je překryt šum. Jak bylo
ukázáno v §2.11 "Statistické fluktuace a chyby měření", je velikost tohoto šumu v každém bodě obrazu
dána druhou odmocninou z průměrného nastřádaného počtu
impulsů n: s = ±Ö(n). Relativní statistické fluktuace s/n = 1/Ö(n) jsou tím nižší,
čím vyšší je počet impulsů nastřádaný v jednotlivých
buňkách obrazu. Konstantní pozadí B je tedy zobrazeno
jako plocha, jejíž body kolísají zhruba mezi B*±Ö(B*), tj. sB = ±Ö(B*). Podobně statisticky kolísají hodnoty bodů v
obraze A*. Pokud jsou tyto fluktuace příliš vysoké,
srovnatelné s průměrnými hodnotami rozdílu mezi A* a B*,
mohou se v nich tyto rozdíly snadno "ztratit" a
příslušná struktura nebude na obraze patrná. Rušivé
statistické fluktuace jsou tak principiálním
limitujícím faktorem rozpoznatelnosti *) malých a ne
příliš kontrastních lézí na scintigrafickém obrazu.
*) Nebýt statistických fluktuací, bylo
by možno umělým zvýšením strmosti
(kontrastu) zobrazení scintigrafického obrazu na displeji
dosáhnout zviditelnění i malých a málo kontrastních lézí.
A navíc by bylo možno vhodnou dekonvoluční filtrací
(s použitím inverzní modulační přenosové funkce MTF)
provést korekci na rozlišení kamery, resolution
recovery - počítačové "zaostření" obrazu
- a na obraze zrekonstruovat všechny detaily ze zobrazovaného
objektu (viz "Filtry
a filtrace", část
"Pásmové fokusační filtry").
Statistické fluktuace nás v praxi většiny těchto možností
bohužel zbavují...
Ze statistické analýzy obrazových dat plyne,
že rozpoznat (a statisticky prokázat) můžeme
v obraze jen takovou strukturu (lézi), jejíž kontrast Cimg splňuje podmínku
Cimg > 4/Ö(B*) .
Je to podmínka statistické významnosti
rozdílu A*-B* informace v obraze léze vůči okolnímu
fluktuujícímu pozadí B*.
Signál
- šum
V analogii s analýzou elektrických signálů ve slaboproudé
elektronice se i pro kvantitativní popis vlastností obrazů
zavádějí pojmy:
Signál S
je rozdíl v intenzitě obrazu (jeho
"jasu", počtu nastřádaných impulsů) mezi vyšetřovanou strukturou (lézí) a okolím. V
našem případě je dán rozdílem: S = A*max-B*.
Šum N (Noise)
představují rušivé statistické fluktuace v obraze. Pro náš
případ jsou důležité fluktuace pozadí, takže šum je dán
druhou odmocninou z průměrného nastřádaného počtu impulsů
v obraze pozadí: N = sB = Ö(B*).
Podobně jako kvalita signálu v elektronice, je kvalita
obrazu dána parametrem:
Poměr signál-šum SNR (Signal-Noise Ratio) SNR
= S/N = S/Ö(B*).
Shora uvedenou statistickou podmínku detekovatelnosti léze lze
pak vyjádřit takto: Lézi v obraze je možno vidět jen tehdy,
když poměr jejího signálu k šumu je SNR > 4.
Vezmeme-li v úvahu vliv rozlišení i
statistických fluktuací, spojením shora uvedených vztahů
můžeme základní podmínku rozpoznatelnosti léze
zformulovat takto:
Cobj > 4 . e(FWHM/d)2 /Ö(B*) .
Na obraze bude viditelná pouze taková léze, která bude mít
dostatečný kontrast Cobj (v akumulaci radioaktivity), geometrickou velikost d
dostatečně velkou ve srovnání s rozlišením kamery FWHM a
počet nastřádaných impulsů bude dostatečně velký, aby
relativní statistické fluktuace nebyly příliš vysoké.
Zobrazení léze je tím lepší, čím je tato léze větší,
kontrastnější a čím větší bude hustota nastřádaných
impulsů v obraze. A čím menší je velikost a kontrast léze,
tím vyšší potřebujeme nastřádat počet (hustotu) impulsů
v obraze pro její úspěšné zobrazení. Pro zobrazení těchto
malých a ne příliš kontrastních lézí má též
rozhodující význam co nejlepší rozlišovací schopnost
kamery, aby nedocházelo k enormní degradaci kontrastu léze
při zobrazení.
Pozitivní
a negativní léze
Jedním z rozdílů mezi "studenými" (negativními) a
"horkými" (pozitivními) lézemi spočívá v tom, že
dobře akumulující horké léze mohou mít vysoký kontrast Cobj i mnoho set
procent, zatímco u studených lézí může kontrast dosahovat
maximálně 100%. Proto pozorujeme dobře zobrazené i drobné
(avšak kontrastně akumulující) horké léze, jako jsou
zánětlivá či nádorová ložiska u klasické scintigrafie
skeletu nebo u 18FDG PET. Drobnější studené léze bývají obtížně
pozorovatelné, zvláště když jsou hlouběji uložené
(třebas uvniř jater nebo plic).
Hluboko
uložené léze
Fantomová měření v levé části obr.4.2.9 (podobně jako
měření výše na obr.4.2.7) byla provedena bez
rozptylujícího prostředí (ve vzduchu) a v blízkosti čela
kolimátoru kamery. Simulují idealizovanou situaci povrchových
lézí.
Jestliže je léze uložena ve větší hloubce v tkáni,
uplatňují se další čtyři nepříznivé faktory,
snižující ještě více kontrast zobrazení a zhoršující
detekovatelnost léze:
v Větší
vzdálenost od čela kolimátoru vede k horší rozlišovací
schopnosti (vyššímu FWHM), což podle výše uvedené
exponenciální závislosti snižuje kontrast Cimg v obraze.
v Absorce
záření g z léze při průchodu tkání (atenuace) snižuje
počet užitečných impulsů detekovaných v obraze léze.
v K záření g z léze se může
přičítat záření z ostatních vrstev tkáně. Snižuje se
tím již primárně kontrast objektu Cobj v příslušné planární projekci a tím i kontrast v
obraze. Tento efekt je do značné míry eliminován u
tomografického zobrazení SPECT a PET (viz níže §4.3
"Tomografická scintigrafie").
v Část záření
gama se Comptonovsky rozptyluje v materiálu tkáně. Část
tohoto rozptýleného záření je detekována a rovněž
snižuje kontrast zobrazení léze (jak bylo ukázáno výše na
obr.4.2.8).
V
pravé části obr.4.2.9 je fantomová ukázka zobrazení
pozitivních a negativních lézí, uložených na povrchu a v
různých hloubkách v tkáni (simulované vodou s rozpuštěnou
aktivitou 99mTc). U hluboko uložených lézí se jejich zobrazení
pronikavě zhoršuje, zvláště v případě negativních
("studených") lézí.
Jak
lze zlepšit kvalitu obrazu a detekovatelnost lézí?
O rozpoznatelnosti malých struktur (lézí) při
scintigrafickém zobrazení rozhodují v praxi především
následující faktory:
× Geometrická velikost léze;
× Akumulace radioindikátoru v lézi oproti okolní
tkáni ® kontrast léze;
× Hloubka uložení léze ®
zeslabení záření, interference se zářením z ostatních
vrstev;
× Prostorová rozlišovací schopnost scintigrafického
systému - kontrast v obraze;
× Detekční účinnost (citlivost) + doba akvizice ®
počet nastřádaných impulsů ®
statistické fluktuace.
Velikost a lokalizace léze je dána anatomickou
situací u pacienta, rozlišení a citlivost kamery jsou v
zásadě určeny její konstrukcí, můžeme je však
částečně ovlivnit vhodnou volbou kolimátoru. Jsou pak v
zásadě čtyři možnosti, jak můžeme zlepšit kvalitu obrazu
a zachytitelnost lézí :
l Zvýšit primární kontrast léze
Toho lze v některých případech dosáhnout volbou vhodného
radioindikátoru, který se pokud možno selektivně
vychytává v diagnostikované lézi.
l Zvýšit aplikovanou aktivitu
radioindikátoru, čímž zvýšíme detekovaný počet impulsů
a snížíme relativní statistické fluktuace. To ovšem
naráží na problém zvýšené radiační zátěže
pacienta a při vysokých aktivitách též na mrtvou dobu
detekčního zařízení.
l Prodloužit čas akvizice
obrazu, čímž se úměrně zvýší počet nastřádaných
impulsů v pixelech obrazu a sníží se relativní statistický
šum. Příliš dlouhý akviziční čas však přináší
problémy s pohybem pacienta, který nevydrží
tak dlouho nehybně ležet pod detektorem kamery. U dynamické
scintigrafie toto řešení většinou není použitelné vůbec,
neboť doba akvizice jednotlivých snímků je určena časovou
dynamikou vyšetřovaného procesu.
l Provést vhodnou počítačovou filtraci obrazu,
která může zlepšit jeho kvalitu a napomoci rozpoznání
drobnějších defektů - je podrobněji
rozebíráno v pojednání "Filtry a filtrace
scintigrafických obrazů". Je to především optimalizované vyhlazení
statistických fluktuací (Low-pass filtry - vyhlazovací) a umělé zlepšení
rozlišení - resolution recovery
("Pásmové filtry - fokusační").
Obecně
platí, že léze v tkáni je zobrazena tím snadněji, čím je
větší, kontrastnější a uložena v menší hloubce pod
povrchem těla.
Kvantifikace pozitivních lézí na
gamagrafických obrazech - SUV
Jednou z nejčastějších úloh radionuklidové gamagrafie je
zobrazit akumulaci vhodného radioindikátoru v
lézích (především nádorového charakteru) - a to nejen
rozpoznat ložisko na obraze, ale stanovit i kvantitativní
míru akumulace radioindikátoru v zobrazené tkáni.
Jednoduchým relativním kritériem významnosti
zobrazené léze je shora diskutovaný kontrast obrazu
Cimg = (A*max-B*)/B* mezi aktivitou (nastřádaným počtem impulsů)
v obrazu léze A* a okolním pozadím B*. Pro posuzování
závažnosti tumorů u různých pacientů, jakož i
při sledování časového vývoje velikosti a metabolické
aktivity tumorů u daného pacienta (nejčastěji se jedná o sledování
biologické odezvy nádorové tkáně na terapii), je třeba hodnotit a vzájemně porovnávat
míru akumulace příslušného radiofarmaka na obrazech z
různých nezávislých scintigrafických studií. Pro absolutní
(semi)kvantitativní vyjádření selektivního
vychytávání radioindikátoru v tumoru, ve srovnání
s průměrnou distribucí v ostatním těle, se často používá
tzv. standardizovaná hodnota akumulace SUV (Standardized
Uptake Value). Vyjadřuje poměr lokální akumulované
koncentrace radioindikátoru v lézi k průměrné koncentraci v
celém těle (tj. k aplikované aktivitě
normované na hmotnost pacienta):
SUV = C/(Ainj/M) .
Zde C [kBq/cm3] je tkáňová koncentrace radioaktivity (objemová
aktivita) v lézi, Ainj [MBq] je aplikovaná aktivita, M [kg] je
hmotnost (váha) pacienta. Hodnoty objemové aktivity léze C
a aplikované aktivity Ainj je nutno korigovat ke stejnému času (zvláště při použití krátkodobých radionuklidů
jako je 99m-Tc či 18-F). Koncentraci C
radioaktivity v lézi stanovíme z gamagrafického obrazu s
použitím příslušných přepočítávacích a korekčních
faktorů:
C= h-1.(A*-B*).RC-1.Vtum-1,
kde h
[imp. s-1
MBq-1] je detekční
účinnost (citlivost) kamery, RC je tzv. recovery
koeficient korekce na "partial volum effect"
(zmíněný výše v části "Nepříznivé
vlivy u scintigrafie",
psáž "Efekt částečného objemu"), Vtum [cm3] je objem léze. Pokud tedy naměříme v nějakém
místě obrazu hodnotu SUV=1, je zde objemová
aktivita stejná jako průměrná aktivita v celém těle -
znamená to, že se zde radioindikátor nevychytává.
Čím vyšší hodnotu SUV>1 dostaneme, tím selektivněji
se daný radioindikátor v daném místě akumuluje, tím vyšší
je metabolická aktivita příslušné tkáně.
Používá se buď SUVmax
počítané z hodnoty A*max nejintenzívnějšího pixelu v obrazu léze, nebo SUVmean
(SUV50%)
stanovované z průměrné hodnoty v pixelech uvnitř zájmové
oblasti (ROI) léze, někdy i SUV70% a pod. Pokud je mimo vyšetřovanou lézi jinak
přibližně homogenní distribuce radioindikátoru, je SUVmax přibližně rovno
hodnotě kontrastu Cimg a i ostatní hodnoty SUV50 či SUV70 lze stanovovat jednoduše jako poměr počtu impulsů v
tumoru (resp. jeho vymezené části - ROI) a v tkáňovém
pozadí ("tumour to background ratio"). Je
však žádoucí provést korekci na partial volume effect
pomocí recovery koeficientů RC (jak
bylo výše zmíněno).
Analýza SUV se provádí především na PET
obrazech 18FDG
a dalších radiofarmak s tumorovou akumulací - viz též §3.6,
část "Diagnostika nádorových onemocnění". Pro středně akumulující tumorové léze se
hodnoty SUV pohybují v rozmezí zhruba 2¸5, pro dobře a selektivně
akumulující ložiska pak může být i SUV>10.
Pozn.:
Kvantifikace SUV se u planární a SPECT
scintigrafie provádí jen zcela vyjímečně.
SUV je doménou především nádorové PET scintigrafie
(viz níže §4.3, část "Pozitronová emisní tomografie PET"), kde se používá především pro kvantifikaci
akumulace 18F-FDG. Zde problematiku SUV rozebíráme z obecného
hlediska, v souvislosti se společnými vlastnostmi
scintigrafických obrazů a informacemi v nich obsažených.
Nevýhody a úskalí
kvantifikace SUV
Stanovení SUV může být užitečným nástrojem pro
posuzování závažnosti (metabolické aktivity, možné
agresivity) nádorů a účinnosti biologické odezvy na jejich
terapii. Je však nutno mít na paměti i některá úskalí,
spočívající v závislosti získaných hodnot
SUV na řadě okolností a parametrů:
¨ Především je to přesná skutečná hodnota
aktivity, ve vztahu ke kalibraci měřiče
aplikované aktivity a citlivosti (detekční
účinnosti) gamakamery. Závisí i na čase mezi
aplikací a vyšetřením, který radioaktivním
rozpadem a farmakokinetikou výrazně ovlivňuje množství
radioindikátoru akumulované v jednotlivých tkáních, včetně
vyšetřovaných lézí. Korekce na tento čas může být
obtížná, protože různé typy tkání a nádorů akumulují
radioindikátor s různou rychlostí. Jedinou
možností, jak minimalizovat tento časový faktor, je
dodržovat stejný časový interval mezi
aplikací a scintigrafií. Je třeba též odečítat hodnoty
aktivity zbylé ve stříkačce či hadičce při aplikaci.
¨ Hydratace a hladiny metabolických
látek (např. cukrů) v krvi pacienta, funkční stav ledvin,
jater a dalších orgánů.
¨ Dále je to závislost na hmotnosti a tělesné
konstituci pacienta. U pacientů s vyšším
podílem tuku, který velmi málo akumuluje používaná
radiofarmaka, dochází k nadhodnocení naměřených
hodnot SUV. To může být problémem při srovnávání
různých pacientů mezi sebou, nebo pokud u daného pacienta
dojde ke změně hmotnosti mezi jednotlivými vyšetřeními. Korekci
SUV na hmotnost pacienta lze přibližně provést
pomocí normalizace na standardní vztažné hodnoty váhy
pacienta 70kg a povrchu těla S=1,75m2, s použitím
empirického vztahu mezi váhou M, výškou H,
povrchem těla S a podílem tukové tkáně: SUVM-corr
= C/(Ainj).43,8.M0,425.H0,725.0,0072. Vlivem
této korekce je změřená hodnota SUVM-corr v zobrazených lézích u hmotnějších pacientů
nižší než nekorigovaná hodnota SUV, u subtilnějších
pacientů je naopak nižší.
¨ Vyznačování zájmových oblastí
(ROI) vyšetřovaných lézí na scintigrafickém obraze je
individuálně závislé a není příliš reprodukovatelné.
Hodnoty SUV (především SUVmean) jsou přitom velmi citlivé i na malé rozdíly ve velikosti
a pozici vyznačených ROI.
¨ Absorpce záření gama v tkáni,
způsobující zeslabení - atenuaci - signálu
z hlouběji uložených lézí (viz část
"Nepříznivé
vlivy u scintigrafie a jejich korekce"). Korekce na atenuaci není
vždy přesná a spolehlivá.
¨ Počítačové úpravy obrazů -
různé druhy filtrů, metody a algoritmy rekonstrukce u
tomografických obrazů, mohou výrazně (a
nelineárně) ovlivnit nastřádaný počet
impulsů v hodnocené lézi a tkáňovém pozadí. Vede to k
velkým arteficikálním rozdílům ve
změřených hodnotách SUV.
¨ Efekt částečného objemu (Partial Volume Effect - popsaný výše v
pasáži "Objemové a aktivitní zkreslení") způsobuje zkreslení
zobrazovaných lézí co do aktivity i velikosti. Ke korekci na
tento efekt se používají RC koeficienty,
jejichž stanovení je obtížné (získávají
se pomocí fantomových měření) a jejich
hodnoty závisejí na zobrazovacích vlastnostech konkrétní
kamery. Pro jejich použití je též třeba znát průměr
zobrazované léze.
Vzhledem k těmto úskalím při stanovení
konkrétní přesné hodnoty SUV je tento parametr validní jen
při srovnávacích studiích větších
souborů pacientů, kde se individuální odchylky a nepřesnosti
randomizují. Při porovnávání změn
scintigrafických obrazů u konkrétního pacienta je hodnotu SUV
(kterou v praxi nelze stanovit s lepší
přesností než 30%) potřeba "brát
s rezervou"!.
Skeptická
poznámka autora k SUV :
Význam "přesné" absolutní kvantifikace SUV s
použitím všech sofistikovaných korekčních metod se někdy přeceňuje.
Pro získání vlastní zkušenosti si dovoluji doporučit
kolegům následující pokus: Zkuste u
několika pacientů porovnat hodnoty SUV
stanovené shora uvedeným složitým postupem s hodnotami
získanými z prostého poměru počtu impulsů
z ROI v obraze vyšetřované léze a počtu
impulsů v ROI vhodné referenční zdravé tkáně.
Relativní výsledky budou velmi podobné,
přinejmenším z hlediska posouzení závažnosti metabolické
aktivity tumoru a biologické odezvy na terapii..?.. - uvítám
Vaše zkušenosti...
Relativní SUV
Uvedená úskali přesného stanovení SUV ukazují, že v paxi
většinou nelze dodržet identické podmínky
při opakované scintigrafii pacienta před a po aplikaci
terapie. Proto se (v souvislosti s výše
uvedenou poznámkou) zavádí relativní
SUVrel, jakožto poměr SUVrel
= SUVtumor/SUVreferenční tkáň, kde se všechny problematické hodnoty aplikované
aktivity, detekční účinnosti, partial volum efektu, hmotnosti
pacienta, času aplikace, vykrátí. Dostaneme
tak v podstatě hodnotu poměru tumor/background ratio vyjadřující
relativní míru vychytávání radioindikátoru v analyzované
lézi ve srovnání s tkáňovým pozadím. Ze scintigrafického
obrazu se SUVrel dostane velmi jednoduše porovnáním počtu impulsů z
ROI léze a ROI reprezentativního tkáňového pozadí (jako referenční tkáň se bere např. ROI jater či
aorty; při opakovaném vyhodnocení téhož pacienta je nutno
dodržet identické ROI).
Technické poruchy scintilačních kamer
U tak složitého elektronického zařízení, jakým je
scintilační kamera, je řada možností vzniku lehčích i
závažnějších technických poruch. Zmíníme zde jen
některé poruchy specifické pro gamakamery. Z hlediska jejich
lokalizace je můžeme rozdělit na dvě skupiny :
1. Poruchy
elektrických napájecích zdrojů a mechanických pohybů kamery
Elektrické napájecí zdroje u kamer jsou dlouhodobě
zatěžovány často značnými výkony, zahřívají se,
chladicí ventilátory se "zadřou", ....
Současné gamakamery ve své elektro-mechanické
části obsahují řadu čidel, regulačních a kontrolních
obvodů, což je jistě správné z hlediska zdárného a
bezpečného fungování přístroje. Někdy je to však
příliš "překombinované", takže i bezvýznamná
odchylka může vést k zablokování mechanických pohybů a
tím i praktické použitelnosti kamery, s nutností servisního
zásahu.
2. Poruchy
zobrazovacích vlastnosti v zorném poli kamery
Prakticky všechny tyto poruchy můžeme zřetelně vidět na
obrazu homogenní distribuce záření gama (ať
již se jedná o plošný homogenní zdroj, nebo ozáření
krystalu bez kolimátoru bodovým zdrojem z dostatečné
vzdálenosti - viz "Fantomy a fantomová měření", pasáž "Testování a kalibrace homogenity
zobrazení kamery") :
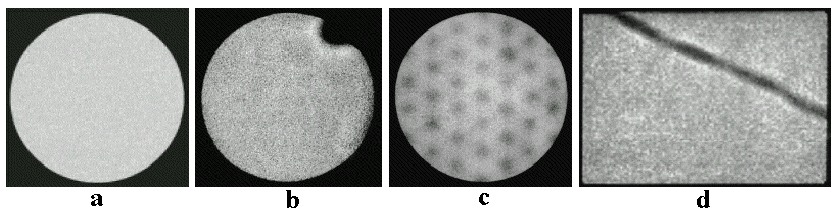
Při správné funkci by obraz homogenní
distribuce radioaktivity měl být rovněž homogenní
(obrázek a), s jedinými přípustnými odchylkami
pocházejícími ze statictických fluktuací nastřádaného
počtu impulsů v důsledku kvantově-stochastických dějů při
emisi fotonů gama.
Lokální kruhový výpadek (většinou ostře ohraničený, často s patrným
lemem) v zorném poli je důsledkem
přerušené detekce scintilací z určitého místa krystalu
kamery. Příčinou může být buď porucha příslušného fotonásobiče,
nebo jeho předzesilovače či nějakého
dalšího obvodu, kterým procházejí detekované impulsy. Na
obrázku b je porucha jednoho periferního fotonásobiče. Oprava
předzesilovače nepředstavuje větší problém. Výměna
vadného fotonásobiče je však technicky velmi náročná. Po
elektrickém odpojení je třeba fotonásobič opatrně
"odloupnout" od sikonové vazeliny (zajišťující
optický kontakt se světlovodičem scintilačního krystalu),
dokolale očistit příslušné místo a přitmelit speciálně
selektovaný fotonásobič s vlastnostmi stejnými jako ostatní
fotonásobiče. Tato práce zabere zkušenému elektronikovi
celý den, včetně následných adjustací a výsledných
kalibrací detektoru kamery.
Řada drobných nehomogenit na obrázku b,
odpovídajících pozicím fotonásobičů, nemusí znamenat
poruchu, ale je většinou způsobena špatným seřízením -
"rozladěním" - poloh fotopíků z
jednotlivých fotonásobičů. Po správném seřízení - "naladění"
(tuning) a vytvoření nové korekční matice
homogenity, zpravidla obdržíme homogenní zorné pole.
Nejzávažnější poruchou scintilační kamery
je prasklý krystal. Na obrazu zorného pole se
jeví jako výrazná nepravidelná (klikatá či rozvětvená)
čára výpadku impulsů, s pozitivním lemem (obr. d).
K této fatální poruše může dojít v zásadě dvěma
způsoby:
× Mechanickým tlakem či nárazem
na velmi křehký krystal. Stačí, aby na krystal bez
kolimátoru upadl třebas šroubovák, držák fantomu nebo jiný
předmět těžší než několik gramů. Při výměně
kolimátorů může k prasknutí krystalu dojít tehdy, když na
nasazovaném kolimátoru je nějaký cizí předmět, stačí
třebas tužka..!..
× Tepelným pnutím při
nerovnoměrné nebo rychlé změně teploty krystalu. Větší
teplotní gradienty vlivem tepelné roztažnosti mohou v krystalu
vyvolat značná mechanická pnutí, která mohou vyústit až v
prasknutí. Zvlášt teplotně citlivý je krystal při sundaném
kolimátoru. Za této situace se dokonce nedoporučuje otvírat v
místnosti okna ani spouštět klimatizaci.
Prasklý krystal je neopravitelnou
poruchou scintilační kamery. Je nutno vyměnit celý detektor (krystal + fotonásobiče + předzesilovače) za nový detektor, zkompletovaný ve výrobním
závodu. Jedná se o nákladnou záležitost, cca 2 miliony
korun!
Nové
a alternativní fyzikální a technické principy scintilačních
kamer
Prakticky jediným druhem scintilačních
kamer používaných dosud v nukleární medicíně jsou kamery Angerova
typu popsané výše (samozřejmě
s výjimkou kamer PET
popsaných níže v §4.3 o tomografické scintigrafii). Přes jednoznačnou úspěšnost používání těchto
kamer v nukleární medicíně byly o samého počátku známé
též dvě základní nevýhody tohoto
řešení. První spočívá v nutnosti použití olověného
kolimátoru, kterým projde pouze záření g v přesně
vymezeném směru, avšak naprostá většina dopadajících
fotonů se zachytí v přepážkách mezi otvory Ţ nízká
detekční účinnost (citlivost) kamery. Druhá
nevýhoda pramení z omezené přesnosti, s jakou je systém
fotonásobičů a elektronických obvodů schopen lokalizovat
polohu scintilačního záblesku ve velkoplošném scintilačním
krystalu Ţ nedokonalá prostorová rozlišovací schopnost.
Proto již od 70.let byly navrhovány a experimentálně
zkoušeny alternativní fyzikálně-technická řešení
scintilačních kamer, odstraňující první nebo druhou
nevýhodu, popř. obě současně. Tato alternativní řešení
nepřesáhla dosud rámec laboratorních pokusů,
avšak s rozvojem technologií v oblasti mikroelektroniky a
nových materiálů je reálná naděje v blízké budoucnosti
dotáhnout některé z těchto konstrukcí do prakticky
použitelné formy, či dokonce na nahrazení stávajících
scintilačních kamer ve vzdálenější budoucnosti.
Drátové
kamery
Drátové kamery jsou založeny na jednoduchém principu
polohově citlivé mnohodrátové ionizační komory,
která byla vyvinuta pro sledování a zobrazení stop částic,
vznikajících při interakcích na urychlovačích (viz §2.3,
část "Driftové ionizační komory").
Vlastní detektor je tvořen větším počtem (i několika
stovek) tenkých drátků - elektrod, natažených v plynové
náplni ve dvou vrstvách ve vzájemnmě kolmém směru -
určují souřadnice X,Y. Při vniknutí fotonu záření g dojde k ionizaci v příslušném místě.
Oblak elektronů z tohoto místa driftuje k nejbližším
elektrodám, na nichž tím vzniká elektrický signál.
Průsečíky elektrod, které takto obdržely signál, udávají
místo interakce detekovaného fotonu. Ionizační oblak
elektronů může dorazit i k několika blízkým elektrodám;
vyhodnocovací elektronika pak stanovuje souřadnice pomocí
vážených průměrů signálů z různých elektrod. Místo
dopadu a interakce fotonu tak lze určit s přesností cca 0,1mm.
Kamery tohoto typu jsou vhodné především pro zobrazení
nízkoenergetickým zářením g.
Polovodičové multidetektorové gamakamery
Jedním ze základních faktorů omezujících vnitřní
rozlišení Angerovy scintilační kamery je neurčitost, s jakou
je systém fotonásobičů a následných elektronických obvodů
schopen lokalizovat polohu scintilačního záblesku ve
velkoplošném scintilačním krystalu. Vnitřní rozlišení
Angerovy kamery se proto v praxi nedaří snížit pod cca 3mm.
Koncepce multidetektorové kamery
spočívá v tom, že místo jednoho velkoplošného
scintilačného detektoru opatřeného množstvím
fotonásobičů se použije mnoho samostatných
miniaturních detektorů - pixelových polovodičových
detektorů (viz §2.5 "Polovodičové detektory"), umístěných v matrici
těsně vedle sebe. Záření gama se zde převádí přímo
na elektrické signály, aniž by byly nutné scintilátory a
fotonásobiče. Signál z každého tohoto detektoru se
zpracovává nezávisle (v
multiplexním režimu), přičemž
polohové souřadnice (x,y) jsou určeny prostě polohou (i,j) daného
mini-detektoru v detekční matici a vedou se přímo do
obrazové matice v počítači (pixel to pixel)
- obr.4.2.10 :
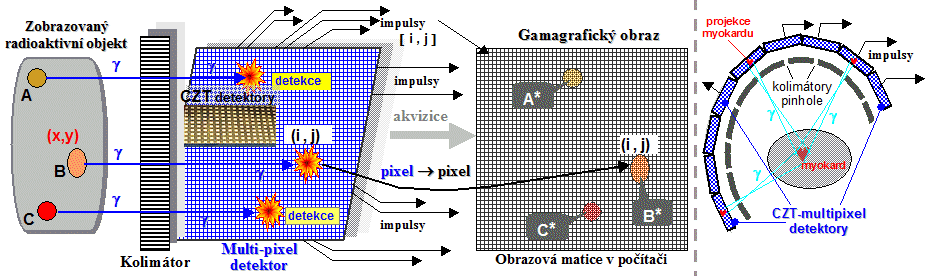
Obr.4.2.10. Princip multidetektorové polovodičové kamery.
Vlevo, uprostřed: Krystal
multidetektorové kamery je tvořen velkým množstvím
pravidelně uspořádaných miniaturních polovodičových
pixelových detektorů. Vpravo:
Speciální oblouková konfigurace polovodičových CZT
detektorů a multi-pinhole kolimátorů pro SPECT myokardu.
Detekce fotonů se provádí v jednotlivých
pixelech nezávisle, takže vnitřní prostorové rozlišení je
dáno velikostí (roztečí) pixelů - detektorů
(na rozdíl od Angerovy kamery, kde se
souřadnice scintilací stanovují triangulačně podle odezvy
různých fotonásobičů). Pokud je
vytvořena dostatečně hustá mřížka pixelových detektorů,
můžeme dosáhnout velmi dobrého vnitřního prostorového
rozlišení (i pod 1mm); celkové rozlišení pak závisí na použitém
kolimátoru. Optimalizované kolimátory pro
multipixelové polovodičové kamery by měly mít čtvercové
otvory velikosti pixelových detektorů (minus tloušťka přepážek),
které by se všude v zorném poli svými otvory geometricky
kryly s detekčními pixely.
Tento typ kamer se zatím vyráběl jen s malým
zorným polem kolem cca 5x5cm, pro ojedinělé použití pro scintigrafii malých
objektů (drobných laboratorních
zvířat), nyní se začíná vyrábět ve
standardní velikosti klasických kamer. Do této kategorie
patří i elektronické zobrazovací detektory pro X-záření,
tzv. flat-panely (popsané
v §3.2, část "Elektronické
zobrazení X-záření",
flat panely s "přímou konverzí", kterým patrně
patří budoucnost...). Postupně se
začínají používat i planární a SPECT kamery standardních
rozměrů s polovodičovými detektory.
Pro tuto polovodičovou gamagrafii
(planární a SPECT
"scintigrafii") se osvědčily polovodičové
CZT (Cadmium-Zinc-Tellur) detektory. Telurid
kadmia a zinku CZT je polovodičový detektor
pracující při pokojové teplotě, který s vysokou
účinností převádí gama a X záření přímo na elektrické
impulsy (fyzikální aspekty viz. §2.5
"Polovodičové detektory", pasáž "Kadmium-Zinek-Teluridové
(CZT) detektory"). Porovnání průměrných základních parametrů
standardní Angerovy kamery (se
scintilačním krystalem NaI(Tl) a fotonásobiči) a polovodičové kamery s CZT detektory (velikosti 2,5mm) je v
následující tabulce :
| Druh kamery | Vnitřní prostorové rozlišení | Detekční účinnost ( pro 99mTc) |
Energetické rozlišení | Max. četnost impulsů |
| Angerova kamera s NaI(Tl) | 4 mm | 60 cps/MBq | 10 % | 3.105 cps |
| Polovodičová CZT kamera |
2,5 mm | 85 cps/MBq | 6 % | 6.105 cps |
Polovodičové CZT kamery tedy, ve srovnání s
klasickými Angerovými kamerami, mají lepší
prostorové rozlišení i energetické rozlišení,
poněkud vyšší deteční účinnost (citlivost) a kratší
mrtvou dobu detekce.
Perspektivní je též
použití CZT detektorů pro pozitronovou emisní tomografii PET,
místo scintibloků BGO/LSO s fotonásobiči (viz níže "Pozitronová emisní tografie PET", obr.4.3.5). Vedle lepší
detekční účinnosti a prostorového rozlišení se může
dosáhnout i poněkud kratší koincidenční doba (pro lepší TOF). Zatím se
experimentálně zkouší na menších modelech PET. Výhodou
polovodičových detektorů je též jejich nezávislost
na magnetickém poli, což umožňuje použití v
hybridních systémech PET/MR.
V nukleární kardiologii se pro SPECT
myokardu začínají používat stacionární polovodičové
CZT (Cadmium-Zinc-Tellurid) kamery se
speciálním "kardiofokálním" uspořádáním
detektorů (obr.4.4.10 vpravo). Detektory jsou v gantry kamery
umístěny po oblouku pokrývajícím úhel cca
90-180°. Detektory jsou opatřeny kolimátory "multi-pinhole"
směrovanými kardiofokálně do středu gantry. Na rozdíl od
klasického rotačního SPECT (popsaného
níže "Tomografická
scintigrafie SPECT") zde střádání dat probíhá stacionárně,
detektory a kolimátory jsou v pevné poloze vzhledem k tělu
pacienta, všechny projekce SPECT jsou získávány současně.
Dosahuje se tím vyšší detekční účinnosti a rychlejšího
zpracování. Jedná se však o jednoúčelový
přístroj pro SPECT myokardu v kardiologii.
Vyvíjejí se dokonalejší univerzální stacionární
polovodičové SPECT kamery - viz. níže "Stacionární
multidetektorové kamery SPECT"
.
Comptonovy kamery
V odstavci o nepříznivých vlivech u
scintigrafie jsme Comptonův rozptyl záření g v tkáni zařadili
mezi nepříznivé jevy, zhoršující kvalitu
scintigrafických obrazů. Při vhodné mechanické konfiguraci a
elektronickém propojení dvou nebo více detektorů však
Comptonova rozptylu záření g v samotném detekčním systému může být využito
pro "elektronickou kolimaci" a
zobrazení pole záření g bez použití mechanických kolimátorů
(využití Comptonova rozptylu pro
gama-zobrazení poprve navrhli Everett, Fleming, Todd a
Nightengale v r.1977). Princip činnosti
takové tzv. Comptonovy kamery je schématicky
znázorněn na následujícím obrázku 4.2.11 :

Obr.4.2.11. Schématické znázornění principu elektronické
kolimace využívající energeticky-úhlové rekonstrukce dráhy
primárních (g) a Comptonovsky rozptýlených (g') fotonů záření gama.
Vlastní kamera je tvořena dvěma (popř. i
několika) za sebou následujícími detektory poskytujícími
polohovou a energetickou informaci o detekovaném kvantu g :
V prvním tenkém detektoru 1
(nahrazujícím klasický olověný kolimátor) dochází ke
Comptonovu rozptylu fotonů přicházejícího záření g (o různé úhly J), které pak
pokračují ve svém pohybu k druhému masívnějšímu detektoru
2, kde jsou plně absorbovány.
V koincidenčním režimu jsou detekovány polohové souřadnice
dopadu primárního fotonu g (x1,y1) a energie E1 předaná elektronu při Comptonově rozptylu v prvním
detektoru, a zároveň polohové souřadnice dopadu (x2,y2) a energie E2 Comptonovsky
rozptýleného fotonu g' pohlceného v druhém detektoru. Na základě
geometrického porovnání poloh (x1,y1) primárního a (x2,y2) rozptýleného fotonu gama se stanoví úhel J comptonova
rozptylu. Tento úhel J se pak dává do vztahu s energií E1 Comptonova rozptylu a
energií E2
rozptýleného záření g', což umožňuje (podle vztahu pro
úhlově-energetické rozdělení Comptonovsky rozptýleného
záření Eg ' = Eg /[1 + (Eg /moec2).(1 - cos J)] , uvedeného v §1.3) kinematicky
rekonstruovat dráhu fotonu a stanovit tak incidenční
úhel j, pod nímž primární foton g přilétl k prvnímu
detektoru kamery ze svého zdroje. Fotopíkové měření Eg = E1+E2 pak umožňuje
eliminovat ty nežádoucí fotony, které byly Comptonovsky
rozptýleny ještě před příchodem do prvního detektoru,
podobně jako u Angerovy kamery.
Vzniká tak incidenční kužel s
vrcholem v místě (x1,y1) a vrcholovým úhlem J, na jehož plášti leží
možné trajektorie přicházejícího fotonu. Množina těchto
plášťů incidenčních kuželů od jednotlivých detekovaných
fotonů může být pak použita k počítačové
rekonstrukci výsledného scintigrafického obrazu
distribuce radioaktivity ve snímaném objektu: v matici
rekonstruovaaného obrazu se sumačně "osazují"
pixely odpovídající průniku jednotlivých kuželoseček
(elipsy, kružnice), vznikajících projekcí incidenčních
kuželů do roviny (na obr.4.2.11 vpravo je
ukázka rekonstrukce obrazu bodového zdroje, vznikajícího jako
průnik eliptických projekcí incidenčních kuželů fotonů
vycházejících z tohoto zdroje).
V rozptylovém detektoru 1 se používá
multidetektorového systému polovodičových detektorů Si, CdTe
či GaAs tloušťky cca 5mm, je zde požadován vysoký účinný
průřez pro Comptonův rozptyl. Absorbční detektor 2
může být Angerova soustava krystalu NaI(Tl) nebo BGO či LSO s
fotonásobiči a elektronikou vyhodnocující polohu záblesků.
V poslední době se však i v tomto druhém detektoru Angerova
kamera nahrazuje polovodičovým multikrystalovým detektorem.
Kromě prostorového a energetického rozlišení jsou pro dobrou
činnost Comptonovy kamery kladeny vysoké nároky i na časové
rozlišení koincidence (podobně jako u detektorů PET
- viz §4.3).
Ve srovnání s mechanickými kolimátory může elektronická
kolimace vést k podstatnému zlepšení
detekční účinnosti (citlivosti), neboť se
využívají fotony g z podstatně většího prostorového úhlu
(elektronická kolimace, avšak jiného druhu, má velký význam
u pozitronové emisní tomografie, viz níže PET).
Kromě laboratorních experimentů zatím Comptonovy
kamery nebyly realizovány, zůstanou asi jen
fyzikálně-technickou zajímavostí....
Gamakamery pro vysoké energie
Potřeba zobrazit distribuci záření g vysokých energií
vyvstává především ve dvou oblastech :
× 1. Gamagrafické zobrazení distribuce
radioaktivních látek, vysílajících tvrdé záření
gama (jejich rozložení ve vzorcích, tkáních a orgánech),
popř. zobrazení distribuce atomových jader excitovaných
vnějším ozářením, které při deexcitaci emitují
vysokoenergetické záření g
(jako je metoda NSECT - viz níže "Neutrony stimulovaná
emisní počítačová tomografie").
To je však poměrně okrajová záležitost...
× 2. Gama-teleskopické zobrazení zdrojů
záření gama ve vesmíru - supernov, neutronových hvězd,
akrečních disků u černých děr (viz
např. "Astrofyzikální význam černých děr" v knize Gravitace, černé díry a fyzika
prostoročasu) a
dalších bouřlivých astrofyzikálních procesů; o záření g z vesmíru viz
též §1.6 "Kosmické záření",
část "Kosmické X a gama záření".
Zobrazování
pomocí záření gama vysokých energií - stovky keV až
desítky MeV - je značně obtížnější než u měkkého g-záření
(60-500keV). Pro takové energie mají kolimátory, vzhledem ke
značnému prozařování septy mezi otvory, špatné prostorové
rozlišení i světelnost a používané scintilační krystaly
standardních gamakamer jsou příliš tenké pro dosažení
rozumné detekční účinnosti. Vhodným řešením je zde shora
zmíněný princip Comptonovy kamery, v
modifikaci optimalizované pro vysoké energie. Jednodušší typ
Comptonova teleskopu, používaného na kosmických
stanicích k detekci g-záření z vesmírných zdrojů, je tvořen větší
ionizační komorou (driftovou drátovou nebo projekční), v
níž se měří energie rozptýleného g-záření a odražených
elektronů a směr rozptýleného záření nebo odražených
elektronů.

Obr.4.2.12. Některé principy gamakamer pro vysoké enrergie.
Vlevo: Kombinovaná Comptonova-Angerova
gamakamera pro vysoké energie. Vpravo:
3-Comptonovský gama-teleskop s mnoha detekčními
vrstvami.
Na obr.4.2.12 vlevo je
schématicky znázorněn princip činnosti kombinované
Comptonovy-Angerovy gamakamery pro vysoké energie. Citlivý
deteční objem kamery je tvořen ionizační driftovou
časově-projekční komorou (TPC - Time Projection
Chamber) s plynovou náplní (o ionizačních detektorech
viz §2.3 "Ionizační komory"). Když do tohoto pracovního prostoru vletí
vysokoenergetický foton g, dochází především ke Comptonovu rozptylu
v plynové náplni, pro vyšší energie pak i k tvorbě
elektron-pozitronových párů, s následnou anihilací
pozitronu s elektronem za vyzáření protisměrné dvojice
fotonů gama o energiích 511keV. Dráha odražených nebo
párových elektronů je snímána na základě ionizačních
elektronů, které tyto vysokoenergetické částice podél
svých drah vytvářejí. Jsou detekovány maticí několika
stovek miniaturních pixelových ionizačních komůrek,
pracujících v proporcionálním nebo Geigerově (lavinovitém)
režimu. Nebo mohou být použity polovodičové detektory. Tato
matice komůrek tvoří 2-D polohově citlivý detektor
elektronů. Ionizační elektrony z jednotlivých míst dráhy
rychlé nabité částice driftují do různých komůrek (kolmá
projekce dráhy do nejbližších komůrek) po různě dlouhou
dobu; vyhodnocením těchto geometrických a časových údajů
lze zrekonstruovat 3-D dráhu odražených nebo párových
elektronů a pozitronů v prostoru komory. Pracovní komora je ze
všech stran obklopena scintilačními krystaly s
fotonásobiči (Angerova kamera),
snímajícími comptonovsky rozptýlené a anihilační fotony, s
určením polohy scintilací a energie záření. Komplexním
koincidenčním vyhodnocením impulsů z matice pixelových
detekčních komůrek a z fotonásobičů Angerovy kamery lze pak
geometricky zrekonstruovat směr (úhel), z
něhož přilétl detekovaný primární vysokoenergetický foton
g -
realizovat gamagrafické zobrazení.
Na obr.4.2.12 vpravo je princip gama-teleskopu
založeného na opakovaném Comptonově rozptylu
ve vrstvách polohově citlivých polovodičových detektorů.
Systém sestává z několika vrstev plochých polohově
citlivých (2-D) detektorů, poskládaných nad sebou v
ekvidistantních vzdálenostech. Po vstupu primárního g-fotonu o energii Eg1 dojde k jeho Comptonovu rozptylu v některém z
detektorů, což je doprovázeno polohovým impulsem a impulsem o
amplitudě nesoucí informaci o ztrátě energie DE1, kterou foton při
rozptylu v detektoru zanechal. Rozptýlený foton pokračuje v
letu pod úhlem J1 s energií Eg2= Eg1-DE1, načež může dojít k jeho dalšímu Comptonovu
rozptylu v další detekční vrstvě, poskytující
příslušný polohový impuls a energetický impuls DE2. Foton se rozptýlí
o úhel J2 a pokračuje s
energií Eg3= Eg2-DE2.
Může tak docházet k opakovaným mnohonásobným rozptylům,
dokud foton neopustí detekční prostor. Koincidenčním
vyhodnocením polohových souřadnic v jednotlivých detekčních
vrstvách se stanoví úhly rozptylu J1,J2,J3,...., vyhodnocením amplitud impulsů se zjistí
ztráty energie DE1,DE2,DE3,... Tyto údaje se dosadí do Comptonových rovnic
Eg2 = Eg1 /[1 + (Eg1 /moec2).(1 - cos J1)] ; Eg1 = DE1 + Eg2 = DE1
+ {DE2 + [DE22+ 4moec2.DE2/(1-cosJ2)]1/2/2} , .... ,
což umožňuje kinematicky a geometricky zrekonstruovat dráhu
fotonu - poskytne hledanou hodnotu úhlu J incidenčního kuželu, pod
nímž do detekčního systému vletěl primární g-foton. A další
rekonstrukcí pomocí průniku množiny projekcí incidenčních
kuželů všech zaregistrovaných fotonů se získá výsledný g-teleskopický
obraz zdroje z něhož byly fotony emitovány. Výhodou
tohoto uspořádání je to, že k rekonstrukci úhlu
dopadajícího g-fotonu zde není nutná jeho úplná absorbce v
těžkém "kalorimetrickém" detektoru pro zjištění
celkové energie. Energie dopadajícího fotonu se stanovuje
změřením pozice prvních tří interakcí a energie odevzdané
v prvních dvou interakcích. Postačuje tedy, aby došlo
nejméně k 3-násobnému Comptonovu rozptylu, jehož analýzou
lze zrekonstruovat incidenční úhel J - odtud se tento systém
někdy označuje jako 3-Comptonovský teleskop
(3-Compton telescope). Analýza příp. dalších rozptylů
zpřesňuje rekonstrukci. V jednotlivých vrstvách plochých
polohově citlivých detektorů lze použít buď ionizační
drátové komory, nebo lépe germaniové či křemíkové polovodičové
driftové detektory, které mají dobré energetické i
obrazové rozlišení.
Pro zobrazení záření gama velmi
vysokých energií, stovky MeV až stovky GeV, se
používají speciální částicové detektory
elektron-pozitronových párů v uspořádání
podobném jako na obr.4.2.12 vpravo. Přicházejí g-záření dopadá
nejprve na desku z těžkého materiálu (wolframu), kde se
přemění na elektron-pozitronové páry, vylétající téměř
ve směru původního fotonu g. Jejich dráhy se pak sledují vrstvami polohově
citlivých 2-D křemíkových detektorů (trackerů), čímž se
zjišťuje směr odkud záření gama přiletělo. Nakonec svou
energii předají do kalorimetrického detektoru, umístěného
pod poslední detekční vrstvou, čímž se zjistí energie g-kvanta.
4.3.
Tomografická scintigrafie
Každý živý organismus je
objekt trojrozměrný a stejný charakter má
tedy i distribuce radioindikátoru. Planární scintigrafický
obraz, který je dvojrozměrnou projekcí skutečnosti, může
proto zachycovat jen část reality. O distribuci
radioindikátoru v "hloubkovém třetím rozměru",
kolmém k čelu kolimátoru, nemůžeme z planárního
scintigrafického obrazu nic zjistit. Planární scintigrafické
obrazy mají z tohoto hlediska závažné úskalí - možnost překrývání
a superpozice struktur uložených v různých
hloubkách. Pomáháme si zde sice zobrazováním ve více
různých projekcích, avšak riziko falešného nálezu či
neodhalení anomálie v hloubi organismu, překryté jinou
strukturou, nelze nikdy vyloučit. Superpozice záření z
různých hloubek zobrazovaného objektu dále vede ke snížení
kontrastu zobrazení lézí, které jsou v planárním
obraze překrývány zářením z tkáňového pozadí.
Pro odstranění těchto nevýhod planární
scintigrafie a pro získání komplexního zobrazení struktur v
různých hloubkách byla vyvinuta tomografická
scintigrafie *) poskytující trojrozměrné
zobrazení distribuce radioindikátoru. Jednou z
hlavních předností tomografického zobrazení je podstatně vyšší
kontrast zobrazení lézí (až 10-krát), které na
transverzálních řezech nejsou překrývány zářením z
tkáňového pozadí.
*) Řecky tomos
= řez - tomografické zobrazení je tvořeno určitými řezy,
většinou transverzálními, jejichž větší počet vytváří
trojrozměrný obraz.
Některé základní principy, především geometrické
a rekonstrukční, mají všechny tomografické metody
společné. Rentgenová transmisní tomografie CT byla popsána v
§3.2 "Rentgenová diagnostika", část "Transmisní
rtg tmografie (CT) ", kde je zmíněn i vývoj tomografických metod
obecně.
Technický vývoj gamagrafické tomografie
Snahy o dosažení hloubkového tomografického zobrazení
začínaly již záhy po zavedení scintigrafie v 60. a
70.letech. Předchůdkyní nynější gamagrafické tomografie
SPECT byla v 70.letech pohybová tomografie
(obr.4.3.1 vlevo): vyšetřovací stůl s pacientem a kolimátor
kamery se šikmými otvory (slant hole) pomocí
elektromotorků synchronně rotovaly takovým způsobem,
že pro vrstvu v určité "ohniskové" hloubce se oba
pohyby vykompenzovaly a získal se ostrý obraz,
zatímco v ostatních vrstvách (nad a pod ohniskovou rovinou)
byl obraz pohybově rozmazán a tím byl tmavší a
méně zřetelný. Na pozadí těchto rozostřených a
ztmavěných oblastí byly lépe patrné ostřeji a jasněji
zobrazené struktury z ohniskové roviny. Hloubková poloha
ohniskové roviny se nastavovala poloměrem otáčení lehátka
na excentru motorku lehátka. Kvalita, kontrast a hloubkový
efekt takového zobrazení však nebyly valné (se SPECT naprosto
nesrovnatelné). Získal se obraz vždy jen jedné podélné
vrstvy, pro vytvoření obrazu jiné ohniskové vrstvy bylo
nutno změnit poloměr klouzavé rotace lehátka a spustit novou
akvizici. Podrobnější tomografické zobrazení ve více
vrstvách bylo tudíž časově značně náročné. Metoda je
již dávno opuštěná.

Obr.4.3.1. Rané pokusy o realizaci tomografické scintigrafie.
Vlevo: Pohybová tomografie s rotujícím
slant-hole kolimátorem a rotujícím lehátkem. Uprostřed:
Koincidenční tomografie s využitím g-g úhlové korelace. Vpravo:
SPECT na stacionární planární gamakameře s
rotací pacienta.
Dělaly se též zajímavé
exprimenty s 2-fotonovou koincidenční tomografií
využívající g-g úhlové korelace mezi emisí
kaskádních dvojic fotonů gama u některých radionuklidů (§1.2, část "Záření gama",
pasáž "Úhlové korelace záření
gama") - obr.4.3.1 uprostřed. K základní zobrazovací
gamakameře byl v určitém místě a pod vhodným úhlem q (např. 90°)
přiložen další detektor gama, či v dokonalejší verzi
další gamakamera se štěrbinovým kolimátorem, v koincidenčním
zapojení. Pro vytvoření obrazu byly registrovány pouze
impulsy pocházející ze současného příchodu
dvojice kaskádních gama-kvant do obou detektorů. Byla tak
zobrazovaná jen jedna podélná tenká vrstva,
vymezená detekčním úhlem pomocného koincidenčního
detektoru (či větší počet
nezávislých vrstev při použití koincidenční kamery se
štěrbinovým kolimátorem). Paleta
vhodných isotopů, vykazujících kaskádní deexcitaci s
úhlovou korelací emitovaných gama-fotonů, je však velmi
omezená a detekční účinnost koincidenčního systému byla
velmi nízká. Tato metoda nepřekročila rámec laboratorních
experimentů; avšak v určitém smyslu ji lze považovat za
ideovou předchůdkyni pozitronové emisní tomografie. Totiž,
pouze dokonalá úhlová korelace 180° mezi dvojicí anihilačních
fotonů při elektron-pozitronové anihilaci našla široké
uplatnění v koincidenční pozitronové emisní
tomografii, viz níže PET.
První pokusy o gamagrafickou tomografii
SPECT se v 60.-80.letech prováděly na řadě
pracovišť s planárními Angerovými kamerami (první tomografický snímek prezentovali Kuhl a
Edwards v r.1963). Jelikož tehdejší
(planární) kamery neměly gantry a nemohly rotovat, otáčel
se pacient - obr.4.3.1 vpravo. Před kolmo
nastavenou stacionární kameru se pacient posadil na otočnou
židli s vyznačenou úhlovou stupnicí (goniometrem). Provedl se
planární snímek, židle s pacientem se pootočila o určitý
úhel, nastřádal se další snímek atd. - cca 16-64 snímků
pro sekvenci úhlů 0-360°. Následovala počítačová rekostrukce
zpětnou projekcí do transverzálních řezů. Tato
metoda, přes svou mechanickou neohrabanost, v podstatě již
umožňnovala plnohodnotné SPECT zobrazení - s tím omezením,
že v té době ještě nebyly vyvinuté dostatečně komplexní
softwary rekostrukce transverzálních řezů a jejich
zpracování.
Skutečně úspěšnou a rutinně používanou
metodou tomografie SPECT se pak stala montáž gamakamer na gantry
s rotací kamery kolem pacienta (jak je popisováno
níže). V poslední době se vyvíjejí stacionární
multidetektorové kamery SPECT
bez rotace, které pravděpodobně vytlačí neohrabaný
rotační SPECT.
Autorská poznámka:
Rané pokusy o tomografické zobrazení podle obr.4.3.1 jsme v
70. a 80. letech prováděli i na našem Oddělení
nukleární medicíny KNsP v Ostravě-Porubě.
Naše první gamakamera Pho Gamma HP (Nuclear Chicago) s
vyhodnocovacím zařízením CLINCOM z r.1974 byla vybavena
rotujícím kolimátorem Slant Hole a rotujícím
lehátkem pro pohybovou tomografii (obr.4.3.1 vlevo).
Pokusy s g-g koincidenční tomografií jsme prováděli na
kameře Pho Gamma HP s pomocí kolmo orientované kolimované
scintilační sondy, zapojené v koincidenci do toku
scintigrafických impulsů (přídavnou gamakameru se
štěrbinovým kolimátorem jsme neměli k dispozici).
Improvizovanou SPECT s pacientem na otočné židli jsme
zkoušeli rovněž na planární kameře Pho Gamma, s tehdy
nejnovějším počítačovým vyhodnocovacím zařízením
GAMMA-11 a vlastním vyvinutým softwarem.
Na rozdíl od rentgenové
transmisní tomografie CT, kde obraz vzniká průchodem - transmisí
- X záření tělem, u scintigrafické tomografie vzniká obraz
detekcí záření vysílaného - emitovaného
- z radioindikátoru uvnitř těla. Radionuklidová emisní
počítačová tomografie (ECT) je dvou typů :
1. Jednofotonová emisní tomografie SPECT
za použití g-radionuklidů registruje z každé radioaktivní
přeměny vždy jen jeden emitovaný foton
záření gama.
2. Dvoufotonová pozitronová emisní tomografie PET
využívající pozitronové (beta+) radionuklidy, resp. vznikající anihilační
záření, kde se současně (koincidenčně) detekují vždy dva
fotony emitované při anihilaci.
V obou případech jsou výsledné tomografické
obrazy získány počítačovou rekonstrukcí po
nasnímání impulsů z detekce fotonů. V tomto pořadí 1.,
2. si obě tomografické metody probereme.
Tomografická
scintigrafie SPECT
Nejčastější metodou
tomografické scintigrafie je tzv. jednofotonová emisní
počítačová tomografie SPECT (Single
Photon Emission Computerized
Tomography). Její princip je znázorněn na
obr.4.3.2 :
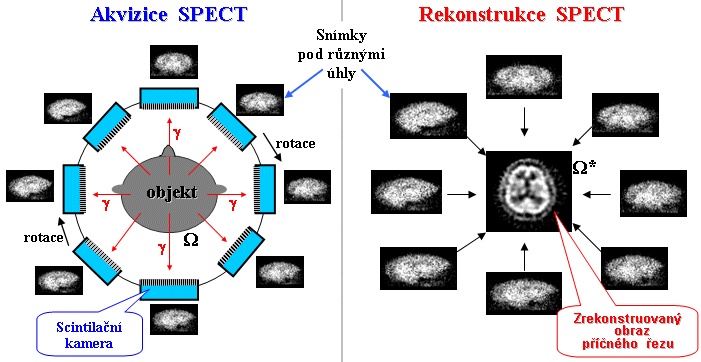
Obr.4.3.2. Princip snímání
scintigrafických snímků vyšetřovaného objektu W (zde mozek) pod různými úhly
rotující kamerou SPECT a jejich počítačové rekonstrukce do
výsledného obrazu W* příčného řezu tímto objektem.
Základní
princip SPECT
Tomografická kamera SPECT se svou konstrukcí od běžné
planární kamery liší jen tím, že speciální stojan
na němž je detektor kamery upevněn, tzv. gantry
kruhového tvaru (angl. gantry =
portál, průchozí nosná konstrukce),
umožňuje motoricky poháněnou rotaci
detektoru kolem vyšetřovaného objektu *) -
fotografie SPECT kamery je výše v §4.2 na obr.4.2.4 vpravo dole. Pro zrychlení
akvizice jsou na společném gantry instalovány nejčastěji dva
detekční systémy ("dvouhlavá"
SPECT kamera), vyskytovaly se i kamery s 3
či 4 detektory (neosvědčilo se...).
*) Ojediněle se vyskytuje i technická
konstrukce SPECT kamery bez gantry. Detektory
kamery jsou upevněny na speciálních ramenech opatřených servomotorky,
umožňujícími pohyby detektorů v prostoru v
různých směrech a pod různými úhly - se všemi "stupni
volnosti". Vhodným elektronickým řízením servomotorků
lze pak dosáhnout i kruhového pohybu detektorů kolem
vyšetřovaného objektu (kolem lehátka s pacientem) při SPECT.
Zcela jiný princip mají nové stacionární
multidetektorové kamery SPECT.
Akvizice SPECT
Vlastní tomografická scintigrafie SPECT pak spočívá v tom,
že kamera postupně obíhá *) kolem
vyšetřovaného objektu a pod řadou různých úhlů
snímá (planární) scintigrafické obrazy vyšetřovaného
objektu - počet těchto projekcí je většinou 32, 64
až 128 obrazů pod úhly 0°-360° - obr.4.3.2 vlevo. [Pozn.:
V některých případech se používá rozmezí
úhlů menší - některé projekce, jejichž kvalita by
byla degradována zvýšenou absorbcí (atenuací) záření g a nijak by
nepřispěly k výsledným rekonstruovaným obrazům (spíše by
mohly vnést zhoršení), se nesnímají. Taková je situace u SPECT myokardu, kde se snímá rozmezí úhlů 90-270°, zatímco v
úhlech mezi 0-90° a 270-360°, odpovídajícím zadním a
pravým bočním projekcím, se snímky vzhledem k výrazné
atenuaci záření g nepořizují.]
*) Níže jsou zmíněny stacionární
multidetektorové kamery SPECT
bez rotace.
Obíhání detektorů kamery
kolem vyšetřovaného objektu je zpravidla krokové
(step-by-step) - kamera se potočí o určitý úhel a
zastaví se, po předvolenou dobu probíhá akvizice
příslušné projekce, pak se opět pootočí o daný úhlový
krok a probíhá střádání dalšího snímku. Plynulé
(kontinuální) obíhání detektoru s kontinuální akvizicí se
používá jen zřídka. Z geometrického hlediska může být
oběh detektorů kruhový (circular) -
ten se používá častěji, nebo eliptický (non-circular),
příp. s využitím systému "auto-countouring"
(zmíněného výše v pasáži "Konstrukční
uspořádání scintilačních kamer"), za účelem lepšího
"kopírování" povrchu těla a dodržení co
nejkratší vzdálenosti čela kolimátoru kamery od
zobrazovaných struktur (pro dosažení co
nejlepšího prostorového rozlišení).
Kolimátory pro SPECT
Obíhající kamery při akvizici SPECT jsou opatřeny zpravidla standardními
kolimátory s paralelními otvory, stejnými jako se
používají při planární scintigrafii: pro 99mTc je to většinou
kolimátor HR, pro 131I kolimátor HE, pro 123I kolimátor MediumEnergy.
Ojediněle se používají speciální kolimátory
s jinou geometrií otvorů: kolimátor FanBeam
pro SPECT mozku, nebo konvergentní kolimátor
pro SPECT myokardu. Všechny tyto typy kolimátorů byly
podrobněji popisovány výše v části "Scintigrafické
kolimátory". U stacionárních
multidetektorových SPECT kamer se
používají kolimátory typu Pinhole, nebo
speciální mechanicky pohyblivé kolimátory (což je však jen provizorní řešení...).
Rekonstrukce obrazů
SPECT
Z této série planárních
scintigrafických obrazů - projekcí - nasnímaných pod
různými úhly (jsou to tedy rovninné
projekce distribuce radioindikátoru do různých úhlů) se pak počítačově rekonstruuje
obraz distribuce radioaktivity v myšleném příčném
řezu, vedeném vyšetřovaným objektem v rovině
kolmé k ose rotace kamery - obr.4.3.2 vpravo. Metody
počítačové rekonstrukce SPECT jsou popsány níže v pasáži
"Počítačová rekonstrukce SPECT".
Takovou rekonstrukci lze provést pro každý
řádek obrazové matice úhlově snímaných obrazů, takže
nám v paměti počítače vznikne celá série "vedle sebe
naskládaných" obrazů příčných řezů - jakýsi
trojrozměrný "válec" (u kamer
s kruhovým zorným polem) či
"krychle" (resp. kvádr - u kamer
s kvadrangulárním zorným polem),
představující trojrozměrné zobrazení
distribuce radioindikátoru ve vyšetřovaném objektu. Buňky
tohoto trojrozměrného obrazu mají již objemový charakter a
nazývají se "voxely" (objemové - volumové -
pixely). Tímto trojrozměrným obrazem v
paměti počítače pak metodami počítačové grafiky
můžeme vést a zobrazovat na monitoru řezy v
libovolných směrech - tedy nejen primární
transverzální řezy, ale i řezy podélné a šikmé, můžeme
provádět různé geometrické reorientace a
další úpravy tak, abychom co nejpřehledněji zobrazili
požadovanou strukturu. Pomocí metod počítačové grafiky lze
pomocí vhodného stínování a perspektivního úhlového
zobrazení vytvářet trojrozměrné 3D-obrazy s
řadou počítačových efektů, které jsou sice umělé a
nemusí přímo odrážet skutečnost, avšak jsou velmi
názorné a efektní, např. i pro didaktické účely.
Příklad 3D-zobrazení u scintigrafie myokardu.
Stacionární
multidetektorové kamery SPECT
Základní nevýhodou standadrního rotačního
snímání scintigrafických projekcí u SPECT je těžkopádnost,
pomalost a nízká detekční účinnost.
V každém úhlu se registruje jen malá část fotonů gama (jdoucích ve směru momentální polohy detektorů), ostatní fotony emitované z těla pacienta jsou
ztracené. Detektory se pomalu postupně přesouvají do
dalších a dalších úhlů; při značně dlouhé akviziční
době je počet nastřádaných impulsů v obrazech poměrně
nízký. Požadované obrazy SPECT získáme až ext
post, po skončení měření a provedení
počítačové rekonstrukce. U rotační metody nelze
provádět dynamickou SPECT scintigrafii (s výjimkou perfuze myokardu, kde je to však umožněno
EKG-hradlováním), ani operativně
modifikovat akviziční proceduru.

Obr.4.3.3. Stacionární SPECT kamera
snímá pomocí většího počtu kruhově uspořádaných
multipixelových detektorů současně projekce pod všemi úhly.
Není zde žádná rotace. Takto vzniklá data pak mohou být
průběžně rekonstruována do obrazů příčných řezů.
Pro eliminaci této nevýhody rotační SPECT se nabízí použít větší počet menších zobrazovacích stacionárních detektorů - gamakamer, rozmístěných v prstenci kolem vyšetřovaného objektu, bez rotace - obr.4.3.3 vlevo. Všechny projekce se pak snímají současně ze všech úhlů. Kamera je kompaktní, neobsahuje žádné pohyblivé díly, využití fotonů pro zobrazení je daleko efektivnější - i při nižší aplikované aktivitě zde trvá SPECT vyšetření výrazně kratší dobu. Neuplatňují se zde rušivé mechanické jevy, jako jsou posuny centra rotace. Jsou vyvíjeny kamery s multiPinhole kolimátory, multiDivergent, či multiParalel kolimátory. Tomografické obrazy SPECT zde mohou být rekonstruovány a zobrazovány průběžně během akvizice, obr.4.3.3 vpravo (podobně jako je tomu u planární scintigrafie a u PET), což umožňuje i dynamickou SPECT scintigrafii. Tento druh kamer se začíná používat zatím v nukleární kardiologii pro SPECT perfúze myokardu (§4.9.4, část "Scintigrafie perfuze myokardu", viz též výše část "Polovodičové multidetektorové kamery"). Stacionárním kompaktním SPECT kamerám s multipixelovými polovodičovými detektory (popsanými výše "Polovodičové multidetektorové gamakamery") nepochybně patří budoucnost, jistě dříve či později vytlačí těžkopádné SPECT kamery s rotujícími detektory..!..
Počítačová
rekonstrukce SPECT
Sinogram, Linogram
Vyneseme-li postupně obrazy nastřádané v různých úhlech J, jednotlivé body
předmětu v nich budou opisovat kružnice o
různých poloměrech (podle vzdálenosti
od centra rotace). X a Y - souřadnice
těchto kruhově obíhajících bodů budou opisovat sinusové
(resp. kosinusové) křivky R.sinJ o amplitudě dané
vzdáleností R od centra rotace. Jejich jas je přitom
modulován nastřádaným počtem impulsů v jednotlivých
pixelech úhlových projekcí. Množina všech těchto graficky
znázorněných souřadnic křivek oběhu pro všechny body v
daném řezu vytváří důležitý 2D obraz zvaný sinogram.
Vzniká jednoduše tak, že postupně vezmeme zvolené
řádky (odpovídající danému transverzálnímu
řezu) z jednotlivých projekčních obrazů a uložíme je
"nad sebe" v novém obraze - sinogramu. To se provede
pro všechny projekce (úhly J). Sinogram má v tomografické scintigrafii dvě úlohy
:
1. Používá se jako datový formát
(sinogram-file), do něhož probíhá akvizice
primárních dat z jednotlivých projekčních úhlů v
predefinovaných časech na snímek. Některé nové gamakamery
(především PET) mohou data operativně střádat i v LIST-modu
(bez predefinového času na snímek), ze kterého může být
sinogram dodatečně vytvořen, s možností počítačových
úprav. Každý řádek akviziční matice - každý
transverzální řez - má svůj sinogram. Z dat sinogramů pak
lze zrekonstruovat obrazy příčných řezů (pomocí inverzní Radonovy transformace).
2. Zobrazení sinogramu umožňuje zkontrolovat
správný průběh tomografického vyšetření. Za
normálních okolností musí mít sinogram každého
zobrazovaného aktivního místa hladký nepřerušený průběh
("vlnovku"). Příp. pohyb pacienta (který může vést ke zhoršení kvality či k
artefaktům) během akvizice SPECT je na
sinogramu jasně vidět jako diskontinuita
hladkého průběhu. Sinogramy se používají i pro testování
mechanických poruch při rotaci detektorů, jako jsou posuny
centra rotace (viz níže "Nepříznivé
vlivy u SPECT a jejich korekce",
pasáž "Mechanická nestabilita osy rotace"). Na základě sinogramů lze nežádoucí pohyby
softwarově korigovat.
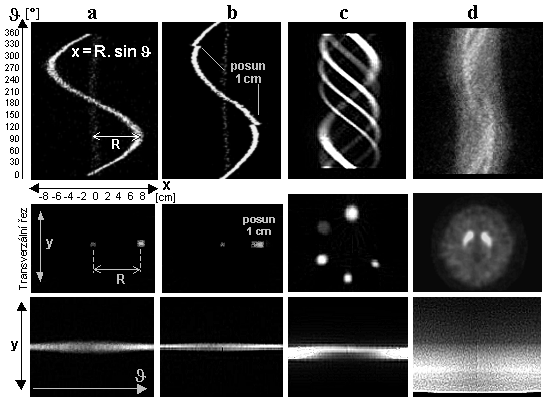 |
Příklady sinogramů
(nahoře) a linogramů (dole) u SPECT
scintigrafie. V prostřední části jsou transverzální
řezy. a) Bodový zdroj ve vzdálenosti R od centra rotace na sinogramu opisuje sinusovou křivku x =R.sinJ. Slabý pomocný zdroj ve středu setrvává nehybně na ose rotace (x=0). b) Posun zdroje v radiálním směru během akvizice se projeví nespojitostí na sinogramu. c) Sinogram 5 aktivních lézí v Jasczak fantomu. d) Sinogram a linogram SPECT mozku pro zobrazení dopamin. receptorů ("Scintigrafie receptorových systémů v mozku"). (SPECT Jasczak fantomu pořídil Ing.M.Koláček, SPECT mozku MUDr.M.Havel, z KNM Ostrava) |
V metodách tomografického zobrazení (SPECT,
PET, příp. MRI) se někdy konstruuje i tzv. linogram
- obraz, v němž jsou sumované řádky ze všech primárních
obrazů "naskládány" jako sloupce lineárně
vedle sebe. Ve SPECT linogram vzniká tak, že v každém z
obrazů projekcí pod jednotlivými úhly se sečtou
všechny řádky a vzniklý sumační řádek se uloží
jakožto sloupec v novém obraze - linogramu. To
se provede pro všechny projekce. Na rozdíl od sinogramů,
kterých je větší počet (pro každý transverzální řez), linogram
je jeden pro celé tomografické vyšetření. Byly
vypracovány počítačové metody pro rekostrukce obrazů
příčných řezů (inverzní Radonova
transformace) pomocí integrace podél
přímek v linogramu. V některých případech může linogram
sloužit též pro posouzení hladkého průběhu SPECT
vyšetření vzhledem k pohybovým artefaktům či přechodným
elektronickým poruchám v procesu akvizice.
Pozn.: Univerzální
tomografické zákonitosti
V této části nastíněné zákonitosti a vztahy mezi
kruhovými planárními projekcemi pod úhly J a
transverzálními tomografickými řezy (sinogramy, Radonova
transformace, metody rekonstrukce, vzorce na obr.4.34), platí
nejen při SPECT snímání fyzickou rotací kamery, ale i při
stacioárním SPECT, při PET, CT, příp. NMRI. Mají v zásadě
univerzální platnost a používají se v
různých zobrazovacích modalitách.
Metody rekonstrukce
SPECT
V množství dat, nastřádaných v jednotlivých projekcích pod
různými úhly, je implicitně obsažena
informace o prostorovém hloubkovém rozložení. Abychom mohli explicitně
zobrazit hloubkové prostorové rozložení radioindikátoru v
příčných řezech, je nutno provést počítačovou
rekostrukci nastřádaných "surových" dat.
Používají se dvě metody počítačové
rekonstrukce nastřádaných planárních obrazů z různých
úhlů do požadovaných transverzálních řezů :
1. Metoda
zpětné projekce
Analytická metoda zpětné projekce počítačově simuluje
inverzní proces k akvizici studie SPECT: Jako kdyby
detektor kamery vysílal z každé polohy (úhlu, kde byl při
rotaci a nastřádal tam příslušný snímek) a z každé své
buňky paprsky záření - o intenzitě modulované obrazem
(nastřádanou informací v buňce) - zpět ve směru k
vyšetřovanému objektu, kde tyto paprsky
"vykreslují" obraz příčného řezu v myšlené
obrazové matici umístěné ve středu rotace. Informace
obsažená v jednom daném pixelu obrazu nastřádaného z
určitého úhlu je přenesena do všech pixelů vznikající
matice příčného řezu, nacházejících se v přímce kolmé
k detektoru. Různě "intenzívní" paprsky z různých
úhlů pak při průchodu vytvářenou obrazovou maticí
"ozařují" a "osazují" jednotlivé elementy
(buňky, pixely) různě velkými čísly, které se při
průchodu dalších paprsků (z dalších úhlů) sčítají.
V místech, kterými prochází nejvíc paprsků o vyšší
intenzitě, vznikají "horká" místa s vysokým
nahromaděním impulsů - odpovídají místům s vyšší
koncentrací radioindikátoru ve vyšetřovaném objektu.
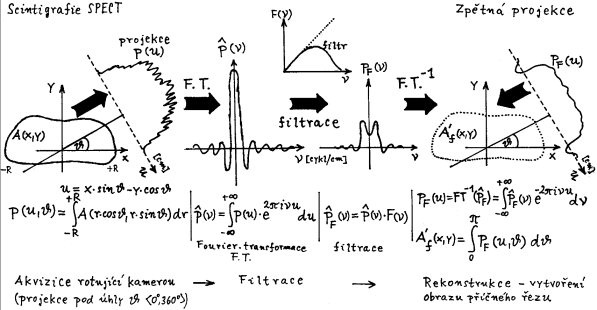
Obr.4.3.4. Proces akvizice SPECT a rekonstrukce transverzálního
řezu metodou filtrované zpětné projekce.
Zpětná projekce tedy využívá zpětného
promítání dat z jednotlivých planárních obrazů do
původně prázdné matice vždy pod úhlem, v němž planární
obraz vznikal. Výsledná matice - zrekonstruovaný obraz -
vzniká přímým sečtením těchto projekčních dat. Prostá
zpětná projekce má nevýhodu ve vyšším rušivě
strukturovaném pozadí se vznikem "hvězdicovitých"
artefaktů (viz níže). V praxi se proto používá filtrovaná
zpětná projekce FBP (Filtered Back Projectoion),
která je variantou inverzní Radonovy transformace.
Příslušné matematické vzorce jsou uvedeny na obr.4.3.4, kde
je z matematického hlediska znázorněn celý proces akvizice,
filtrace a rekonstrukce SPECT (3.dimenze je
vynechaná). Vyšetřovaný objekt
(pacient), jehož příčný řez má distribuci
radioindikátoru A(x,y), je kamerou snímán v řadě projekcí
pod různými úhly J, čímž vznikají obrazy projekcí p(u). Tyto obrazy
se pak Fourierovsky transformují do frekvenční oblasti a
vzniklá spektra p(n) se násobí filtrem složeným z RAMP-filtru a
uživatelského filtru (viz "Filtry
a filtrace"). Vzniklá zfiltrovaná spektra pF(n) se pak inverzní Fourierovou transformací
převádějí zpět do prostorové oblasti (vznikají filtrované
obrazy projekcí pF(u)), načež se zpětnou projekcí
(pod těmi samými úhly J) vytváří výsledý obraz příčného řezu
A´f(x,y).
Metoda filtrované zpětné projekce je
nejpoužívanější, neboť je poměrně rychlá (používají se algoritmy rychlé Fourierovy
transformace, hodnoty goniometrických funkcí se dopředu
vypočítají pro diskrétní hodnoty úhlů, takže pak se již
používají běžné aritmetické operace).
Z hlediska vztahu mezi skutečnou distribucí radioaktivity
A(x,y) a zrekonstruovaného obrazu příčného řezu A´(x,y) se
však nejedná exaktně o vzájemně jednoznačné zobrazení -
obraz se konstruuje nikoli z lokálních hodnot v pixelech, ale
vzniká superpozicí projekčních paprsků.
Tyto projekční paprsky jsou arteficielní a
zanechávají ve výsledném obraze své stopy, neodpovídající
skutečné distribuci radioaktivity ve vyšetřovaném objektu.
Nejmarkantněji se to projevuje v okolí ložisek zvýšené
depozice radioaktivity, kde sbíhající se projekční papsky
vytvářejí "hvězdicovitou" arteficiální
strukturu - tzv. star-efekt. Tento
star-artefakt se sice účinně potlačí RAMP-filtrem,
avšak různé "nudličky" či "filamenty"
jsou v obrazech rekonstruovaných zpětnou projekcí vždy
patrné (níže na obrázku vlevo). Tyto nevýhody rekonstrukce
zpětnou projekcí do značné míry odstraňuje iterativní
metoda rekonstrukce. RAMP filtr, který zároveň funguje jako
"zaostřovací" (zvýrazňuje detaily a hrany v
obrazu), se při rekonstrukci používá v kombinaci s
uživatelským "vyhlazovacím" filtrem pro snížení
statistických fluktuací, šumu, v obrazu. Vhodnou volbou tohoto
filtru a jeho form-faktorů lze dosáhnout optimálního
kontrastu, prokreslení detailů a snížení šumu (podrobněji je diskutováno v práci "Filtry a
filtrace").

2. Metoda
iterativní rekonstrukce
Iterativní metoda *) rekonstrukce hledá pomocí postupných
kroků - aproximací takový obraz příčného řezu,
který by co nejlépe odpovídal jednotlivým nasnímaným
projekcím pod různými úhly J. Jedná se o algebraickou
rekonstrukční techniku (ART).
*) Latinské slovo "iteratio"
znamená "opakování"; zde se jedná
o opakující se cykly postupných aproximací.
Iterativní rekonstrukce probíhá v následujících etapách:
Iterace se opakují tolikrát, dokud není
splněno určité (dopředu nastavené) konvergenční
kritérium, např. požadovaná přesnost, nebo
předvolený počet iterací.
Dalo by se očekávat, že s rostoucím počtem iterací se
bude zvyšovat celková kvalita obrazu. Zkušenost však ukazuje,
že to platí asi do 4-8 iterací. Vyšší počet
iterací pak již jen zvyšuje statistické fluktuace, neboli
zhoršuje se odstup signál-šum.
Oproti metodě zpětné
projekce má iterativní metoda tu základní přednost **), že nevznikají
hvězdicové artefakty (nepoužívají se zde tedy
filtry typu RAMP). Rovněž v oblastech s nízkou radioaktivitou
(blízkou pozadí) jsou obrazy příčných řezů
"čistší" a kontrastnější - neobsahují
"filamenty" jako pozůstatky po paprscích zpětné
projekce. Další výhodou iterativní rekonstrukce je možnost
zavedení některých korekcí přímo do
algoritmu rekonstrukce - korekce na vlastnosti kolimátoru,
závislost rozlišení na vzdálenosti od kolimátoru...
**) Při zpracování obrazů SPECT v
běžné klinické praxi však nelze od iterativní metody
rekonstrukce očekávat "žádné zázraky" - rozdíl
oproti metodě zpětné projekce není často ani patrný, neboť
kvalita obrazu je primárně dána nedostatečnou statistikou,
rozlišením kamery, rozptylem a dalšími rušivými jevy
(zmíněnými níže), se kterými žádná rekonstrukční
metoda "nic neudělá".
Iterativní metoda rekonstrukce je podstatně
náročnější na počet aritmetických operací, takže se
mohla začít rutinně využívat až s vývojem dostatečně
rychlých počítačů (za použití koprocesorů) s vysokou
kapacitou paměti.
Zdokonalené varianty
iterativní rekonstrukce
Za účelem zefektivnění a zrychlení iterativní rekonstrukce
byly vyvinuty některé novější varianty a modifikace
základní iterační procedury:
EM (Expectation Maximalization) - hledání
nejlepšího odhadu obrazu statistickými metodami........
ML (Maximum Likekihood) - odhad na principu
maximální věrohodnosti......
MLEM (Maximum
Likelihood Expectation Maximization) -
iterační procedura s předem nastavitelným počtem iterací:
před začátkem rekonstrukce se předvolí takový počet
iterací, o němž předpokládáme optimální kvalitu obrazu.
OSEM (Ordered-Subset Expectation Maximalization) -
soubor všech projekcí se nejprve pravidelně rozdělí na
několik menších skupin (podmnožin=subsetů) a
iterační krok je aplikován na jednotlivé subsety zvlášť.
Sub-iterace každého subsetu slouží jako vstupní odhad pro
iteraci následujícího subsetu. Jeden úplný iterační krok
je iteračním cyklem přes všechny subsety. Součin počtu
subsetů a počtu iterací v každém z nich určuje efektivní
počet iterací. Z výpočetního hlediska je metoda OSEM
přibližně tolikrát rychlejší, kolik
subsetů použijeme.
SART (Simultaneous Algebraic Reconstruction
Technique) - pracuje simultánně na více řezech 3-D obrazu
............
OSSART - kombinace metod OSEM a SART
............ ........doplnit.........
Hybridní rekonstrukce
SPECT-CT ?
Některé nové hybridní
systémy SPECT/CT se pokoušejí zlepšit kvalitu SPECT
obrazů pomocí speciální iterativní rekonstrukce,
integrující SPECT a CT data během rekonstrukce s použitím lokálních
("zónových") CT denzitních map měkkých
tkání, plicních či tukových tkání a kostních tkání.
Tyto zónové CT denzitní mapy vymezují hranice tkání a
jejich koeficienty modulují
("remodelují") primární scintigrafická data
distribuce radioindikátoru. Dosahuje se tím ostřejší hranice
kostních tkání a lézí - za předpokladu že tyto tkáně vychytávají
dané radiofarmakum (např. 99m-Tc fosfonáty). Tato
modulace může též výrazněji zobrazovat diferenciaci mezi
kortikální a houbovitou kostí v obratlích a plochých
kostech, či mezi kůrou a dutinou v dlouhých kostech.
Zjednodušeně řečeno, modulace CT koeficienty dodá SPECT
obrazům distribuce radioindikátoru vyšší kontrast.
Mírné zlepšení kvality obrazů je viditelné,
diskutabilní je zde však modelová závislost..?.. Takto
získané SPECT obrazy je proto při klinickém vyhodnocování
žádoucí zkonfrontovat s obrazy vzniklými klasickou
iterativní rekonstrukcí (příp. zpětnou projekcí).
Výhody
SPECT
Oproti planární scintigrafii má tomografická scintigrafie
SPECT tři výhody :
¨
Přesnější určení anatomické polohy struktur a
jejich tvaru na trojrozměrném obraze, při pohledu z různých
úhlů.
¨
Lepší oddělené zobrazení lézí ležících za
sebou v různých hloubkách.
¨
Potlačením superpozice záření z překrývajících
se vrstev se dosahuje podstatně lepšího kontrastu zobrazení,
což umožňuje citlivější rozpoznávání malých lézí i ve
větších hloubkách.
Nepříznivé vlivy u SPECT a jejich korekce
Jak bylo výše uvedeno, základními výhodami
tomografické scintigrafie je poskytnutí úplného kompletního
obrazu "ze všech stran" (3-rozměrného
obrazu) a podstatně vyšší kontrast
zobrazení lézí vůči tkáňovému pozadí. Zmíníme však i
některé nevýhody a úskalí
scintigrafie SPECT.
Podobně jako u planární scintigrafie, i u
scintigrafie SPECT se vyskytují některé nepříznivé a
rušivé jevy, které mohou zhoršovat kvalitu zobrazení.
Uvedeme zde pět základních nepříznivých vlivů, z nichž
první dva jsou známé i z planární scintigrafie (u metody SPECT se však projevují výrazněji a
poněkud jiným způsobem), poslední tři
jsou specifické pro SPECT (rotační
metodou).

Pozn.: O úskalích a možných chybách korekčních metod zde platí v zásadě totéž, co bylo shora popsáno v pasáži "Chyby a úskalí korekčních metod - korekční artefakty" u scintigrafie obecné.
Použití
scintigrafie SPECT
Tomografická scintigrafie SPECT představuje (oproti planární scintigrafii)
významné doplnění a zdokonalení
geometricko-anatomické informace o distribuci
radioindikátoru v tkáních a orgánech. Používá se
především při scintigrafii perfuze myokardu (§4.9.4 "Scintigrafie perfuze myokardu") a mozku
(§4.9.8 "Perfúzní
scintigrafie mozku"),
jakož i reptorové scintigrafie mozku ("Scintigrafie
receptorových systémů mozku"). I v dalších scintigrafických metodách, jako je
scintigrafie skeletu, či lokalizační nádorová diagnostika,
je tomografické SPECT zobrazení přínosné.
Další významnou možnost,
upřesnění anatomické lokalizace, přináší
fúze SPECT+CT obrazů v dvoumodalitních
kombinacích SPECT/CT (viz níže pasáž
"Fúze obrazů
PET a SPECT s obrazy CT a NMRI"). Scintigrafické obrazy poskytují důležité
informace o funkčním stavu tkání a orgánů, avšak
většinou nejsou schopny dát dostatečnou anatomickou informaci
o přesné lokalizaci patologických abnormalit (lézí)
zobrazených scintigraficky. Do okolních anatomických struktur (např. skeletních), které
radioindikátor nevychytávají, se radioaktivita nedostane a na
scintigrafickém obraze nejsou viditelné. Pro lepší a
názornější porovnávání charakteru, velikostí a lokalizace
zobrazovaných struktur je proto optimální provést simultánní
zobrazení obrazů SPECT+CT nebo PET+CT, kde rentgenové
snímky CT poskytují přesnou anatomickou lokalizaci
vyšetřovaných struktur.
Pozitronová
emisní tomografie PET
Pozitronová emisní
tomografie (PET) je metoda
scintigrafického zobrazení distribuce pozitronových (b+)
radionuklidů, založená na detekci anihilačních
fotonů vznikajících při interakci emitovaných
pozitronů s elektrony v tkáni pacienta, kterému byl aplikován
pozitronový radionuklid. Při radioaktivní přeměně
pozitronového radionuklidu je z jádra emitován pozitron
("kladný elektron"). V látkovém prostředí pozitron srážkami s
elektrony atomových obalů postupně ztrácí energii a klikatě
mění směr pohybu. Po zabrzdění (termalizaci) pozitronu e+ během poměrně krátké dráhy dochází při
interakci s elektronem e-
k jejich vzájemné anihilaci - přeměně
dvojice elektron-pozitron na dva fotony gama o
energiích 511keV, které se od sebe rozlétají z místa
anihilace současně v protilehlých směrech, pod úhlem 180°
*) - viz §1.6, pasáž "Interakce nabitých částic -
přímo ionizující záření ", obr.1.6.1 dole.
*) Toto platí přesně v těžišťové
vztažné soustavě pozitronu a elektronu. Energie fotonů 2´511keV je
důsledkem zákona zachování energie (klidová
energie elektronu i pozitronu je m0e.c2 = 511keV), protilehlý směr 180° je důsledkem zákona
zachování hybnosti. Při srážkách pozitronů a
elektronů vyšších energií by se úhel rozletu anihilačních
fotonů lišil od 180°. V látkovém prostředí však pozitron
a elektron mají v okamžiku, kdy dojde k anihilaci, již
poměrně malé rychlosti, takže emitovaná kvanta vylétají
skutečně téměř opačným směrem, s max. odchylkou +- cca
2,5°. Vliv této úhlové odchylky je diskutován níže v
odstavci "Prostorová
rozlišovací schopnost PET".
Dále, vlastní anihilaci zpravidla předchází vznik
metastabilního vázaného elektron-pozitronového systému pozitronia.
V případě vzniku tzv. ortopozitronia může dojít i
k emisi 3 fotonů g se
spojitým spektrem. Toto lze pozorovat jen u pozitronových
radionuklidů v řídkém plynném prostředí; v relativně
hustém tkáňovém prostředí je tento jev velmi řídký (podrobnosti viz §1.5, část "Elementární
částice a jejich vlastnosti",
pasáž "Pozitronium").
Dráha emitovaného pozitronu v látce (tkáni) je
"klikatá" a závisí na jeho energii. Střední dosah
neboli dolet pozitronu určuje průměrnou
vzdálenost anihilace od místa emise pozitronu, tj. od polohy
beta+ radionuklidu. Pozitrony od místa emise mohou vylétat
izotropně do všech směrů, takže místa anihilace se mohou
nacházet kdekoliv uvnitř koule o poloměru daném doletem
pozitronů. Středním doletem pozitronů je tak limitováno
maximální fyzikálně dosažitelné rozlišení PET (je diskutováno níže v odstavci "Prostorová rozlišovací schopnost PET").
V pozitronové emisní tomografii se využívá koincidenční
detekce dvojice fotonů anihilačního záření gama (o
energii 511 keV), vznikajících při anihilaci pozitronu b+ s
elektronem a vylétajících z místa svého vzniku v protilehlých
směrech - pod úhlem 180°. Této koincidenční - současně nastávající
- detekce dvojice anihilačních fotonů je využito k elektronické
kolimaci záření g a k následné rekonstrukci tomografických
obrazů.
Poznámka:
Ke scintigrafické detekci anihilačního záření může
být v principu použita i klasická scintilační kamera se
speciálním "těžkým" kolimátorem s dostatečně
silnými septy mezi otvory. V tomto režimu se však snímá
vždy jen jeden z dvojice fotonů - jedná se o jednofotonovou
scintigrafii planární nebo tomografickou (SPECT). Detekční
účinnost je zde však velmi nízká (pouze jeden foton + malá
propustnost kolimátorů + nízká absorbce v tenkém krystalu
NaJ(Tl)) a obrazy vzhledem k hrubým kolimátorům mají špatné
prostorové rozlišení (zpravidla horší než 10mm). Tato
scintigrafie se nyní již nepoužívá.
Některé alternativní možnosti, jako jsou
multidetektorové a Comptonovy kamery zmíněné výše, jsou
zatím ve stádiu laboratorních experimentů a jsou využitelné
jen pro scintigrafické zobrazení malých objektů.
Vývoj PET
Základní primární částice používané v PET, pozitrony,
předpověděné P.Diracem v r.1928, objevil poprve C.Anderson v
r.1932 v kosmickém záření (§1.5,
část "Elementární částice a jejich
vlastnosti").
Koincidenční detekci dvojic kvant anihilačního záření z
pozitronových radionuklidů ke gamagrafickému zobrazení poprve
odzkoušeli W.Sweet a G.Brownel ve svém dvoudetektorovém
pohybovém skeneru již koncem 50.let, další pokusné
přístroje PET se konstruovaly na Univ. of Pensylvania, první
prstencové detektory zkonstruovali R.Robertson a Z.H.Cho.
Významnmým impulsem pro rozvoj PET byla syntéza 18-FDG
(fluorem 18 značená glukóza) v r.1970 a zjištění její
akumulace v nádorových tkáních. Počátkem 90.let se PET
gamagrafie začala používat klinicky ve velkých laboratorních
centrech, po r.2000 se čím dál rychleji šířila na klinická
pracoviště nukleární medicíny. U nás bylo první PET
pracoviště vybudováno v r.1999 v Praze v nemocnici Na Homolce.
Po r.2005 se většina PET kamer vyrábí v hybridní
kombinaci s rtg CT zobrazením - PET/CT (příp. s mag.
rezonancí PET/MRI) - srov. §4.6, část "Hybridní
tomografické systémy".
Přístroji PET/CT jsou postupně vybavována všechna komplexní
onkologická centra.
Koincidenční
detekce ® elektronická
kolimace g-záření
Fotony g
vzniklé při e+e--anihilaci mají tři význačné geometrické
vlastnosti:
¨
Vylétají z místa anihilace současně a
protisměrně - pod úhlem 180°;
¨
Pohybují se po přímkových drahách;
¨
Pohybují se rychlostí světla
300000km/s, takže v laboratorních měřítkách mohou být
detekovány prakticky současně.
Tyto vlastnosti umožňují tzv. koncidenční
detekci dvojic anihilačních fotonů: měřený
pozitronový zářič umístíme mezi dva detektory
(dostatečně malých rozměrů), jejichž výstupy zapojíme do
elektronického koincidenčního obvodu. Tímto
obvodem projdou do další elektronické aparatury jen impulsy
odpovídající současné detekci fotonů v
obou detektorech. Vzhledem k uvedeným geometrickým vlastnostem
takto mohou být detekovány jen fotony z anihilací, k nimž
došlo na přímkové spojnici citlivých míst
obou protilehlých detektorů. Nastane-li anihilace mimo tento
prostor spojnice, pak i v případě detekce některého z
fotonů jedním detektorem, není druhý z anihilačních fotonů
zachycen protilehlým detektorem - na výstupu koincidenčního
obvodu se impuls neobjeví. Když se tedy na výstupu
koincidenčního obvodu objeví impuls, známená to, že v
některém z bodů na spojnici obou detektorů nastala e+e--anihilace.
Obklopíme-li vyšetřovaný objekt s
pozitronovým radionuklidem větším počtem protilehle
umístěných detektorů v koincidečním zapojení,
dosáhneme tím cílené směrové detekce
anihilačních g-fotonů - jejich elektronické kolimace,
bez nutnosti fyzického odstínění olověným děrovým
kolimátorem.
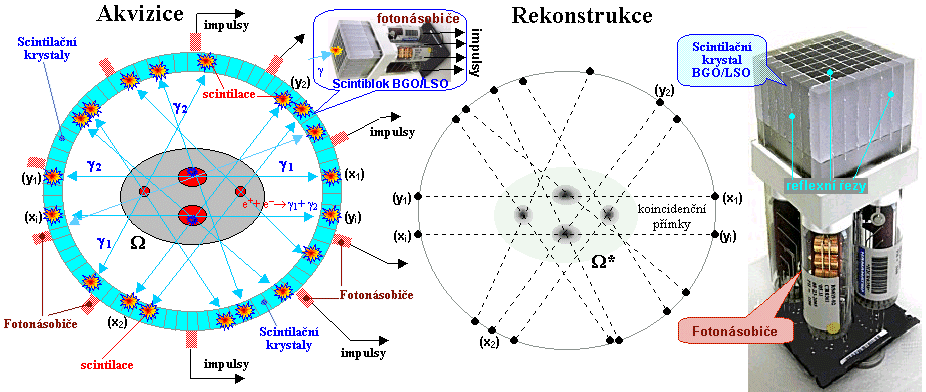
Obr.4.3.5. Princip snímání a rekonstrukce pozitronové emisní
tomografie.
Vlevo: Koincidenční akvizice anihilačních
fotonů g. Uprostřed: Rekonstrukce obrazu. Vpravo:
Scintiblok s pixelovaným krystalem BGO/LSO a 4 fotonásobiči (výrobek Hamamatsu).
Princip snímání PET
Princip PET je schématicky znázorněn na obr.4.3.5. Detektor
scintilační kamery PET má prstencové uspořádání
segmentů velkého počtu malých scintilačních krystalů v
optickém kontaktu s fotonásobiči *), snímajícími záblesky
vzniklé interakcí záření g
. Vzhledem k poměrně vysoké energii
anihilačního záření g 511keV se ve scintilačních krystalech místo
obvyklého NaI(Tl) používá materiál BGO nebo
LSO s větší hustotou a vyšší detekční
účinností v oblasti vyšších energií g - viz
§2.4. "Scintilační detekce a spektrometrie", pasáž
"Scintilátory a jejich
vlastnosti". Průměr detektorového prstence bývá 60-80cm.
*) Jednotlivé scintilační krystaly s rozměry kolem 4x4mm jsou
upevněny do scintibloků (obr.4.3.5 vpravo)
spolu s fotonásobiči, je popsáno níže.
Vyšetřovaný objekt W, v němž je
distribuována b+-radioaktivní látka, je umístěn uvnitř
detekčního prstence PET kamery (obr.4.3.5 vlevo). Dojde-li v
určitém místě k radioaktivní b+-přeměně jádra radioindikátoru, vyzářený
pozitron e+
se po cca 1-3mm (v závislosti na jeho kinetické energii *)
pohybu v tkáni ionizačním brzděním prakticky zastaví a při
interakci s elektronem e- anihiluje: e+
+ e- ® 2g, přičemž obě
kvanta anihilačního záření g1 a g2 o energii 511keV se rozletí v protilehlých směrech
(t.j. pod úhlem 180°), projdou tkání a jsou koincidenčně
zaregistrovány prstencovým scintilačním detektorem
ve dvou místech (úhlech j1 a j2, na obrázku je označeno: j1®x1, j2®y1). Snímací prstenec
detektorů umístěný kolem vyšetřovaného objektu tedy
zaznamená ty fotony, které dopadly ve stejnou dobu na
protilehlá místa prstence. Spojnice těchto míst, tzv. koincidenční
přímka či přímka odezvy, prochází bodem,
v němž došlo k e+ e- anihilaci. Množina těchto koincidenčních přímek
od jednotlivých dvojic detekovaných anihilačních fotonů (xi,yi) pak slouží k rekonstrukci
obrazu distribuce pozitronového radionuklidu ve vyšetřovaném
objektu - na obr.4.3.5 vpravo.
*) Tento dolet pozitronového záření v
tkáni určuje základní mez, pod niž se nelze
dostat s rozlišením PET zobrazení. Pro
nejčastěji používaný 18F činí dolet pozitronů v tkáni asi 0,9mm, což je
podstaně méně, než činí vlastní rozlišení PET-aparatury.
Podrobněji je diskutováno níže v pasáži "Nepříznivé
vlivy u PET".
Rozdíly
PET oproti planární scintigrafii a SPECT
Zásadním rozdílem oproti klasické planární nebo SPECT
scintigrafii je to, že detektory u PET nejsou opatřeny
olověnými kolimátory s mnoha otvory, neboť kolimace
je realizována elektronicky, což vede k podstatně
vyšší detekční účinnosti PET ve srovnání se SPECT (kde
je většina záření absorbována v septech kolimátoru).
Další rozdíl spočívá v tom, že zobrazovací detektor
kamery SPECT se musí otáčet kolem
vyšetřovaného objektu (pacienta), aby byly střádány
parciální projekce pod různými úhly (tak
je tomu u dosavadních SPECT kamer; u nově vyvíjených stacionárních
SPECT kamer probíhá akvizice ze
všech projekčních úhlů současně). U
PET se detektory neotáčejí kolem pacienta,
jsou stacionární - prstencové detektory
střádají data ze všech projekčních úhlů současně.
Výsledný obraz se pak může rekonstruovat průběžně
během akvizice.
Koincidenční PET
dvouhlavými rotujícími kamerami pro SPECT
V polovině 90.let někteří výrobci scintilačních kamer
(jako první firma Adac, dále pak Picker, Elscint,
GE a další) vyvinuli speciální elektronické obvody,
které umožňovaly provádět pozitronovou emisní tomografii i
na běžných dvou-(popř. 3)- hlavých kamerách používaných
pro SPECT. Obě hlavy, umístěné naproti sobě
a bez kolimátorů, rotovaly kolem
vyšetřovaného objektu stejně jako při akvizici SPECT, avšak
impulsy se vedly do speciálního koincidenčního
zařízení, které zaznamenávalo a vyhodnocovalo
impulsy odpovídající současné detekci anihilačních fotonů
511keV oběma protilehlými detektory. Software vyhodnocovacího
zařízení pak prováděl rekonstrukci transverzálních řezů
stejným způsobem jako u PET.
Toto řešení se zpočátku jevilo jako velmi slibné,
neboť by umožňovalo provádět PET i na pracovištích
nevlastnících drahé jednoúčelové zařízení, stačila by
univerzální dvouhlavá SPECT kamera doplněná vhodnou
elektronikou, popř. za použití tlustšího scintilačního
krystalu. Zkušenosti z praktického používání však
ukázaly, že se jedná o řešení sub-optimální,
které detekční účinností ani rozlišením naprosto nemůže
konkurovat jednoúčelovým PET-kamerám s prstencovým
detektorem. Proto výrobci scintilačních kamer od tohoto
řešení brzy ustoupili a nabízejí zvlášť
klasické dvouhlavé kamery pro SPECT a zvlášť kamery PET s
prstencovým uspořádáním detektorů.
Tři typy
koincidencí u PET
Při koincidenční detekci anihilačních fotonů mohou nastat v
zásadě tři případy, kdy dochází k současné
detekci dvou fotonů g :
¨
Pravé koincidence
- přímá detekce dvojic fotonů pocházejících vždy z jedné
e+e--anihilace. Místo
anihilace se nachází přesně na přímce mezi protilehlými
detektory, což při rekonstrukci vytváří obraz distribuce
radioindikátoru. Pro nepříliš vysoké četnosti počet
pravých koincidencí roste prakticky lineárně
s aktivitou v zorném poli, při vyšších četnostech roste
pomaleji vlivem mrtvé doby a při velmi vysokých četnostech
dokonce klesá v důsledku zahlcení náhodnými koincidencemi (paralyzabilní efekt mrtvé doby).
¨
Rozptylové koincidence
- jeden nebo oba současně detekované fotony podlehly Comptonově
rozptylu, což odchýlilo jejich úhel.
Místo anihilace neleží na spojnici detektorů, které které
tuto dvojici fotonů registrovaly. Procentuální podíl
rozptylových koincidencí roste s (elektronovou) hustotou
látkového prostředí a jejich počet opět roste v zásadě
lineárně s aktivitou v zorném poli (podobně
jako pravé koincidence). Pokud dopadne do
některého z detektorů jen jeden z anihilačních fotonů a
druhý po Comptonově rozptylu unikne mimo protilehlý detektor,
není zaznamenána žádná koincidence.
¨
Náhodné koincidence
- jedná se o detekci fotonů g pocházejících z různých anihilací,
které náhodně dopadly do protilehlých
detektorů současně (v rámci časového
rozlišení koincidence). Místo ani jedné z obou anihilací
neleží na spojnici detektorů které je registrovaly. Počet
náhodných koincidencí je úměrný druhé mocnině
aktivity pozitronového zářiče v zorném poli.
Pouze pravé
koincidence vytvářejí správný gamagrafický obraz
distribuce pozitronového radionuklidu. Rozptylové a náhodné
koincidence jsou parazitní (příslušné
koincidenční přímky jsou falešné, neodrážejí
skutečnou distribuci pozitronového radioindikátoru - jedná se
o tzv. kombinatorické pozadí) a zhoršují
kvalitu obrazu - snižují kontrast a zvyšují šum.
Novější typy PET kamer sestávají z
několika souosých vedle sebe řazených prstenců detektorů,
což umožňuje současné snímání několika transaxiálních
řezů; zorné pole v axiálním směru činí u současných
přístrojů cca 15cm. V tomto uspořádání se používají dva
druhy snímání:
Při tzv. 2D-způsobu jsou mezi jednotlivé
detekční prstence vloženy stínící přepážky,
takže koincidenční přímky se snímají z každého
příčného řezu zvlášť - jen v rovině prstenců, kolmo na
osu systému.
Při tzv. 3D-způsobu jsou septa z
detektorů vysunuta a koincidenční snímání probíhá i
"šikmo" ze směrů mezi rovinami jednotlivých
prstenců - vyhodnocují se i koincidence z detektorů v
různých prstencích. Může tak být zachyceno podstatně více
fotonů, t.j. dosaženo vyšší citlivosti. Je
zde však též zvýšená pravděpodobnost náhodných
kioncidencí (viz níže), takže tento způsob lze plně
využít jen u kamer s rychlejšími detektory na bázi LSO
scintilátorů.
Pro zobrazení větších částí těla či pro celotělové
zobrazení jsou PET kamery vybaveny vyšetřovacím
lehátkem s motoricky řízeným posunem.
Výpočetní systém pak nasnímaná data z několika poloh
pacienta při rekonstrukci spojí do jednoho velkého
celotělového tomografického obrazu.
Scintilační detektory pro PET
Scintilační krystaly
Jak již bylo shora zmíněno, při poměrně vysoké energii 511
keV anihilačního gama záření mají obvyklé scintilační
krystaly NaI(Tl) nízkou detekční účinnost. Pro PET jsou
vhodnější scintilační materiály s vyšší denzitou
pro dosažení vysoké detekční účinnosti při ne příliš
velké tloušťce krystalu - aby se v prstencovém detektoru
kamery dosáhlo vysoké detekčné účinnosti a dobrého
prostorového rozlišení lokalizace scintilací soustavou
fotonásobičů. Velmi žádoucí je rovněž krátká
doba trvání scintilace (scintilační dosvit), aby
mohlo být použito úzké koincidenční okénko - vysoké
časové rozlišení pro omezení náhodných
koincidencí (a možnosti použití metody
TOF - viz níže). Pro detekci záření
gama byla syntetizována řada scintilačních materiálů
různých vlastností (viz §2.4, část
"Scintilátory a jejich vlastnosti"). Pro PET je v zásadě
použitelných několik druhů scintilátorů :
| Scintilátor : | NaI(Tl) | BaF2 | LaBr3(Ce) | YAlO3(Ce) (YAP) |
LuPO4(Ce) (LPO) |
Gd2SiO5(Ce) (GdSO) |
Bi4Ge3O12 (BGO) |
Lu2YSiO5(Ce) (LYSO) |
Lu2SiO5(Ce) (LSO) |
Lu Fine Silicate (LFS) |
LuAlO3(Ce) (LuAP) |
| Hustota [g/cm3] | 3,67 | 4,89 | 5,1 | 5,55 | 6,2 | 6,71 | 7,13 | 7,1-7,4 | 7,41 | 7,35 | 8,34 |
| lmax [nm] | 415 | 220/310 | 360 | 350 | 360 | 440 | 480 | 420 | 420 | 425 | 380 |
| scint. dosvit [ns] | 230 | 0,8 | 16 | 30 | 24 | 60 | 300 | 41 | 40 | 33 | 11/28 |
| h [foton/MeV] | 4.104 | 1,8.103 | 6,3.104 | 1,6.104 | 1,3.104 | 8.103 | 6.103 | 3.104 | 3.104 | 3,2.104 | 9,6.103 |
V praxi se používají především těžší
scintilátory BGO, nověji pak LSO
(v příp. modifikaci LYSO), který má výhodu podstatně kratšího
scintilačního dosvitu. Scintilátory LYSO
mají podobné vlastnosti jako LSO; složka ytria
způsobuje technologicky snadnější růst monokrystalů.
Větší procento ytria (vyskytuje se i
LYSO o složení Lu0,6Y1,4SiO5:Ce) však snižuje densitu
a detekční účinnost oproti LSO.
Na bázi LSO byl dále vyvinut scintilátor LFS
(Lutetium Fine Silicate), který má jemnější
krystalovou strukturu a kromě základního lutetia,
křemíku a kyslíku (LSO) s dopujícím Ce, obsahuje i pečlivě
odzkoušené malé příměsi některých dalších prvků jako
je Ca, Gd, Sc, Y, La, Eu, či Tb. Dosahuje se tím poněkud
lepší energetické rozlišení a kratší scintilační dosvit.
Scintilátor LaBr3:Ce5% (je hygroskopický) s velmi rychlou scintilací se zkouší z hlediska TOF (viz níže).
Vnitřní
radioaktivita scintilátorů LSO
Drobnou nevýhodou scintilačních detektorů na bázi lutetia
(jako jsou LSO a LYSO) je vyšší radiační pozadí
v důsledku vnitřní radioaktivity obsažené
ve scintilátoru. Vedle základního stabilního isotopu 175Lu
je totiž v luteriu obsaženo i 2,6% dlouhodobého radioisotopu
176Lu s poločasem rozpadu 3,8.1010let - viz §1.4,
pasáž "Lutetium". Při jeho radioaktivních rozpadech je
emitováno záření beta a gama, které je s vysokou
účinností vnitřně detekováno a v každém detektoru
způsobuje vnitřní radiační pozadí *) asi
40 impulsů/sec./ l gram LSO (podrobnější
analýza byla provedena v §2.4, část "Scintilátory a jejich vlastnosti", pasáž "Vnitřní radioaktivita
scintilátorů LSO"). Záření beta
je plně absorbováno v každém jednotlivém krystalu
nezávisle, takže se při koincidenčním měření neprojevuje
(náhodné koincidence jsou zde zanedbatelé). Promptní
záření gama, zvláště fotony o energiích 300keV, však
mohou z jednotlivých LSO krystalů vyletět a zasáhnout další
detektory, kde mohou být okamžitě detekovány - vznikne tím
koincidenční událost, přispívající k pozadí v PET obrazu.
Takto vzniklé pozadí je zanedbatelně malé vůči tokům
měřeného anihilačního záření řádově 106 fotonů/s při
klinické scintigrafii. Určité problémy ale mohou vznikat u experimentálních
studií PET s nízkými aktivitami řádu jednotek kBq při
dlouhých měřících časech (animální PET).
*) Stojí za zajímavost, že typická PET
kamera, sestávající z cca 190 bloků LSO krystalů o objemu
cca 50cm3,
obsahuje úhrnnou vnitřní radioaktivitu 176Lu asi 2,4 MBq! Každý scintilační detektor o objemu
50cm3
produkuje cca 12500 impulsů/s. radiačního pozadí , což
nezanedbatelně zatěžuje elektronické čítací obvody. Při
koincidenčním měření vyšších aktivit (cca 100 MBq u
pacientů) se to však ve výsledných obrazech prakticky neuplatňuje.
Toto "parazitní" záření však může být
využíváno pro průběžnou kalibraci a ladění PET
detektorů, bez použití fantomových zdrojů.
Fotodetektory pro PET
Pro snímání a elektronickou registraci světelných záblesků
ze scintilačních detektorů se u PET používají dva typy
fotodetektorů :
× Fotonásobiče
jsou nejčastěji používanými a osvědčenými
elektronickými snímači světelného signálu ze
scintilačních detektorů - jsou podrobně popsány v §2.4,
část "Fotonásobiče". Mají vysoké a lineární zesílení, nízký
poměr signál-šum, krátký impuls výstupního signálu
(krátkou mrtvou dobu). Jejich částečnou nevýhodou je
složitost konstrukce, potřeba vysokého napětí, větší
rozměry (nelze je příliš miniaturizovat), vyšší cena,
relativně nízká kvantová účinnost a citlivost na
magnetické pole.
× Polovodičové detektory
jsou moderní alternativou fotonásobičů. Jejich
hlavní výhody jsou: malé kompaktní rozměry (miniaturizace),
vysoká kvantová účinnost, nízké napětí, menší cena,
necitlivost na magnetické pole. Pro snímání scintilací se
používají dva druhy polovodičových fotodetektorů :
- Fotodiody jsou tvořeny p- a n-typem
polovodiče v těsném kontaktu v p-n přechodu. Jsou zapojeny v
inverzní polaritě na napětí (v závěrném směru). Dopadem
fotonu světla jsou excitovány elektron-děrové páry v
materiálu polovodiče, čímž diodou projde proudový impuls.
Při vyšším napětí dochází i k tvorbě sekundárních
elektron-děrových párů a zesílení signálu. Pokud je
elektrické napětí nastaveno těsně kolem průrazného
napětí p-n přechodu, dojde při dopadu fotonu k lavinovitému
nárustu elektron děrových párů - jedná se o lavinovou
fotodiodu (avalanche photodiode), pracující v
tzv. Geigerově režimu.
- Křemíkové "fotonásobiče"
SiPM jsou multipixelové lavinové fotodiody-
multipixelové fotonové čitače, jejichž každý element
pracuje nezávisle v Geigerově režimu. Výstupní signál je
úměrný počtu pixelů, které byly zasaženy fotony, a tedy
počtu fotonů detekovaných v záblesku, mají spektrometrické
vlastnosti (jsou podrobněji popsány v §2.4, část "Fotonásobiče", pasáž
"Polovodičové
fotonásobiče SPM").
Bloky detektorů pro
PET
Scintilační krystaly s fotonásobiči (nebo polovodičovými
fotodetektory) jsou v PET kameře sestaveny do kompaktních scintibloků,
rozmístěných po obvodu kruhového gantry. Každý takový scintiblok
je tvořen čtvercovým 2D polem krystalů (BGO nebo LSO),
spojených s fotonásobiči pomocí světlovodiče - obr.4.3.5
vpravo. Pole krystalů je většinou vytvořeno z jednoho
monokrystalu pomocí řezů vyplněných světlo-odrazivým
materiálem. Obvyklá konfigurace sestává z krystalu rozměru 5´5 cm a tloušťky
3-5 cm, rozřezaného na pole 8´8 dílčích krystalů, k
němuž jsou přes světlovodič přitmeleny 4 fotonásobiče o
průměru cca 2cm (na obr.4.3.5 výřez
nahoře uprostřed, detailněji v pravé části obrázku). Když foton g záření dopadne na jeden z krystalů, vzniklé
scintilační světlo je sdíleno všemi čtyřmi fotonásobiči.
Informace o přesné poloze záblesku
(souřadnice x,y) v poli krystalů se získá elektronickou
analýzou poměru amplitud impulsů na výstupu
jednotlivých fotonásobičů, podobně jako u klasické
planární gamakamery (bylo popsáno výše
v §4.2 "Scintilační
kamera", obr.4.2.1; každý PET
scintiblok lze považovat za jednoduchou "Angerovu
mini-kameru"). Jeden prstenec
(ring) detektoru je tvořen cca 48 scintibloky
uspořádanými těsně vedle sebe v kruhu o průměru cca 60-70
cm (gantry), celá kamera obsahuje 3-5 takových paralelních
prstenců.
Jak bylo shora zmíněno, místo fotonásobičů
mohou scintilace z multikrystalu elektronicky snímat matice
polovodičových fotodiod, či lépe fotonásobičů SiPM.
Blízká budoucnost pravděpodobně patří kompaktním
scintiblokům LSO-SiPM, LYSO-SiPM nebo LaBr3-SiPM. Pro
vzdálenější vývoj v PET jsou pak (místo
scintibloků BGO/LSO s klasickými fotonásobiči nebo SiPm) perspektivní multipixelové plně
polovodičové detektory (např.
na bázi CZT). Vedle lepší detekční
účinnosti a prostorového rozlišení se tím může dosáhnout
i poněkud kratší koincidenční doba (pro
lepší TOF). Zatím se experimentálně
zkouší na menších modelech PET. Výhodou polovodičových
detektorů je též jejich nezávislost na magnetickém
poli, což umožňuje použití v hybridních systémech
PET/MR.
Rekonstrukce obrazů PET
Během akvizice se nasnímá velké množství souřadnic
koincidenčních přímek (řádově miliony koincidenčních
detekcí); data jsou ukládána ve formě tzv. sinogramů.
Počítačovou rekonstrukcí těchto
přímkových průmětů koincidenčních míst se vytvářejí obrazy
příčných řezů a z množiny transverzálních
řezů pak počítačovou reorientací lze vytvořit řezy pod
libovolnými úhly, příp. prostorové 3-rozměrné obrazy
podobně jako u SPECT. Při rekonstrukci se používá buď
metody (filtrované) zpětné projekce, která
však může produkovat hvězdicové artefakty kolem pozitivních
lézí, nebo výpočetně náročnější iterativní
rekonstrukce, poskytující kvalitnější obrazy bez
těchto artefaktů. Další výhodou iterativní rekonstrukce je
možnost zakomponovat různé vlastnosti konkrétních
přístrojů a metod (jako je homogenita, atenuace, šum,
rozlišení) přímo do rekonstrukční procedury. Běžné
rekonstrukční metody, analogické jako u SPECT, byly popsány
výše v pasáži "Počítačová rekonstrukce SPECT".
................?doplnit speciální
modifikace rekonstrukčních procedur ?........
Zobrazovací vlastnosti
PET
Oproti klasické jednofotonové planární a SPECT scintigrafii
má dvoufotonová koncidenční tomografie PET dvě základní přednosti:
podstatně vyšší detekční účinnost
(citlivost) a poněkud lepší prostorové rozlišení
:
Detekční účinnost (citlivost)
PET
Absence klasických kolimátorů a registrace fotonů
anihilačního záření současně ze všech směrů,
s využitím elektronické kolimace, vede k podstatně
vyšší detekční účinnosti (citlivosti) gamakamer
PET ve srovnání s klasickými Angerovými kamerami, kde
naprostá většina emitovaných gama fotonů není detekována (letí "do prázdna" nebo je pohlcována v
septech kolimátorů).
Detekční
účinnost či citlivost h
přístrojů pro detekci a spektrometrii ionizujícího záření
je obecně poměr mezi počtem detekovaných impulsů a počtem
přicházejících kvant záření, zavádí se relativní
a absolutní účinnost, často se vyjadřuje v %
(byla definována a fyzikálně
diskutována v §2.1, část "Obecné fyzikální a přístrojové vlivy při
detekci a spektrometrii",
pasáž "Detekční účinnost a citlivost"). U gamakamer, kde zdrojem gama záření je použitý radionuklid,
se citlivost - detekční účinnost - většinou kvantifikuje
jako počet impulsů detekovaných kamerou za jednotku času [za
sekundu] - cps, vztažený na jednotku
aktivity [kBq, MBq] použitého radionuklidu v
zobrazovaném zdroji; pro planární/SPECT scintigrafii je to
většinou 99mTc, u PET je to 18F. Jen vyjímečně se vyjadřuje v % (detekční účinnost-citlivost u klasických gamakamer
je diskutována v §4.5, pasáž "Citlivost (účinnost detekce)
scintilační kamery").
Detekční účinnost -
citlivost - PET kamery je určena několika fyzikálními,
geometrickými a technickými faktory, které lze rozdělit do
dvou kategorií :
l
Detekční
účinnost hd anihilačního záření 511keV v detekčních elementech prstence PET. Tato
"fyzikální" detekční účinnost hd prstencově
uspořádaných detektorů závisí na tloušťce
detekčního materiálu h, jeho hustotě
a atomovém čísle - přes lineární součinitel
zeslabení m pro gama 511keV je dána koeficientem (1-e-m.h) (detekční účinnost scintilačních detektorů je
rozebíraná v §2.4 "Scintilační detekce a spektrometrie
záření gama", pasáž "Scintilátory a jejich vlastnosti"; scintilační materiály vhodné pro gama 511keV
byly diskutovány výše v pasáži "Scintilační detektory pro PET"). Dále závisí na
nastavení okénka amplitudového analyzátoru, scintilačním
dosvitu a mrtvé době. Ve větších vzdálenostech od středu
se dále projevuje mírné snížení detekční účinnosti v
důsledku šikmého úhlu dopadu větší části
anihilačních fotonů na detektory. Všechny tyto ostatní
individuální vlivy zahrneme do faktoru f.
V našem případě koincidenční dvoufotonové
detekce PET ve dvou protilehlých detektorech s
detekční účinností hd bude výsledná detekční účinnost dána
součinem hd.hd, tj. vystupuje v kvadrátu
hd2 = [f . (1 - e-m.h)] 2.
l
Geometrická
účinnost hg
PET registrace anihilačních fotonů 511keV je dána
prostorovým úhlem projekce, pod nímž jsou
detekovány anihilační fotony ze zdroje aktivity. Každý
radionuklidový zdroj emituje záření izotropně
do všech směrů - do prostorového úhlu 4p. Kolem bodového zdroje,
umístěného uprostřed detekčního prstence poloměru R,
si můžeme vytyčit myšlenou kulovou plochu o tomto poloměru R
- její plochou 4pR2
budou procházet všechny fotony emitované ze
zdroje (kdyby byly detektory rozmístěné
nahusto na této kulové ploše, byla by geometrická detekční
účinnost 100%).
Kruhovým detekčním prstencem šířky S, který má
plochu 2pR.S, však z tohoto celkového počtu projde jen část
fotonů, daná poměrem ploch 2pR.S/4pR2 = S/2R. Má-li PET kamera N paralelních
prstenců šířky S a poloměru R, bude
geometrická účinnost hg = N.S/2R (pokud zanedbáme mezery mezi detektory a poněkud
šikmé úhly od středu k periferním prstencům). Zvětšením průměru prstence 2R se zmenší
celkový projekční prostorový úhel a tím i geometrická
účinnost. S rotoucím počtem N detekčních prstenců v
PET kameře se naopak zvětšuje projekční úhel a tím i
geometrická detekční účinnost.
Vynásobením těchto dvou
dílčích faktorů detektorové a geometrické
účinnosti můžeme získat výsledný vztah pro celkovou
detekční citlivost h PET kamery :
h = [f
. (1 - e-m.h)] 2 .
N . S/2R ,
kde f je frakce detekovaných fotonů ve fotopíku s
konkrétním nastavením okénka PHA analyzátoru (s příp. úhlovou závislostí v periferních
částech), h je tloušťka
detektorů, m je lineární součinitel zeslabení použitého
materiálu detektorů pro záření gama 511keV (většinou BGO či LSO m=....), R je poloměr detekčního prstence, S
je jeho šířka, N je počet detekčních prstenců.
Současné standardní PET kamery se třemi
detekčními prstenci průměru cca 70cm, každý tvořený 48
scintibloky BGO/LSO 5x5 cm a tloušťky cca 5cm, dosahují detekční
citlivost kolem 7-10 cps/kBq 18F (u klasických Angerových planárních či SPECT kamer
činí detekční citlivost jen cca 0,04-0,3 cps/kBq
99mTc,
podle použitého kolimátoru - tedy téměř 30-100 krát
nižší).
Prostorová rozlišovací schopnost PET
Nahrazení mechanických kolimátorů
elektronickou kolimací, vede též k poněkud lepšímu
prostorovému rozlišení PET oproti klasickým
Angerovým kamerám.
Prostorová rozlišovací schopnost
(zkráceně rozlišení) scintigrafického zobrazení je nejmenší vzdálenost [mm] dvou
bodových radioaktivních zdrojů v zobrazovaném předmětu,
které jsou na scintigrafickém obraze od sebe ještě
odlišitelné jakožto dva obrazy. Můžeme ji stanovit jako šířku profilu PSF v obraze bodového nebo čárového
zdroje v polovině maximální výšky profilu, přepočítanou
na prostorové měřítko v předmětu [mm] - označuje se
zkratkou FWHM (Full
Width at Half Maximum - celková šířka v polovině
maxima; rozlišovací schopnost u klasických gamakamer je
diskutována v §4.5, pasáž "Prostorové rozlišení").
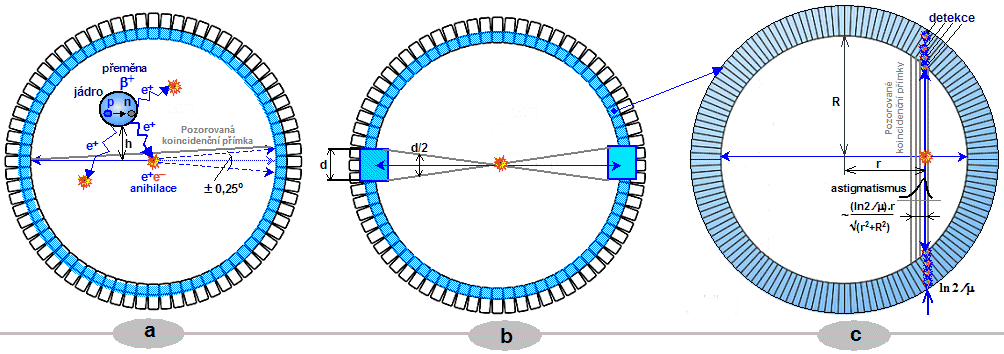 |
||
| Obr.4.3.6. Fyzikální a
geometrické vlivy na polohovou rozlišovací schopnost
při PET zobrazení. a) Dolet pozitronů h v tkáni (je vyznačen příklad tří doletů v různých směrech - silně zvětšeno) a odchylka letu anihilačních fotonů od 180°. b) Projekčně-geometrická degradace rozlišení vlivem šířky d detektorů. c) Prozařování anihilačních fotonů mezi detekčními elementy způsobuje radiální "astigmatismus" v obrazech periferních částí. |
Prostorová rozlišovací schopnost PET
zobrazení je opět určena kombinací několika fyzikálních,
geometrických a technických faktorů :
¨ Dolet pozitronů v tkáni před anihilací s pozitronem představuje primární
fyzikální limit pro rozlišení PET. Pozitrony jsou
emitovány z jader vysokou rychlostí - kinetickou energií
stovky keV až několik MeV, takže z místa depozice
radionuklidu pozitrony doletí v tkáni do
určité vzdálenosti (cca 0,5mm-6 mm,
podle radionuklidu), než se zabrzdí (termalizují) a při setkání s
elektrony (přes pozitronium) anihilují na dvojici fotonů 511keV. Jelikož tedy
pozice, ve které vznikají anihilační fotony, jsou poněkud
odlišné (a pokaždé jiné) od polohy původních mateřských jader, dochází k
určitému rozmazání polohy. Velikost tohoto
rozostření závisí na použitém pozitronovém radionuklidu -
na maximální a hlavně střední energii emitovaných
pozitronů, určující jejich střední dolet h v
tkáni (obr.4.3.6a). Pro některé
používané pozitronové radionuklidy činí:
....... tabulka ..............
¨ Úhlové rozmazání v důsledku neúplného zabrzdění pozitronů.
K elektron-pozitronové anihilaci v tkáni pak dochází s
určitou zbytkovou kinetickou energií (pokaždé jinou), takže v
laboratorní vztažné soustavě bude úhel vyzáření
anihilačních fotonů mírně odlišný od 180°, v průměru o
+- 0,25°. Tato úhlová nejistota - variabilita způsobuje
drobné geometrické rozmazání, které je
úměrné poloměru R detekčního prstence, s hodnotou 0,004.R.
¨ Velikost detektorů - šířka d detekčních prvků je dominantním faktorem projekčně-geometrické
degradace rozlišovací schopnosti. Protilehlé
detektory konečných (nenulových) rozměrů detekují záření
nejen z jediné (středové, osové) koincidenční přímky, ale z celého kuželu úhlů.
Vede to ke geometrické nejistotě koincidenční přímky
vzhledem ke skutečné pozici anihilace, jejíž pološířka
činí d/2 (obr.4.3.6b).
¨ Přesnost dekódování polohy scintilace v rámci scintibloku detekčních elementů, pomocí
podstatně nižšího počtu fotodetektorů (např.
4 fotonásobiče na 64 detekčních scintilačních elementů). Nepřesnost tohoto dekódování (optického
multiplexování) poněkud degraduje
rozlišení. Pro tento příspěvek byla empiricky zjištěna
hodnota pološířky cca d/3.
¨ Prozařování anihilačních fotonů mezi
detekčními elementy - pronikavé
anihilační g záření 511keV může interagovat s několika
různými (sousedními) krystaly. Může tím vznikat detekovaný
signál i v jiném sousedním krystalu, než na jaký foton
primárně dopadá. Tím se může koincidenční přímka
chybně přiřadit některému ze sousedních detekčních
elementů. K tomuto efektu dochází při dopadu anihilačních
fotonů na detekční elementy v šikmém směru,
což nastává ze zdrojů vzdálenějších od středu (pro zdroje ve středu r=0 se to neprojevuje a projekce
koincidenčních přímek zůstává úzká, daná jen velikostí
detekčního elementu) - obr.4.3.6c. Tyto šikmo dopadající fotony mohou interagovat s
několika různými krystaly, v závislosti na hloubce
průniku do scintilačního materiálu. Radiální
projekce zdroje se tím rozšíří
trigonometrickým faktorem k . r /Ö(r2+R2),
v němž koeficient k je dán hloubkou průniku
anihilačních fotonů do scintilátoru - polovrstvou absorbce
fotonů 511keV v materiálu detektoru h1/2=ln2/m, kde m je lineární
součinitel zeslabení gama 511keV v materiálu
scintilátoru - obr.4.3.6c. Vzniká tím
jakýsi radiální "astigmatismus"*) -
asymetrické rozostřování obrazů periferních zdrojů, více
vzdálených od středu prstence r=0. Pro detekční krystaly
vyrobené ze scintilátorů BGO nebo LSO byla pro koeficient k
změřena přibližná hodnota 12,5 . Tento efekt je dobře
viditelný na obr.4.3.7 vpravo v obrazech a profilech
periferních bodových zdrojů ve vzdálenostech r = 34 a 30 cm,
částečně i pro r=20cm (náznakově se
projevuje již u r=10cm).
*) Je to trochu podobné astigmatismu
v optice - zobrazovací vadě (aberaci) u
spojných čoček, projevující se u objektů ve větších
vzdálenostech od optické osy, nebo u optických systémů
nesymetrických vzhledem k optické ose.
¨ Rekonstrukční algoritmy vytváření výsledných obrazů ditribuce
radioindikátoru pomocí množiny koincidenčních přímek
vykazují drobné chyby a variace. Projevuje se nerovnoměrnost
hustoty koincidenčních přímek vzhledem k
poloze zdrojů uvnitř detekčního prstence, různé druhy
rekonstrukčních algoritmů a filtrací. Při rekonstrukci tak
vzniká určitý společný dodatečný koeficient degradace
rozlišení *), pro nějž bylo empiricky stanoveno rozmezí
cca 1,2-1,5; použijeme zde přibližnou hodnotu 1,3.
*) V tomto fyzikálním rozboru máme na
mysli standardní "klasické" rekonstrukční algoritmy
filtrované zpětné projekce či iterativní
rekonstrukce OSEM. Neuvažujeme zde speciální
rekonstrukční algoritmy se zabudovaným resolution recovery,
konstrukčními úpravami a modelováním PSF či filtracemi
s využitím inverezní MTF s cílem umělého
zlepšení rozlišení. Jde nám zde o ryze fyzikální
vlastnosti zobrazení PET, nikoli o možnosti
jejich dodatečného počítačového vylepšení (které však
může být v praxi užitečné...).
Zmíněné efekty vedou k
několika příspěvkům k odezvové funkci PSF bodového zdroje,
které mají přibližně Gaussovský tvar. Jejich kvadratickým
sečtením (geometrickým
průměrem) pak můžeme získat výsledný
vztah pro celkové prostorové rozlišení PET
zobrazení :
FWHM = 1,3 .
Ö [(d/2)2
+ h2 + (0,004.R)2 + (d/3)2
+ (12,5.r)2/(r2+R2)] ,
kde FWHM je výsledná pološířka odezvové
funkce bodového zdroje, tj. celkové rozlišení,
d je velikost (šířka) detekčního elementu, h
je střední dolet pozitronů, R je poloměr
detektorového prstence kamery PET, r je radiální
vzdálenost zdrojového zářiče od středu prstence (všechny rozměry se uvádějí v milimetrech).
Současné standardní PET kamery se třemi
detekčními prstenci průměru cca 70cm, každý tvořený 48
scintibloky tloušťky 3 cm s detekčními elementy velikosti cca
5x5mm, dosahují ve středu prstence prostorové rozlišení v
transverzálních řezech kolem 4,2-5 mm*) (klasické planární/SPECT kamery dosahují
takového rozlišení pouze těsně u čela kolimátoru; v
praktické scintigrafii, kde vzdálenost - hloubka - lézí
činí kolem 10cm, však rozlišení nelze dosáhnout lepší
než 10-12mm).
*) Malé animální PET kamery o průměru
cca 20cm s detekčními elementy šířky cca 0,5-1mm dosahují
ještě podstatně lepší rozlišení cca 1-1,5 mm.
 |
| Obr.4.3.7. PET obrazy bodových
zdrojů 18F
umístěných v různých vzdálenostech r
od středu detekčního prstence. Analýzou ROI a
profilových křivek těmito obrazy byly změřeny
hodnoty detekční účinnosti h a prostorového
rozlišení FWHM (měřili
jsme na PET kameře GE Discovery IQ na KNM FN
Ostrava). U posledního periferního bodového zdroje ve vzdálenosti r=34cm byla již část jeho obrazu odřezána okrajem zorného pole. Měření bylo provedeno pomocí jednoduchého uspořádání popsaného v práci "Fantomy a fantomová měření", část "Tomografické fantomy", pasáž "Jednoduchý improvizovaný fantom pro měření zobrazovacích vlastností PET kamery". |
Naše měření prostorového rozlišení a detekční citlivosti na PET obrazech bodových zdrojů, umístěných v různých vzdálenostech od středu detekčního prstence, je vyznačeno na obr.4.3.7. Je zde zřetelně vidět efekt radiálního astigmatismu v obrazech a profilech periferních bodových zdrojů ve vzdálenostech r = 34 a 30 cm, částečně i pro r=20cm (náznakově se projevuje již u r=10cm). Z podobných důvodů (v důsledku šikmého úhlu dopadu větší části anihilačních fotonů na detektory) se ve větších vzdálenostech od středu též projevuje mírné snížení detekční účinnosti.
TOF
- časová lokalizace místa anihilace
Shora popsaná základní (konvenční) metoda PET nedává
žádnou informaci o místu anihilace na koincidenšní přímce,
všem pixelům na koincidenční přimce je přiřazena stejná
pravděpodobnost anihilace, obraz je tvořen jen průsečíky
koincidenčních přímek. Zvyšování rychlosti elektroniky a
zavádění detektorů s vysokým časovým rozlišením (jako jsou LSO scintilátory)
však postupně umožňuje využít další důležitý
"informační kanál" anihilačního záření pro PET:
je jím měření tzv. TOF (Time Of Flight)
- doby letu fotonů g z místa anihilace. Tyto
fotony se do protilehlých směrů rozlétají rychlostí světla
c=300000 km/s. Pokud dojde k anihilaci uprostřed koincidenční
přímky "0", jsou oba fotony detekovány přesně
současně. Pokud však došlo k anihilaci mimo střed, ve
vzdálenosti Dx, foton g1 bude mít do
detektoru dobu letu TOF1=x1/c, zatímco druhý foton g2 poletí nepatrně odlišnou dobu TOF2=x2/c - viz obr.4.3.8. Z časového
rozdílu t2-t1 = TOF2-TOF1 pak lze zjistit radiální souřadnici
Dx místa
anihilace na koincidenční přímce: Dx = c.(t2-t1)/2.
 |
Obr.4.3.8 Časová lokalizace místa anihilace x1,x2 na koincidenční přímce elektronickou analýzou diference časů letu anihilačních fotonů DTOF při pozitronové emisní tomografii. |
Má-li koincidenční detekce anihilačního
záření dostatečně krátké časové rozlišení,
může být změřena časová diference mezi
detekcí obou anihilačních kvant g, což umožňuje (aspoň v
principu) stanovit místo na koincidenční přímce Dx, kde došlo k
anihilaci a odkud byly oba fotony vyzářeny *) - obr.4.3.8.
Vnáší se tím do systému dodatečná informace o poloze
odezvy detektoru.
*) Pokud bychom dokázali
měřit časové diference příchodů anihilačních fotonů s
pikosekundovou přesností, stačila by nám tato informace ke
stanovení míst anihilace a dosažení PET zobrazení přimo.
Nebylo by pak ani potřeba provádět rekonstrukci kvantifikací
průsečíků koncidenčních paprsků, ale obraz příčného
řezu by mohl být (v polárních souřadnicích) střádán
přímo. Nejednalo by se zde již o koincidenční
přímky, ale o koncidenční body. K tomu však
zatím nemáme dostatečně rychlou elektroniku a detekční
techniku...
Časové
rozlišení stávajících přístrojů zatím neumožňuje
přesnou TOF lokalizaci míst anihilace, avšak i přibližná
lokalizace místa vyzáření anihilačních fotonů by mohla
umožnit zkrátit úsečku odezvy, zdokonalit rekonstrukční
proceduru a zlepšit poměr signál-šum ve
výsledných obrazech. Obecná analýza poměru signál-šum SNR
ve scintigrafických obrazech a jeho vlivu na rozpoznatelnost
lézí byla provedenena shora v části "Kvalita scintigrafického obrazu -
rozpoznatelnost lézí".
Tam bylo ukázáno, že tento poměr SNR = (A-B)/ÖB, kde A je
počet užitečných impulsů a B je počet impulsů
pozadí. Máme-li při PET na celé koncidenční úsečce délky
D (dané průměrem D=2.R prstence detektorů) celkový
počet impulsů pozadí BD, pak na jejím úseku FWHMTOF, vybraném šířkou okénka délkového rozlišení
TOF, bude tento počet impulsů pozadí zmenšen na BTOF=BD.(FWHMTOF/D), přičemž
počet užitečných impulsů A zůstává stejný; to
platí pro všechny koincidenční přímky. Použití TOF
lokalizace místa anihilace na koincidenční přímce
tedy vede ke zlepšení poměru signálu k šumu
faktorem SNRD/SNRTOF = [D/FWHMTOF]1/2.
TOF nemá přímý vliv na zlepšení
prostorového rozlišení FWHM kamery PET, pokud se obraz PET
rekonstruuje pomocí průsečíků koincidenčních přímek - to
plyne z výše uvedené geometrické analýzy podle obr.4.3.6.
Pouze tehdy, když by se délkové rozlišení FWHMTOF podařilo snížit
na hodnotu několika milimetrů, by rekostrukce PET mohla
probíhat s významným využitím parametru Dx podle obr.4.3.8,
a TOF by tím mělo vliv i na prostorové rozlišení PET (v krajním případě dokonalého TOF by jeho délkové
rozlišení dokonce mohlo být určující pro výsledné
prostorové rozlišení PET - to však zatím
"nehrozí"..!..).
TOF je stále ve stádiu technického vývoje.
Počáteční enthusiasmus se zatím nenaplnil, metoda je spíše
příslibem do budoucnosti pro další generace
PET kamer. U současných typů PET kamer (r.2010-15) s
instalovaným TOF časové rozlišení TOF činí asi 500-600
pikosekund, čemuž odpovídá možnost rozlišení místa
anihilace na koincidenční přímce cca 15-18 cm. Parametr TOF
je v klinické scintigrafické diagnostice zatím jen minimálně
využitelný. Analýza TOF bude relevantní až tehdy,
když se jeho délkové rozlišení z nynějších 15 cm podaří
zlepšit na cca 5-2 cm.
Zlepšení TOF časového rozlišení na méně
než 400 ps lze očekávat zavedením speciálních
scintilátorů (jako je lanthan-bromid LaBr3) a
moderních fotodetektorů (křemíkové fotonásobiče SiPM).
Data se nahrávají a rekonstruují ve formátu LIST-mode,
iterativní rekonstrukční procedury (3D list mode TOF MLEM,
OSEM,...) mají zabudovány speciální korekční algoritmy,
obsahující údaje z kalibračních měření. Zatím však nelze
očekávat "žádné zázraky"..!..
- TOF bude asi ještě dlouho zůstávat převážně fyzikálně-technickou
zajímavostí...
Nepříznivé
vlivy u PET a jejich korekce
Podobně jako u planární a SPECT scintigrafie, i u
PET-zobrazení se vyskytují některé nepříznivé a rušivé
vlivy, zhoršující kvalitu obrazů. Zmíníme zde několik
významnějších nepříznivých vlivů, z nichž první čtyři
jsou známé i z planární a SPECT scintigrafie, další jsou
specifické pro dvoufotonovou PET :
O úskalích a možných chybách korekčních metod zde platí v zásadě totéž, co bylo shora uvedeno v pasáži "Chyby a úskalí korekčních metod - korekční artefakty" u scintigrafie obecné.
Konstrukční provedení gamakamer PET
Základem každé gamakamery PET (pro niž
se vyskytuje i méně vhodný název "PET scaner") je kruhový prstenec detektorů
průměru 60-80cm, registrujících dvojice fotonů
anihilačního gama záření o energii 511keV v koincidenčním
režimu z protilehlých směrů. Prstenec sestává z většího
počtu detektorů (věšinou
scintilačních), jejichž scintibloky
(viz obr.4.3.5 vpravo)
jsou v několika paralelních koncentrických řadách upevněny
na gantry, jehož vnitřním válcovým
"tunelem" projíždí lehátko s pacientem. Pohyb
lehátka je poháněn servomotorkem, zajišťujícím přesný
počítačem řízený posun tak, aby se obrazy
snímané prstenci z jednotlivých částí těla skládaly do
výsledného PET obrazu (někdy i
celotělového), včetně on-line fúze s
RTG obrazy CT.
 |
Obr.4.3.9. Vyšetřovna pozitronové emisní tomografie PET/CT na Klinice nukleární medicíny FN Ostrava. Uprostřed je základní přístroj PET/CT (GE Discovery). Po stranách a na stropě laboratoře jsou instalovány zaměřovací a navigační laserové pointery pro plánování radioterapie. V zadní části vpravo je na stojanu aplikátor kontrastní látky pro CT. |
Současné PET přístroje jsou dvoumodalitní
- PET/CT pro posouzení přesné anatomické
lokalizace zobrazených lézí pomocí fúze s rtg obrazy
CT (příp. PET/MRI pro fúzi s
obrazy nukleární magnetické rezonance).
Vedle PET prstence je na tomtéž gantry
nainstalován i prstenec CT (či MRI), kterým řízeně
projíždí lehátko a současně s PET
zobrazením in-line vytváří u pacienta i obrazy
CT (příp. MRI). Vedle fyziologicko-anatomické korelace
zde obrazy CT poskytují i denzitní mapy pro korekci atenuace
anihilačního záření gama v tkáních u PET.
Zařízení někdy obsahuje i optické zaměřovací a
navigační lasery pro přesnou lokalizaci lézí při vymezování
ROI v rámci ozařovacího plánu s
využitím obrazů PET.
Použití scintigrafie PET
Oblasti klinického využití pozitronové
emisní tomografie v nukleární medicíně jsou dány, podobně
jako u emisní planární a SPECT scintigrafie, především
vlastnostmi příslušných radiofarmak, zde
tedy radiofarmak značených pozitronovými radionuklidy (tyto radionuklidy a radiofarmaka jsou stručně
popsány v §4.8 "Radionuklidy a
radiofarmaka pro scintigrafii"). Nejdůležitější oblastí využití PET je onkologická
diagnostika - zjišťování lokalizace a povahy nádorů,
která činí více než 90% všech PET vyšetření (§4.9.6 "Scintigrafická diagnostika v onkologii" a §3.6, část "Diagnostika
nádorových onemocnění"). Pro posouzení přesné anatomické lokalizace
zobrazených lézí se používá fúze PET s rtg obrazy
CT - dvoumodalitní PET/CT, příp. s
MRI obrazy (PET/MRI).
 |
Obr.4.3.10.
Příklad scintigrafie PET/CT s 18FDG u pacienta s lymfomem. ( PET/CT obrazy
pořídil |
Na obecné rovině se PET velmi dobře
uplatňuje na poli posuzování metabolické aktivity nádorů,
proliferace, hypoxie tkáně, hustoty exprimovaných receptorů v
buňkách.
Konkrétně se zde využívá farmakokinetických
vlastností především 18F-deoxyglukózy FDG (dále též 18FLT, 18F-cholinu), která se selektivně vychytává v
nádorových buňkách se zvýšeným metabolismem sacharidů -
zobrazuje se metabolická buněčná aktivita
tkání (zatímco rtg a ultrasonografie
zobrazuje jen morfologickou stránku).
Maligní nádory se většinou vyznačují hypermetabolismem
glukózy. Tato metoda je proto vhodná i pro monitorování
odezvy nádorové tkáně na terapii, neboť se pomocí
ní zobrazuje metabolicky aktivní nádorová tkáň, na rozdíl
od buněk inaktivovaných; lze tak sledovat terapeutickou
odpověď - "úspěšnost" terapie. Je m.j. schopna
rozpoznat recidivu nádoru od jiných procesů (např. od následků dřívější léčby nádoru), viz §3.6, část "Modulace ozařovacích svazků". Monitorování
terapeutické odpovědi pomocí PET spočívá v porovnávání metabolické
aktivity nádoru před začátken léčby a po aplikaci
terapie. Ke změně metabolismu nádoru totiž dochází dříve,
než ke změně jeho rozměrů, posuzovaných morfologickými
zobrazovacími metodami rentgenovými či sonografickými. PET
lze využít též k detekci zánětlivého procesu
v organismu (§4.9.6 "Onkologická
radionuklidová diagnostika. Scintigrafie zánětů"), v kadiologii pro
diagnostiku viability myokardu (§4.9.4 "Nukleární
kardiologie").
Metabolická
aktivita nádorových lézí se na obrazech PET často
kvantifikuje pomocí hodnot SUV - z obecného
hlediska bylo rozebíráno výše v §4.2 "Kvalita
scintigrafického zobrazení",
pasáž "Kvantifikace
pozitivních lézí - SUV".
Byly tam diskutovány některé fyzikální a biologické
faktory, které mohou zkreslovat absolutní SUV
kvantifikaci a doporučena relativní SUV kvantifikace
pro porovnávání metabolické aktivity lézí u konkrétních
pacientů před a po terapii. U PET zobrazení pomocí 18F-FDG k tomu
přistupuje ještě hladina glukózy v krvi -
jeji zvýšená hodnota snižuje akumulaci FDG, čímž dochází
k podhodnocení SUV.
PET(/CT) se tak stala významnou
funkční zobrazovací metodou při primární diagnostice,
stagingu, posuzování terapeutické odpovědi, vyhledávání
recidivy či re-stagingu řady onkologických
onemocnění. Obrazy PET mohou být též s výhodou
použity pro plánování radioterapie. Podrobněji je diskutováno v §3.6, část "Diagnostika nádorových onemocnění".
U PET scintigrafie s nejčastěji používanou 18F-FDG je problémem fyziologická
proměnlivá (někdy značně
vysoká) akumulace FDG v
řadě zdravých viabilních tkání, především v mozku a
myokardu (viz obr.4.3.10). Pro detekci mozkových metastáz nebo menších
perfúzních defektů myokardu tedy PET s FDG není vhodná.
Nespecifická zvýšená akumulace FDG je pozorovaná i u
zánětlivých procesů, hojení ran, po chirurgických
zákrocích. Zobrazené místo se zvýšeným příjmem glukózy
nemusí být vždy tumorem...
Perspektivní je proto použití dalších
radiofarmak a pozitronových radionuklidů (§4.8,
pasáž "Radionuklidy a
radiofarmaka pro PET") jako je galium 68Ga, zirkonium
89Zr, jód 124I, měď 64Cu (pro PET) a beta- 67Cu (pro terapii), skandium 44Sc (pro PET)
a beta- 47Sc (pro terapii), příp. smíšené
alfa-beta+
terbium 149Tb (pro PET i alfa-terapii). Těmito radionuklidy lze označovat především monoklonální
protilátky pro PET diagnostiku a provádět následnou
biologicky cílenou radionuklidovou terapii - teranostiku
(§4.9, pasáž "Kombinace
diagnostiky a terapie - teragnostika").
Zajímavá alikace PET se v
poslední době objevila v tzv. hadronové radioterapii
(§3.6 "Radioterapie", část "Hadronová radioterapie"), kde ozařování vysokoenergetickými nabitými
částicemi v ozařované tkáni způsobuje m.j. jaderné
reakce, při nichž vznikají pozitronové
radionuklidy. Při ozařování urychlenými
uhlíkovými jádry 12C vzniká i pozitronový radionuklid 11C, jehož distribuci
můžeme zobrazit metodou PET. PET kamerou instalovanou na
ozařovači hadronové radioterapie tak můžeme monitorovat
rozložení dávky v cílové tkáni a v okolí - tzv. in-beam
PET monitoring - a tím kontrolovat
průběh radioterapie (viz obr.3.6.6 v §3.6).
PET se též
používá v neurologii k diagnostice mozkové
činnosti a perfuze. Oblast mozku, která je aktivní, má
zvýšené hromadění radiofarmaka, což může sloužit k
posouzení mozkové aktivity a její souvislosti s některými
psychicko-neurologickými poruchami (m.j. i
u Alzheimerovy choroby). Dále je to
scintigrafická diagnostika zánětlivých procesů
a vyšetření myokardu, kde na základě
konsumpce speciálních pozitronových radiofarmak lze posuzovat perfuzi
a viabilitu myokardu (viz níže
§4.9.4, část "Perfuze myokardu").
Pro klinické
aplikace je velmi důležitá fúzní kombinace PET
scintigrafie s rentgenovým CT zobrazením (anatomickým - §3.2, část "Transmisní rtg tmografie CT"), které poskytuje
vizualizaci morfologických a anatomických struktur s vysokým
prostorovým a denzitním rozlišením. Tyto informace získané
z CT mohou být použity ke zvýšení přesnosti lokalizace,
rozsahu a charakteru lézí zjištěných na obrazech PET.
Rentgenové CT tak doplňuje funkční
informaci, získanou PET s pomocí radiofarmaka, o lokalizační anatomické
informace. U moderních přístrojů je toto realizováno on-line
v dvoumodalitním hybridním PET/CT systému - viz níže §4.6, část "Hybridní
tomografické systémy". Tato kombinace též umožňuje kvalitní korekci na
absorbci (atenuaci) anihilačního g záření v tkáni. V
poslední době se vyskytuje i hybridní kombinace PET/MRI.
Pozitronová
emisní mamografie (PEM)
Metoda PET s použitím vhodných
nádorově akumulujících radiofarmak (většinou
18FDG,
příp. FLT) se přirozeně využívá i v
dignostice karcinomu prsu. Specifické
anatomické poměry prsů a vlastnosti mamárních lézí však
vedly ke snaze vyvinout menší jednoúčelové - dedikované,
optimalizované - PET zobrazovací přístroje, které
by měly vyšší rozlišovací schopnost pro drobné
léze, typické u nádorových postižení prsu. A též kratší
dobu akvizice než u celotělových PET a aplikaci nižší
aktivity radioindikátoru. Byly vyvinuty v zásadě dvě
technická řešení těchto specializovaných přístrojů pro pozitrovou
emisní mamografii PEM :
- První
se svým designem podobá klasické RTG mamografii s kompresí,
jen rentgenka a detektor jsou nahrazeny dvěma plochými
PET zobrazovacími kamerami (na obr.4.3.11 vlevo), mezi něž se vkládá prs s vhodnou kompresí.
- Druhý
systém je prstencový PET detektor kruhově
uspořádaných scintibloků (cca 48), podstatně menších
rozměrů než celotělový PET (O cca 20cm),
většinou jeden prstenec do kterého se zasunují nekomprimovaná
prsa. Prsa visí volně uvnitř detektoru umístěného pod
lehátkem s otvorem, na němž leží pacientka - obr.4.3.11
vpravo.

Obr.4.3.11. Konstrukční provedení přístrojů pro
pozitronovou emisní mamografii PEM.
Vlevo: Kompresní PEM mamograf s
plochými PET detektory. Vpravo: Prstencový
PEM mamograf s volně vloženými prsy bez komprese.
V obou případech se provádí
koncidenční detekce dvojice anihilačních fotonů
protilehlými detektory, s počítačovou rekonstrukcí obrazů
příčných řezů, stejně jako v klasické PET. Výhodou
těchto optimalizovaných PEM přístrojů je lepší
prostorová rozlišovací schopost (cca 2-3 mm),
umožňující detekovat i malé léze v prsou (v případě dobré akumulace i pod 1cm).
I
když malé přístroje PEM jsou podstatně levnější než
velké univerzální (celotělové) kamery PET, metoda
pozitronové emisní mamografie nedoznala většího
rozšíření (na rozdíl od široce
používané RTG mamografiie - §3.2, pasáž "RTG
mamografie"). Jedním z důvodů je pozitronové radiofarmakum s
krátkým poločasem, které je mimo větší pracoviště
nukleární medicíny obtížně dostupné. Slouží jen jako doplňková
metoda k mamografii RTG, sonografické nebo MRI. Pro
zobrazení komplexnějšího rozsahu onemocnění je však
stejně potřeba provést zobrazení PET ve větším rozsahu,
včetně uzlin a příp. metastáz. PEM je specializovaná
okrajová metoda, která se ojediněle používá především v
USA a Japonsku v několika větších komplexních onkologických
centrech...
Specializované PEM přístroje ve světě
dodávají jen dva výrobci: CMR Naviscan, California,
USA a IHEP - GaoNeng Medical Equipment, Hangzhou,
Čína.
| -------------------- fyzikálně-technická zajímavost ------------------- |
Neutrony stimulovaná emisní počítačová
tomografie NSECT
NSECT (Neutron Stimulated Emission Computed
Tomography) je nová (a zatím pokusná) metoda spektroskopického
zobrazení koncentrace některých prvků v organismu s
pomocí interakce neutronů. Na rozdíl od
konvenční emisní počítačové tomografie SPECT (nebo PET)
zde záření gama není vyzařováno radioaktivními isotopy,
ale stabilními isotopy, u nichž je emise g-záření
(charakteristické energie) stimulována
nepružným rozptylem rychlých neutronů,
kterými je analyzovaná oblast zvnějšku
ozařována. Tyto stabilní isotopy mohou být buď přirozenou
součástí vyšetřované tkáně, nebo mohou být zavedeny jako
molekulární indikátory (podobně jako kontrastní látky nebo
radiondikátory), např. metabolickou cestou.

Obr.4.3.12. Princip neutrony stimulované emisní počítačové
tomografie NSECT.
Analyzovaná oblast (vzorek, tkáň) je
ozařována svazkem rychlých neutronů (energie
cca 7-10 MeV) z vhodného kolimovaného neutronového zdroje -
elektronického neutronového generátoru (§1.5, část "Urychlovače", pasáž "Urychlovače jako neutronové
generátory") nebo radioisotopového
zdroje (.....). Tyto
neutrony se srážejí s jádry atomů ozařovaného materiálu,
přičemž dochází v zásadě ke třem druhům interakcí (viz §1.6, pasáž "Neutronové
záření a jeho interakce"). Pro naše účely je důležitý nepružný
rozptyl neutronů, při němž neutron předá jádru
část své kinetické energie a ta způsobí zvýšení jeho
vnitřní energie - excitaci jádra. Při
návratu jádra do původního stavu (deexcitaci vzbuzených
jaderných hladin) se vyzáří foton záření gama o přesně určené charakteristické energii,
dané druhem jádra. Tyto energie sekundárního g-záření z
excitovaných jader se pohybují v rozmezí od desítek keV až
asi do 6 MeV. Spektrometrickou detekcí tohoto g-záření lze
stanovit, jaké prvky jsou zastoupeny (podle
energie linie g) a v jaké relativní koncentraci (podle intenzity -
počtu fotonů v příslušném píku). Gamagrafickou detekcí
(gamakamerou*) lze stanovit prostorovou distribuci
těchto g-emitujících jader. Nebo spektrometrický detektor
může snímat záření gama pod různými úhly.
Počítačovou rekonstrukcí poloh (úhlů) a energií tohoto
neutrony stimulovaného g-záření lze vytvořit 3D mapy (gamagrafické obrazy)
prostorového rozložení koncentrací specifických chemických
prvků ve vyšetřované tkáni.
*) Energie g-fotonů, emitovaných ze
vzbuzených hladin stabilních jader při neutronové excitaci,
je většinou příliš vysoká pro zobrazení
standardními gamakamerami. Jsou to stovky keV až několik MeV
(např. pro 16O je Eg=6MeV, pro 12C je Eg=4,5MeV). Pro takové energie mají kolimátory
gamakamer špatné prostorové rozlišení i světelnost a
používané scintilační krystaly jsou příliš tenké pro
dosažení rozumné detekční účinnosti; rovněž
spektrometrické vlastnosti nejsou dobré. Proto se v
dosavadních experimentálních metodách používají
spektrometrické detektory neposkytující prostorovou informaci,
ale jen energetické spektrum. Informace o poloze analyzovaných
atomů se získává buď rotací detektoru opatřeného
kolimátorem a snímáním z různých úhlů, nebo rotačním
skenováním vyšetřovaného objektu úzce kolimovanými
neutronovými svazky. Při tomto druhém způsobu dráha
neutronového svazku definuje geometricku pozici vyšetřovaných
objemů a spektrometrický detektor snímá integrálně všechny
fotony emitované excitovanými jádry podél dráhy
neutronového svazku (tedy tu část
fotonů, která se do detektoru dostane).
Nežádoucí impulsy pozadí mohou být výrazně zredukovány
použitím koncidenčního zapojení spektrometru, trigrovaného
pulsním režimem neutronového generátoru. Následuje
počítačová rekonstrukce dat z jednotlivých projecí. Takto
vzniklý obraz je v principu vlastně 4-D: pro
každý voxel 3-D obrazu je uložena i informace o energii g-záření ® zastoupení
různých prvků. Volbou konkrétní energie (energetického
okénka) se získává obraz rozložení odpovídajícího
konkrétního prvku.
Pozn.: Pro gamagrafii tohoto tvrdého g-záření lze v
principu použít speciální Comptonovy kamery
(popsané výše v části "Nové a alternativní fyzikální a
technické principy gamagrafického zobrazení", passáž "Gamakamery pro vysoké energie"), které jsou však zatím též
experimentální.
Metodou NSECT lze v zásadě
zobrazit distribuci všech prvků a jejich isotopů, s výjimkou
vodíku (jehož jádra nemají excitované hladiny a proto
nedochází ke stimulované g-emisi) a hélia (které má příliš vysokou
excitační energii 25MeV). Neutrony jsou pronikavé částice,
takže mohou být excitovány a zobrazeny i struktury v hloubce
organismu, s příp. korekcí absorbce (atenuace) primárního
neutronového záření i registrovaného stimulovaného g-záření.
Diagnostický potenciál NSECT je dán skutečností, že
relativní zastoupení různých prvků, včetně stopových, je
rozdílné pro různé druhy tkáně. Jemně se liší též mezi
zdravou a nádorovou tkání. Metoda se zatím zkoušela u
časné diagnostiky nádorů prsu a plic. Kromě laboratorních
experimentů zatím NSECT nebyla realizována,
zůstane asi jen fyzikálně-technickou zajímavostí....
Poznámka:
NSECT má některé analogie a společné aspekty s jinými
metodami neutronové analýzy materiálů, především neutronovou
aktivační analýzou NAA (INAA), popsanou v §3.4,
část "Neutronová
aktivační analýza".
Pro speciální účely biologického výzkumu se ojediněle
používá i neutronová aktivační analýza in vivo:
příslušná část organismu se ozáří neutrony (z reaktoru
nebo neutronového generátoru) a následuje standardní gamagrafické
zobrazení distribuce indukované radioaktivity beta
doprovázené fotony gama, mapující rozložení zkoumané
látky v tkáních a orgánech.
4.4.
Hradlovaná fázová scintigrafie
V našem organismu (jakož i u všech vyšších živočichů) se nacházejí dva důležité orgány, které z
časového hlediska pracují periodicky :
- Srdce, které pravidelnými stahy - systolou
a diastolou srdečních komor a síní - funguje jako
"čerpadlo" zajišťují cirkulaci krve v
organismu.
- Plíce, které svými dýchacími pohyby -
smršťováním a rozšiřováním, nádechem a výdechem
- uskutečňují výměnu vzduchu a okysličování krve
v organismu a odvod oxidu uhličitého.
Tyto periodické děje nejsou přesně pravidelné
a konstantní, jejich frekvence kolísá a
individuálně se liší, podle zdravotního a psychického stavu
a především fyzické zátěže. Srdeční frekvence v
klidovém stavu bývá cca 55-75 pulsů/min., dechová frekvence
kolem 15-20 vdechů/min. Při intenzívní fyzické zátěži
však může stoupnout i na 2-3-násobek - potřeba rychlejšího
přečerpávání krve srdcem a rychlejší výměny kyslíku a
CO2
dýcháním.
Při této periodické činnosti dochází k
poměrně rychlým pohybům jednotlivých
částí srdce a plic vůči sobě i vzhdem k okolním tkáním a
orgánům. Tyto pohyby mohou při scintigrafické diagnostice
působit rušivě - způsobovat pohybové rozmazání
příslušných struktur ve scintigrafickém obraze.
Při scintigrafické analýze vlastních periodických
dějů v organismu však lze této periodicity s
výhodou využít v metodickém přístupu, který se nazývá hradlovaná
či gejtovaná scintigrafie (angl. gate =
brána, vrata, hradlo). Vedle scintigrafických impulsů z
kamery se snímá i další elektrický signál - EKG, či
dechový - který vhodně řídí (spouští, hradluje, gejtuje)
průběh akvizice.
Fázová
scintigrafie rychlých periodických dějů - srdeční činnosti
Dynamická scintigrafie s časem rychle
proměnné distribuce radioaktivity naráží na
principiální fyzikální a technické problémy. Aby byla
věrně zachycena dynamika sledovaného procesu, je nutno
použít co nejlepší časové rozlišení, tj.
vysokou frekvenci krátkodobých snímků. Statistický charakter
radioaktivního rozpadu pak vede ke značným statistickým
fluktuacím měřených impulsů v obraze. Relativní
statistické fluktuace jsou dány výrazem 1/ÖN, kde N je
počet impulsů v obrazové buňce nastřádaný za dobu jednoho
snímku. Při vysokém časovém rozlišení je čas střádání
jednoho snímku velmi krátký (řádu 10-2s), počty nastřádaných impulsů malé a statistické
fluktuace jsou velmi značné *). Východiskem nebývá ani
enormní zvýšení aplikované radioaktivity (to většinou
není možné i z jiných důvodů, především
radiohygienických), protože vlivem mrtvé doby nestačí
detekční zařízení tak rychlý tok impulsů účinně
zpracovávat.
*) Pro věrné zachycení srdeční
činnosti je nutné srdeční cyklus rozdělit na velmi krátké
časové intervaly; jelikož cyklus trvá přibližně 1 sekundu,
střádací doba jednoho snímku by měla být zhruba 0,03
sekundy. Při této extrémně krátké měřící době jsou
statistické fluktuace zaznamenávané četnosti impulsů tak
velké (desítky %), že nedovolují jednotlivé snímky
hodnotit. Na takových snímcích by ani nebylo poznat, o jaký
orgán se jedná - byla by vidět jen sprška chaoticky
rozházených bodů.
Provést podrobnou dynamickou scintigrafii jednoho
srdečního cyklu se tedy na první pohled zdá být zcela
nemožné. Naštěstí zde však jsou dvě příznivé okolnosti:
1. Srdeční činnost je periodickým
dějem (platí to aspoň přibližně) ;
2. Srdeční činnost je doprovázena (resp.
spouštěna) elektrickými signály, které lze
zevně detekovat .
V případě, kdy sledovaný děj je periodický,
tj. distribuce radioaktivity je periodickou funkcí času, je
situace podstatně příznivější. Označíme-li
scintigrafickou odezvovou funkci f(x,y,z,t), kde x,y,z jsou
polohové souřadnice, t je čas, pak pro periodický děj bude
platit: f(x,y,z,t) @ f(x,y,z,t+k.T), k=0,1,2,...., T je perioda ("@" znamená,
že rovnost platí pouze v průměru, až na statistické
fluktuace rozpadu a registrace). Dynamický scintigram takového
děje je pak v principu dán scintigrafickou studií jen jedné
periody (cyklu). A naopak, periodičnost procesu nabízí
možnost vytvořit dynamickou studii jednoho cyklu (periody) s
velmi vysokým časovým rozlišením a zároveň s vyhovující
"statistikou": změříme s vysokým časovým
rozlišením několik set jednotlivých cyklů tak, jak jdou za
sebou, a výsledky pak synchronně složíme (nasumujeme) snímek
po snímku na základě periodičnosti tak, aby vznikla
dynamická studie jen jednoho cyklu:
FN(x,y,z,t) = k=1SN f [x,y,z,t+(k-1).T] , t Î < 0,T ) .
Takto synchronně složenou studii FN(x,y,z,t) budeme nazývat fázovou
dynamickou scintigrafickou studií - jedná se o studii jednoho
"průměrného" či "reprezentativního"
cyklu, složenou z N běžných cyklů periodického
děje.
Toto lze přímo (bez dodatečných informací) provést
pomocí počítače v případě, že perioda T je přesně
známá a konstantní. V praxi však toto není většinou
splněno, např. srdeční frekvence poněkud kolísá. Ze
statisticky silně rozptýlených dat počítač naprosto
"nepozná" jednotlivé fáze periodického děje a
nemá potom tedy podle čeho synchronně skládat. Proto je nutno
do počítače navíc zavádět z vnějšku určité synchronizační
impulsy (značky), které umožňují přesně stanovit
konec jednoho a začátek dalšího cyklu. V případě srdeční
činnosti takovými synchronizačními čili gatovacími impulsy
mohou být signály z EKG (R-vlny), pomocí
nichž počítač "pozná" vždy konec jednoho a
začátek dalšího cyklu.
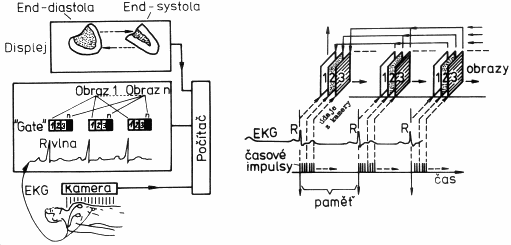 |
| Obr.4.4.1. Vlevo: Schéma vytváření
hradlované fázové dynamické scintigrafie srdečního
cyklu na základě scintigrafických dat z kamery a
synchronizace odvozené od R-vlny EKG. Vpravo: Obrazy z mnoha různých srdečních cyklů se synchronně sčítají tak, že se vytvoří série snímků zachycujících jediný průměrný cykl. |
Princip konstrukce fázové dynamické studie srdečního cyklu je znázorněn na obr.4.4.1. Počítačový program rozdělí časový interval mezi dvěma R-vlnami na krátké intervaly o délce Dt =T/(počet snímků na cykl), kde počet snímků na cykl se volí obvykle 32, někdy 16. Signál odvozený z R-vlny (elektronicky z její náběžné hrany) určuje začátek srdečního cyklu. Impulsy odpovídající počátku srdečního cyklu v intervalu 0 až Dt se zaznamenávají do prvního snímku v paměti počítače. V době od Dt do 2.Dt se impulsy střádají do druhého snímku, v době od 2.Dt do 3.Dt do třetího snímku atd. Stejným způsobem se rozdělí doba trvání dalšího srdečního cyklu, jehož začátek signalizuje počítači další R-vlna z EKG; impulsy registrované během prvního intervalu Dt se přičítají na prvý obraz předchozího srdečního cyklu, impulsy registrované od Dt do 2.Dt se přičítají k druhému obrazu předešlého cyklu atd. Tento proces se mnohokrát opakuje, čímž se v paměti formuje fázová dynamická studie jednoho průměrného srdečního cyklu.
Selekce a vylučování
cyklů
Jak známo, srdeční rytnus není nikdy zcela pravidelný,
tepová frekvence a perioda méně či více proměnná,
může dokonce docházet až k arytmiím. Do výpočtu je třeba
brát jen takové cykly, jejichž perioda se neliší příliš
od průměrné periody. Nepravidelné srdeční cykly, tj.
takové, jejichž doba trvání je jiná než u běžných
pravidelných cyklů, je třeba ze záznamu vyloučit.
Tyto falešné cykly, způsobené extrasystolami nebo jinými
poruchami srdečního rytmu, by zkreslovaly celkovou dynamiku
průměrného cyklu - nejednalo by se již o cyklus
reprezentativní. Meze pro selekci "správných" cyklů
se obvykle volí ±10% T.
Přitom je třeba vyloučit nejen takový nesprávný cykl s
anomální periodou, ale i cykl po něm následující,
neboť nemusí začínat ve správné fázi end-diastoly. Vlivem
mírně kolísající délky cyklu je nastřádaný počet
impulsů v posledních fázových snímcích arteficielně
snížen. Aby to nezkreslovalo dynamiku terminálního úseku
fázových křivek, provádí se příslušná korekce odvozená
od počtu cyklů, které přispěly do jednotlivých fázových
snímků.
LIST-mode akvizice
Shora popsaný způsob akvizice do obrazových matic se někdy
označuje jako frame-mod. U dřívějších
generací akvizičních počítačů, kde nebyla k dispozici
dostatečně velká operační paměť, se používala akvizice v
tzv. LIST-modu: do paměti se střádaly
sekvenčně souřadnice (x,y) jednotlivých
impulsů tak, jak za sebou přicházely. Do tohoto
kontinuálního toku dat se pod vhodným kódováním nahrávaly
i synchronizační impulsy z EKG. Převod do scintigrafických
obrazů (re-framing) a konstrukce vlastní fázové studie se pak
provádělo dodatečně. Výhodou LIST-modu
bylo, že data bylo možno dodatečně re-framovat s různou
selekcí správných cyklů, což má svůj význam u některých
poruch srdečního rytmu (jako je bigimenie), kdy ve frame-modu
nelze správnou fázovou studii získat. LIST-mode byl pro
dynamickou scintigrafii po mnoho let prakticky opuštěný, nyní
se začíná používat u některých iterativních metod
tomografických (§4.3, část "Počítačová
rekonstrukce SPECT",
"Rekonstrukce obrazů PET", "TOF - časová lokalizace místa
anihilace").
First-pass fázová
scintigrafie
Shora popsaná metoda konstrukce fázové dynamické scintigrafie
srdečního cyklu de provádí za situace, kdy krev nesoucí
radioindikátor (např. 99m-Tc značené erytrocyty) je rovnoměrně a ustáleně
rozmíchána v krevním řečišti - tzv. stady-state
metoda. Zmíníme se stručně o konstrukci fázové scintigrafie
srdečního cyklu metodou first-pass (první
průtok), kdy se radioindikátor aplikuje do oběhu jako
kompaktní bolus. Akvizice z kamery do paměti
počítače se spustí v okamžiku příchodu bolusu do srdeční
komory a ukončí se před nástupem recirkulace (kdy by
docházelo již k překrytí struktur).
 |
Obr.4.4.2. Konstrukce fázové dynamické studie srdečního cyklu při radionuklidové ventrikulografii first-pass. "Rozpulzovaná" křivka představuje časový průběh radioaktivity v levé komoře během prvního průtoku bolusu. |
Na obr.4.4.2 je znázorněn časový průběh
radioaktivity v levé srdeční komoře při takovém měření.
Křivka je "rozpulzována" vlivem periodického
naplňování a vyprazdňování komory krví nesoucí
radioaktivní bolus. Konstrukce fázové dynamické studie
srdečního cyklu se zde provádí podobným způsobem jako u
metody steady-state, avšak do výpočtu lze vzít jen několi
málo cyklů - počínaje příchodem bolusu do levé komory a
konče nástupem recirkulace, kdy by docházelo již k překrytí
obrazů komor.
Výhodou metody first-pass je, že radioaktivita je obsažena
pouze v komoře, takže jednak odpadá problém korekce na
tkáňové a krevní pozadí, jednak umožňuje scintigrafický
"pohled" na srdeční komoru i z takových směrů,
při nichž by u steady-state metody docházelo k překrytí
obrazů pravé a levé komory a popř. i dalších struktur.
Hlavní nevýhodou first-pass metody oproti metodě steady-state
je malý počet cyklů, z nichž je fázová studie vytvořena;
kvalita snímků vzhledem ke statistickým fluktuacím nebývá
proto příliš dobrá. Kromě toho taková studie nemusí
představovat reprezentativní srdeční cyklus, neboť selekce
"správných" cyklů zde není proveditelná a akvizice
se provádí těsně po injekční aplikaci radioindikátoru, kdy
centrální hemodynamika bývá ovlivněna stresem. Z
kvantitativních parametrů lze proto objektivně hodnotit
nanejvýš jen ejekční frakci. Metoda first-pass se pro
konstrukci fázové scintigrafie srdečního cyklu nyní
používá již jen zřídka. Používá se jen při bolusové
radiokardiografii (§4.9.4, část
"Dynamická bolusová angiokardiografie").
Metoda fázové (hradlované) scintigrafie se prakticky výhradně používá v nukleární kardiologii (§4.9.4 "Nukleární kardiologie"). Je to jednak radionuklidová ventrikulografie (§4.9.4, část "Rovnovážná hradlovaná ventrikulografie"), jejíž komplexní analýza programem VENTR je popsána v §3.1 "Radionuklidová ventrikulografie" knihy "OSTNUCLINE - Komplexní vyhodnocování scintigrafie", v posledních letech pak především SPECT perfuze myokardu (gated myocard SPECT - §4.9.4, část "Scintigrafie perfuze myokardu").
Autorská
poznámka:
Výzkumem a vývojem metod scintigrafických fázových
dynamických studií s vysokým časovým rozlišením jsme se na
našem pracovišti zabývali od r.1976, prakticky souběžně s
vývojem těchto metod v předních laboratořích ve světě.
Bylo zkonstruováno elektronické zařízení pro detekci R-vlny
a implantaci synchronizačních impulsů do počítače. Na
malém počítačovém zařízení Clincom (operační
paměť pouhých 12k!) jsme vyvinuli program pro rekonstrukci a
matematické vyhodnocení radionuklidové ventrikulografie,
který byl v té době patrně nejkomplexnějším postupem v
této oblasti; sloužil pak jako základ pro komplexní program
VENTR ("Radionuklidová
ventrikulografie") na přístroji GAMMA-11 a
později na PC, systém OSTNUCLINE. Pro tyto výzkumné a
vývojové práce bylo též zkonstruováno několik dynamických
fantomů (počínaje rotujícím gramofonovým kotoučem a konče
flexibilním dynamickým fantomem srdeční pulzace i oběhového
čerpání); některé z nich jsou popsány v práci "Fantomy a
fantomová měření v nukleární medicíně", část. 4. "Dynamické fantomy".
4.5.
Fyzikální parametry scintigrafie - kvalita zobrazení a
fantomová měření -
Úkolem scintigrafie je poskytnout
kvalitní, tj. objektivní, podrobné
a přesné zobrazení distribuce radioaktivity
ve zkoumaném objektu, a to jak z prostorového
hlediska, tak i z hlediska časového (u
dynamické scintigrafie). Výše jsme zmínili několik omezení
a nepříznivých vlivů fyzikálního a
technického charakteru, která omezují
možnosti a kvalitu scintigrafického zobrazení ("Nepříznivé vlivy u scintigrafie"). Pro posouzení kvality
scintigrafického zobrazení, jeho optimalizaci a odhalení
případných chyb a poruch, je potřeba analyzovat
a testovat fyzikální vlastnosti
scintilačních kamer. Jako u každého složitého měřícího
přístroje, i u scintilační kamery lze její vlastnosti popsat
několika fyzikálními parametry :
Prostorové rozlišení gamakamery
Scintilační kamera je přístroj zobrazovací,
takže nejdůležitějším jejím parametrem je rozlišovací
schopnost, neboli prostorové či
polohové rozlišení (udávané v
délkových jednotkách - milimetrech) :
| Prostorové rozlišení |
| Prostorovým rozlišením scintigrafického zobrazení nazýváme nejmenší vzdálenost [mm] dvou bodových radioaktivních zdrojů ve zobrazovaném předmětu, které jsou na scintigrafickém obraze od sebe ještě odlišitelné jakožto dva různé objekty. |
| Ekvivalentní definice : |
| Prostorovou rozlišovací schopností rozumíme šířku profilu FWHM v obraze bodového nebo čárového zdroje v polovině maximální výšky tohoto profilu, přepočítanou na prostorové měřítko v předmětu [mm]. |
Prostorové rozlišení se tedy dáno pološířkou profilu obrazu bodového nebo čárového zdroje; označuje se jako FWHM (Full Width at Half Maximum - celková šířka v polovině maxima). Dva bodové zdroje záření můžeme na scintigrafickém obraze od sebe odlišit jen tehdy, pokud je mezi nimi vzdálenost minimálně FWHM - obr.4.5.1 :

Obr.4.5.1 Prostorová rozlišovací schopnost
scintigrafického zobrazení - analýza obrazů
bodových zdrojů, které se zobrazují jako
"rozmazané" rozptylové kroužky.
a) "Rozmazaným" obrazem
bodového zdroje vedeme profilovou křivku PSF
(Point Spread Function), její pološířka FWHM
udává rozlišovací schopnost zobrazení. b,c,d,e)
Obrazy dvou bodových zdrojů umístěných v různých
vzdálenostech od sebe. Pokud je tato vzdálenost větší než
FWHM, jsou tyto zdroje zobrazeny jako dva oddělené objekty.
Při přiblížení na vzdálenost rovnou FWHM a menší již oba
obrazy splývají v jeden - zdroje se pak od sebe již nedají
rozlišit. g) Schématické
znázornění prolínání, superpozice a splynutí obrazů dvou
blízko sebe ležících bodových zdrojů (na profilových
křivkách PSF) - odpovídá situaci podle obr. e).
Pozn.: Bylo měřeno s bodovými zdroji
průměru cca 1mm, 50MBq 99mTc, na kameře Nucline MB9201 tesně u čela kolimátoru
HR, matice 256x256, zoom 2x, se silně zvětšenými výřezy obrazu, cca 4x. Mírné deformace
kruhového tvaru obrazů bodových zdrojů byly způsobeny
drobnými geometrickými nepravidelnostmi otvorů kolimátoru HR (které jsou při tomto velkém zvětšení vidět, ale
při praktické scintigrafii se neprojevují).
Kromě FWHM se rozlišení kamery někdy
charakterizuje ještě i parametrem FWTM (Full Width at Tenh Maximum),
což je šířka profilu obrazu čárového zdroje v desetině
maximální výšky profilu. Tato hodnota vychází samozřejmě
vyšší: za situace bez rozptylujícího
prostředí bývá přibližně FWTM @ (1,8 - 2)´FWHM, za
přítomnosti tkáňového (či vodního) rozptylujícího
prostředí pak je zhruba FWTM @ (2 - 2,5)´FWHM.
Prostorové
rozlišení FWHM <--> modulační přenosová funkce MTF
Je třeba upozornit, že hodnota FWHM stanovená s PSF či LSF nemusí
zcela objektivně vystihovat kvalitu zobrazení z hlediska
rozlišovací schopnosti! Rozptýlené záření a prozařování
septy kolimátoru rozšiřuje především dolní část
PSF, nižší než 50% (viz obr.4.3.3d,e a
obr.4.5.4e), takže na hodnotě FWHM se
nemusí projevit. Pro zcela detailní fyzikální analýzu
rozlišovacích vlastností zobrazovacích systémů se
používají tzv. modulační přenosové funkce
(MTF) - viz práci "Teorie scintigrafického zobrazení a modulační
přenosové funkce", které berou
v úvahu všechny body PSF.
Terminologická poznámka:
Prostorová (polohová) rozlišovací schopnost gamakamery se
někdy zkráceně nazývá jen rozlišení.
Nezaměňovat prosím se spektrometrickým energetickým
rozlišením (....) nebo s časovým
rozlišením (jak se někdy nazývá mrtvá doba
detektoru "Mrtvá doba detektorů") - je to úplně něco jiného..! .
Prostorová
rozlišovací schopnost klasické jednofotonové gamakamery -
planární, SPECT - je dána dvěma složkami :
1. Geometrická
rozlišovací schopnost kolimátoru Rkolim ,
která závisí na průměru otvorů d, a
délce otvorů - kanálků L daných
výškou (tloušťkou) kolimátoru, výrazně též na vzdálenosti
h zobrazovaného objektu od kolimátoru :
Rkolim ~ d . [1 + (h+m)/L]
, (4.5.1)
kde m je ještě šířka mezery mezi zadním čelem
kolimátoru a krystalem kamery (jeho
středem) - obr.4.5.2a. Rozlišovací
schopnost kolimátoru se projevuje tím, že každý bod (bodový
zdroj) v předmětu se na detektor kamery geometricky promítá
jako malá rozmazaná kruhová stopa o průměru
závislém na Rkolim - obr.4.5.2b.
 |
|
| Obr.4.5.2
Dvě základní složky prostorové rozlišovací
schopnosti gamakamery - kolimátor a
krystal+fotonásobiče. a): Trigonometrická analýza rozlišovací schopnosti kolimátoru. Z každého otvoru paralelního kolimátoru si můžeme nakreslit pomyslný kužel vymezující oblast, ze které záření gama může projít tímto otvorem do detektoru kamery (záření z míst mimo tento kužel je pohlceno olověnými septy kolimátoru). Se vzdáleností od kolimátoru se tento detekční kužel rozšiřuje, čímž se zhoršuje geometrické prostorové rozlišení obrazu, promítaného kolimátorem na scintilační krystal gamakamery. b): Rozlišovací schopnost kolimátoru se projevuje tím, že každý bod (bodový zdroj) v předmětu se na detektor kamery geometricky promítá jako malá rozmazaná kruhová stopa o průměru závislém na vzdálenosti od kolimátoru. c): Přibližné znázornění vnitřního rozlišení detektoru kamery, souvisejícího se statistickými fluktuacemi detekovaných scintilací, rozmazávajícími souřadnicové impulsy X,Y a s Comptonovým rozptylem gama fotonů. d): Zobrazení bodového zdroje 99mTc v různých vzdálenostech h od čela kolimátoru HR - degradace rozlišení FWHM se vzdáleností.. |
|
Prostorové rozlišení kolimátoru se
zlepšuje se zvyšováním délky otvorů - kanálků (tloušťky
kolimátorů) a snižováním průměru otvorů. Lepší
rozlišení (a zároveň s menší
závislostí na vzdálenosti) mají
kolimátory s malými a delšími otvory. Prostorová
rozlišovací schopnost gamakamery se výrazně zhoršuje
se vzdáleností *) zobrazované struktury od čela
kolimátoru (obr.4.5.2b,d a obr.4.5.6
vlevo). Gamakamera (čelo kolimátoru) by proto měla
být přiložena co nejblíže povrchu těla
pacienta.
*) U kolimátorů s jiným
uspořádáním otvorů (popsanými výše
v §4.2, část "Scintigrafické kolimátory") je geometrická situace
složitější, avšak v zásadě platí stejné pravidlo zhoršování
prostorového rozlišení při větší vzdálenosti
od čela kolimátoru - obr.4.5.6 vlevo.
Prozařování
septy kolimátoru
Pro správnou zobrazovací funkci kolimátoru je potřeba, aby
gama záření procházelo pouze otvory, zatímco přepážky
mezi nimi by záření nepropouštěly. To však nelze 100-%
splnit, určitá část záření proniká i přes septa.
Zvláště u vyšších energií gama může docházet k prozařování
záření gama septy kolimátoru, pokud jsou tyto přepážky
mezi otvoty tenší než je optimální pro použitou energii
gama. Prozařování septy zhoršuje kontrast
scintigrafického zobrazení. Pokud bychom nízkoenergetický
kolimátor LEHR, optimalizovaný pro 140keV 99mTc, použili pro scintigrafii s 111In nebo dokonce s 131I, dostali bychom obraz se značně zdegradovaným
kontrastem! Efekt prozařování septy a jeho vliv na kvalitu
scintigrafického zobrazení je analyzován na obr.4.5.3 :

obr.4.5.3 Prozařování fotonů gama septy kolimátoru a jeho
vliv na kvalitu scintigrafického obrazu.
a) Schématické znázornění abrorpce
nízkoenergetického záření gama v olověných septech mezi
otvory kolimátoru a částečné prozařování
vysokoenergetického gama přes septy kolimátoru. b)
Prozařování fotonů vyšší energie septy kolimátoru
způsobuje rozšíření okrajových částí obrazu bodového
zdroje (červená část křivky PSF). c),d),e)
Obrazy bodových zdrojů radionuklidů emitujícících různé
energie záření gama - 99mTc (140keV), 111In (245keV), 131I (364keV), nahrané s kolimátorem LE HR pro nízké
energie. f) Fantom Jasczak, naplněný 111In a zobrazený
gamakamerou s kolimátorem Medium Energy (nahoře) a s
nízkoenergetickým kolimátorem LE HR (dole). Prozařování
septy LEHR zde zcela degraduje kontrast obrazu - téměř
nehodnotitelný scintigram.
Pozn.: Typický
"hvězdicovitý artefakt" diagonálního prozařování
je způsoben geometrickou konfigurací otvorů a olověných
přepážek, které se v diagonálním směru promítají
poněkud užší. Pro různé druhy kolimátorů může být tvar
tohoto artefaktu poněkud odlišný, podle detailů
geometrického provedení otvorů a přepážek.
Podíl záření, proniklého přepážkou mezi
otvory - transmisní faktor, činí e-m.stran, kde m je lineární absorpční koeficient materiálu
kolimátoru (olova) pro požadovanou energii gama a stran je nejkratší
dráha, kterou může gama záření proniknout přepážkou z
jednoho ovoru do sousedního otvoru. Pro kolimátor s průměrem
otvorů d, jejich délkou L a tloušťkou
přepážek s,
je nejkratší dráha prozařování přepážkou stran = s.L/(2d+s), takže transmisní faktor
je e-m.s.L/(2d+s). Optimalizace tlouštěk
přepážek mezi otvory se provádí na základě požadavku
na dostatečně nízkou hodnotu transmisního faktoru
(nejčastěji 0,05); vede to k podmínce pro transmisní faktor e-m.s.L/(2d+s)<0,05
(je popsáno v §4.2, pasáži "Scintigrafické kolimátory"). To dává omezení pro tloušťku
přepážek kolimátoru s > (6.d/m)/[L-(3/m)].
Efektivní délka otvorů kolimátoru
Ve vzorci (4.5.1) pro prostorové rozlišení jsme
neuvažovali prozařování septy kolimátoru. Pokud k
prozařování dochází, způsobuje to z hlediska geometrické
kolimace zdánlivé efektivní zkrácení skutečné
délky otvorů kolimátoru. Zavádí se proto někdy tzv.
efektivní délka otvorů
kolimátoru Lef = L - 2.m-1, kde m je lineární součinitel zeslabení v
materiálu kolimátoru (olovu); je to korekce na prozařování
fotonů přes dvě protilehlé přepážky mezi otvory. Zavedení
Lef místo
L v (4.5.1) popisuje zhoršení rozlišovací schopnosti
prozařováním. Nemá to však velký význam, neboť PSF zde
nemá Gaussovský tvar, je rozšířená v dolní části a vede
ke zhoršení ani ne tak hodnoty rozlišení
FWHM, jako spíš kontrastu obrazu, jak je
vidět na obr.4.3.5d,e).
2. Vnitřní
rozlišení detektoru kamery Rint
(vnitřní, vlastní - intrinsic resolution) je dané přesností,
s jakou systém fotonásobičů a navazující elektroniky je
schopen lokalizovat polohu scintilace v
krystalu. Na kvantové úrovni je vnitřní rozlišení
ovlivňováno statistickými fluktuacemi v
produkci světelných fotonů po interakci g-záření v detektoru a
variacemi v počtu elektronů emitovaných z fotokatody a dynod
fotonásobičů. Tyto fluktuace "rozmazávají"
amplitudy elektrických signálů z fotonásobičů a tím i
hodnoty výsledných souřadnicových impulsů X, Y - obr.4.5.2
c. Použití většího počtu fotonásobičů s vyšší
kvantovou účinností a dobrým optickým kontaktem s krystalem
vede k lepšímu vnitřnímu rozlišení.
Negativně se zde též projevuje tloušťka
krystalu, a to dvojím způsobem. Jednak je to geometrické
"rozmytí" poloh světelných záblesků
registrovaných fotonásobiči - scintilace nastávají v
různých hloubkách a soustava fotonásobičů podle toho
vyhodnocuje poněkud různé jejich polohy X,Y. Dále je to vícenásobný
Comptonův rozptyl g-fotonů v detektoru, který rovněž způsobuje
neurčitosti v X,Y- lokalizaci místa interakce primárních
gama-fotonů. Tenší krystal a větší počet fotonásobičů
umožňují dosáhnout lepší rozlišení. Z těchto důvodů se
používají tenké scintilační krystaly
tloušťky cca 0,7-1,8 cm. Současné scintilační kamery,
optimalizované pro g 140keV, mají tloušťku krystalu většinou 9,5mm a
dosahují vnitřní rozlišení 2,5-3,5mm.
Celkové rozlišení
R gamakamery (vnější - extrinsic)
je pak dáno geometrickým součtem obou dílčích
složek: R = Ö(R2int+R2kolim). Celkové rozlišení se však v praxi nepočítá
podle tohoto vztahu, ale měří se pomocí bodových nebo
čárových zdrojů umístěných do zorného pole kamery s
daným kolimátorem ("Fantomy
a fantomová měření v nukleární medicíně", pasáž "Měření
polohové rozlišovací schopnosti kamery").
V praxi se u každé kamery udává v prvé řadě
vnitřní rozlišení, které je
určeno z technologie výroby - typické hodnoty
vnitřního rozlišení u novějších kamer jsou cca 2,5-4mm.
Vnitřní rozlišení představuje limitní hodnotu
rozlišení, pod kterou se u dané kamery již nelze dostat,
a k níž se lze přiblížit jen za použití kolimátoru s
ultravysokým rozlišením.
Dále se udává celkové rozlišení kamery
s jednotlivými kolimátory pro dané vzdálenosti zdroje od
kolimátoru (většinou 10cm), popř. i za přítomnosti rozptylujícího
prostředí (rozptylující
prostředí mezi zdrojem záření a detektorem - voda a tkáně,
které je vždy přítomné při scintigrafickém zobrazování
radioaktivity v těle, poněkud zhoršuje
prostorové rozlišení a výrazněji kontrast v obraze).
Tyto hodnoty celkového rozlišení jsou různé, pro kolimátory
LE HR (vysoké rozlišení), optimalizované pro 140keV 99mTc, ve vzdálenosti
10cm od čela kolimátoru, činí cca 8-10 milimetrů. U
kolimátorů pro vyšší energie je celkové rozlišení (v 10cm) horší, cca 12-15mm. Jak
bylo výše analyzováno, prostorová rozlišovací schopnost
gamakamery se výrazně zhoršuje se vzdáleností
zobrazované struktury od čela kolimátoru. Gamakamera
(čelo kolimátoru)
by proto při snímání měla být přiložena co
nejblíže povrchu těla pacienta.
Vliv rozptýleného
záření
Na zhoršování kvality obrazu se dále podílí Comptonův
rozptyl záření gama v látkovém prostředí - v
tkáni pacienta (fyzikální podstata je
popsána v §1.6, část "Interakce
záření gama a X", pasáž
"Comptonův rozptyl"). Rozptýlené záření především zhoršuje
kontrast scintigrafického zobrazení, v menší míře
prostorové rozlišení FEHM. Tento efekt je analyzován na
obr.4.5.4 :

Obr.4.5.4 Comptonovsky rozptýlené záření gama při
scintigrafii a jeho vliv na kvalitu
scintigrafického obrazu.
a) Pokud dojde shodou okolností k rozptylu
fotonu v tkáni pod takovým úhlem, že rozptýlený foton
projde otvorem kolimátoru a je detekován krystalem kamery,
může pak docházet k detekci těchto fotonů rozptýleného
záření g´ z falešného místa - je detekován
foton gama zdánlivě přicházející z jiného místa, než
odkud byl původně vyzářen při radioaktivní přeměně.
b) Tyto
falešné rozptýlené fotony g´ mají nižší energii než
"pravé" přímé a primárně detekované fotony g (část energie byla při rozptylu v látce předána
elektronu e-), takže většinou nepadnou do
fotopíku. Pečlivým nastavením okénka analyzátoru na
fotopík daného záření g můžeme proto comptonovsky
rozptýlené záření g´ do značné míry eliminovat.
c),d),e) Obrazy bodového
zdroje bez rozptylujícího prostředí (c) a s rozptylujícím
prostředím ve fotopíkovém měření a při zahrnutí
Comptonova rozptylu v širokém okénku analyzátoru (e).
f),g) Obraz vodního fantomu Jasczak s úzkým
fotopíkovým okénkem a se širokým okénkem, zahrnujícím i
rozptýlené záření (je vidět
zhoršení kontrastu obrazu).
Prostorové rozlišení PET
U dvoufotonových kamer koincidenční pozitronové
emisní tomografie PET je fyzikální princip zobrazení
a analýzy prostorové rozlišovací schopnosti odlišný
- byl popsán výše v §4.3, pasáži "Prostorové
rozlišení PET" (prostorové rozlišení PET kamer je obecně poněkud
lepší než u klasických Angerových kamer).
Měření prostorové
rozlišovací schopnosti kamery
lze provádět dvojím způsobem :
¨
Kvantitativní fyzikální měření
- pomocí analýzy obrazů bodových a čárových zdrojů,
kterými vedeme profily-řezy, čímž získáme
křivky PSF či LSF. Z nich pak
přímo stanovíme hodnotu pološířky-rozlišení FWHM
v [mm] (popř. komplexnější analýzou
tzv. modulační přenosové funkce MTF ....
"..."). Pro praktické stanovení
rozlišení je vhodnější použít čárový zdroj,
jehož obrazem můžeme vést nezávisle více profilů LSF,
popř. tyto profily sčítat a dosahovat tak menších
statistických fluktuací.
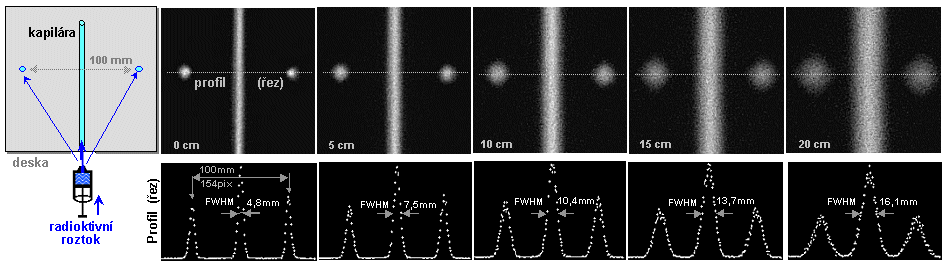 |
| Obr.4.5.5. Měření polohové
rozlišovací schopnosti gamakamery. Vlevo: Čárový zdroj (kapilára) a dva bodové zdroje pro měření polohové rozlišovací schopnosti. Uprostřed, vpravo: Měření bylo provedeno s náplní 99mTc ve vzdálenostech 0, 5, 10, 15 a 20 centimetrů od čela kolimátoru HR kamery Nucline TH. Na obrazech a profilových křivkách je vidět degradace rozlišení FWHM se vzdáleností. |
¨ Vizuální
hodnocení obrazů fantomů
- nejčastěji jsou to tzv. Bar-fantomy prozařované
plošným homogenním zdrojem (většinou 57Co), popř. nádoby složité struktury, plněné
roztokem 99mTc (např. fantom typu Jasczak). Je to
hodnocení víceméně kvalitativní, hodnota
rozlišení se z obrazů spíše odhaduje; pro praxi a
porovnávání je však zpravidla postačující.
Provedení obou způsobů měření
rozlišení je popsáno v práci "Fantomy
a fantomová měření v nukleární medicíně", pasáž "Měření polohové rozlišovací schopnosti
kamery".
Citlivost (detekční účinnost) scintilační
kamery
Detekční účinnost či citlivost S
přístrojů pro detekci a spektrometrii ionizujícího záření
- radiometrů - je obecně definována jako poměr
mezi počtem detekovaných impulsů (kvant
registrovaných detektorem) a počtem
přicházejících kvant záření; zavádí se relativní
a absolutní účinnost, často se vyjadřuje v %
(byla definována a fyzikálně
diskutována v §2.1, část "Obecné fyzikální a přístrojové vlivy při
detekci a spektrometrii",
pasáž "Detekční účinnost a citlivost").
Detekční účinnost klasické jednofotonové
gamakamery - planární, SPECT - je dána dvěma složkami :
1. Geometrická
propustnost (světelnost) kolimátoru pro
záření gama
udávající, jakou část z přicházejících gama-fotonů
kolimátor propustí dál do detektoru kamery (na rozdíl od fotonů, které jsou absorbovány v
septech kolimátoru). Závisí v zásadě
na tom, jakou část z celkové plochy kolimátoru zaujímají
průchozí otvory a jakou část absorbující olověné
přepážky mezi nimi. Podle trigonometrické analýzy na
obr.4.5.2a je geometrická světelnost Skolim paralelního
kolimátoru :
Skolim = (d/L)2 . [d2/(d + s)2] . Kg . [100%] ,
(4.5.2)
kde d je průměr otvorů, s tloušťka
přepážek, L je délka otvorů-kanálků daná výškou
kolimátoru. Geometrický faktor Kg závisí na tvaru a uspořádání otvorů a
přepážek (pro kruhové otvory v
hexagonálním uspořádání je Kg=0,24, pro hexagonální otvory v hexagonálním
uspořádání je Kg=0,26, pro čtvercové otvory v kvangangulárním
rozmístění je Kg=0,28). Běžné kolimátory LE HR
mají geometrickou světelnost cca 1,2%, LEAP kolem 2%, HS cca
2,2%. ..............
Pozn.: Ve vzorcích pro
prostorové rozlišení (4.5.1) a detekční účinnost kamery
(4.5.2) jsme neuvažovali prozařování septy kolimátoru.
Pokud k němu dochází, vede to ke zhoršení kvality obrazu
(viz obr.4.5.3), avšak zároveň ke zvýšení detekční
účinnosti. To je však negativní jev, jehož kvantifikace ve
fyzikálních parametrech je irelevantní...
Nezávislost
detekční účinnosti gamakamery na vzdálenosti
Intenzita záření klesá s druhou mocninou vzdálenosti od
zdroje (přesně to platí pro bodový
zářič). Proto se detekční účinnost
běžných radiometrů výrazně snižuje pro větší
vzdálenosti od měřených zdrojů. U gamakamer s paralelními
kolimátory však detekční účinnost (citlivost) nezávisí
na vzdálenosti zobrazovaného zdroje od čela
kolimátoru! Ve vzorci (4.5.1) nevystupuje parametr h
vzdálenosti. Zobrazení bodového zdroje v širokém rozmezí
vzdáleností 0-30cm od čela kolimátoru na obr.4.5.2 d) sice
ukazuje zhoršování prostorového rozlišení a snižování
jasu obrazu, avšak celkový počet impulsů je ve všech
obrazech stejný, plocha (integrál) pod funkcí PSF je stejná pro všechny vzdálenosti.
Toto překvapivé chování je způsobeno
specifickými vlastnostmi geometrické kolimace
u paralelních kolimátorů. Názorně si to můžeme představit
podle schématického nákresu na obr.4.5.2 a),b) takto: Se
vzdalováním zdroje od čela kolimátoru počet fotonů
dopadajících na jednotlivé otvory klesá
kvadraticky jako 1/h2. Avšak počet otvorů, kterými záření může
projít k detektoru, se kvadraticky zvyšuje
úměrně h2. Tyto dva protichůdné trendy se vzájemně ruší,
takže celkový procházející tok fotonů - účinnost
kolimátoru - se nemění se vzdáleností
mezi zdrojem a kolimátorem.
Pozn.: U speciálních kolimátorů konvergentních
či Pinhole tato zákonitost neplatí,
detekční účinnost se výrazně mění se
vzdáleností - roste nebo klesá (viz
níže pasáž "Zobrazovací vlastnosti speciálních kolimátorů").
2. Vnitřní
detekční účinnost krystalu a fotonásobičů kamery Sint ,
udávající jaká část z fotonů gama, dopadajících na
detektor (t.j. propuštěných
kolimátorem), je systémem scintilačního
kystalu, fotonásobičů a anylyzátoru, skutečně
detekována ve formě impulsů vytvářejících
scintigrafický obraz. To závisí na tloušťce
a konverzní účinnosti scintilátoru, energii
záření gama, nastavení šířky okénka
analyzátoru na fotopík. Fotopíková detekční účinnost
standardního detektoru gamakamery s krystalem tloušťky 9,5mm
pro 140keV 99mTc činí cca 80%, pro 364keV 131I pak kolem 30%.
Celková - systémová
detekční účinnost
- citlinost kamery S je pak dána
součinem obou těchto složek Skolim . Sint ; hlavní určující složkou je přitom účinnost
kolimátoru. U gamakamer, kde zdrojem gama záření je radionuklid,
se však citlivost - detekční účinnost - většinou
kvantifikuje speciálním způsobem: jako počet
impulsů detekovaných kamerou za jednotku času [za sekundu] - cps,
vztažený na jednotku aktivity [kBq, MBq]
použitého radionuklidu v zobrazovaném zdroji; pro
planární/SPECT scintigrafii je to většinou 99mTc,
u PET pak 18F. Jen vyjímečně se vyjadřuje v %.
Ve scintigrafické diagnostice nám jde většinou
o relativní posouzení distribuce
radioindikátoru v různých částech vyšetřovaného objektu.
V případě tzv. kvantitativní scintigrafie
nás však může zajímat i absolutní aktivita
radioindikátoru ve vyšetřované oblasti. Abychom tuto
skutečnou aktivitu mohli stanovit ze scintigrafického obrazu,
potřebujeme znát účinnost (citlivost)
detekce záření g daného radionuklidu
scintilační kamerou. Detekční citlivost gamakamery dále
potřebujeme znát pro stanovení optimální aplikované
aktivity radioindikátoru k získání dostatečně
kvalitních scintigrafických obrazů.
U scintilačních kamer se tedy pro praktické
využití detekční citlivost vztahuje k radioaktivitě
vyšetřovaného objektu :
| Detekční účinnost (citlivost) scintilační kamery |
| Detekční
účinnost, či citlivost S, zobrazovacího systému je
kvantifikována jako četnost impulsů N[imp./s]
měřená scintilační kamerou s bodovým zdrojem
záření g (umístěným
v požadovaném místě zorného pole),
vztažená na jednotku aktivity A[MBq]
zdroje : S = N / A . Vyjadřuje se v jednotkách [imp. s-1 MBq-1], neboli [cps/MBq] či [cps/kBq] . |
Udává se pro konkrétní druh radionuklidu a
kolimátoru. Nejčastěji se citlivost pro planární a SPECT
kamery udává pro radionuklid 99mTc, u PET kamer pro 18F.
Pro různé radionuklidy má citlivost scintilační kamery
obecně rozdílné hodnoty, v závislosti na výtěžku gama
fotonů [%] (počtu gama kvant/100 přeměn radionuklidu) a
jejich energii [keV].
Základní fyzikální
měření detekční účinnosti gamakamery - v dané
vzdálenosti a místě zorného pole - se provádí s bodovým
zdrojem požadovaného radionuklidu. Můžeme tak
provádět podrobná měření závislosti detekční účinnosti
na vzdálenosti v různých místech zorného pole (jak je vidět v pravé části obr.4.5.6). Jiný způsob měření "zprůměrované"
citlivosti je s plošným zdrojem, který celý
leží v zorném poli (tento způsob se
hodí zvláště pro kamery opatřené paralelním kolimátorem) - v obraze plošného zdroje se zprůměrují
příp. lokální nehomogenity citlivosti a
měřící chyba se tím může poněkud snížit. Podle
doporučeného postupu NEMA (pro
zajištění dobré přesnosti a reprodukovatelnosti) citlivost kamery stanovíme tak, že doprostřed
zorného pole umístíme mističku průměru 10cm s roztokem 99mTc o přesně
známé aktivitě - cca 10MBq, vrstva roztoku do 1cm.
Nastřádáme scintigrafický obraz s daným kolimátorem a v
požadované konfiguraci (doba akvizice
min. 100sec), v něm stanovíme počet
impulsů v ROI obrazu misky a přepočítáme jej na 1MBq a 1sec.
Vedle vlastní detekční účinnosti
scintilačního krystalu kamery na dané gama záření závisí
výsledná, celková - systémová citlivost
rozhodujícím způsobem na použitém kolimátoru.
Pro univerzální kolimátory typu LEAP se citlivost
scintilačních kamer pro 99mTc pohybuje kolem 150-300 cps/MBq, pro kolimátory s
vysokým rozlišením (HR) pak jen cca 50-100 cps/MBq 99mTc. Jak bylo
diskutováno výše, u paralelních kolimátorů
registrovaný počet impulsů prakticky nezávisí na
vzdálenosti, zatímco u kolimátorů konvergentních
a Pinhole (§4.2, část "Scintigrafické
kolimátory") je závislost detekční citlivosti na vzdálenosti od
čela kolimátoru velmi výrazná - obr.4.5.6 vpravo (je odvozeno níže v pasáži "Zobrazovací
vlastnosti speciálních kolimátorů";
nezávislost detekční účinnosti na vzdálenosti je u těchto
speciálních kolimátorů zachována pouze u zdrojů s homogenní
plošnou distribucí aktivity, přesahující zorné
pole).
U kamer pozitronové emisní tomografie
PET, které místo mechanických kolimátorů
používají elektronickou koincidenční kolimaci, je
detekční citlivost podstatně vyšší, cca
7000-10000 cps/MBq 18F - viz §4.3, pasáž "Detekční účinnost (citlivost)
PET".

Obr.4.5.6. Závislosti prostorového rozlišení FWHM (vlevo)
a detekční účinnosti S (vpravo)
gamakamery na vzdálenosti zdroje od čela různých druhů
kolimátorů. V rámečku zcela vpravo je pro zajímavost
vynesena celá křivka detekční účinnosti pro konvergentní
kolimátor až do vzdálenosti 70cm, zachycující výrazné
maximum v ohnisku a následující pokles.
Pozn.: Tyto
křivky jsou jen přibližné a mají víceméně ilustrativní
charakter. Vznikly srovnáním a interpolací řady měření
bodových a čárových zdrojů 99mTc s různými kolimátory na kamerách PhoGammaHP,
Nucline MB9201 a TH, Symbia T. Konkrétní hodnoty rozlišení a
citlivosti se u jednotlivých kamer různých typů a výrobců
mohou poněkud lišit, avšak trendy závislostí jsou
vystiženy objektivně.
Vliv látkového
prostředí
Analýza detekční účinnosti (citlivosti)
gamagrafického zobrazení byla shora provedena za situace bez
látkového absorbujícího prostředí - ve vakuu či ve
vzduchu. Při praktické scintigrafii se však mezi
zobrazovanými strukturami s distribuovanou radioaktivitou v
organismu a gamakamerou nachází tkáňové prostředí,
s nímž gama záření interaguje, což vede především k absorpci
a zeslabení gama záření. Určité množství
záření g je během průchodu tkání od místa svého vzniku
směrem k detektoru kamery absorbováno při
interakci s látkou tkáně - v důsledku fotoefektu a Comptonova
rozptylu v tkáni. Vede to k exponenciálnímu poklesu četnosti
N detekovaných fotonů g se zvyšující se hloubkou
h distribuce radioindikátoru v těle: N = No.e-m.h, kde m je lineární součinitel zeslabení, závisející na
energii záření g a na hustotě tkáně (pro g 140keV 99mTc je tento
absorbční koeficient m @ 0,15 cm-1). Toto zeslabení záření gama absorbcí, nazývané
též atenuace, se na scintigrafických obrazech
projevuje arteficielním snížením počtu
impulsů ze struktur uložených ve větších hloubkách, ve
srovnání se strukturami blíže povrchu. V takovém případě
již neplatí tvrzení, že detekční
účinnost (citlivost) nezávisí na vzdálenosti
zobrazovaného zdroje od čela kolimátoru. Detekční účinnost
se zde se vzdáleností - hloubkou - zobrazovaného
zdroje výrazně snižuje!
Mezi citlivostí kamery S
a jejím celkovým prostorovým rozlišením R (= FWHM)
platí přibližná závislost S ~
R-2 (u paralelních kolimátorů plyne z porovnání vzorců
(4.5.1) a (4.5.2)). Tedy čím je lepší
rozlišení zobrazovacího systému, tj. čím je menší
R=FWHM, tím nižší je jeho citlivost - a naopak. Při
snaze o vysoké rozlišení (použití kolimátoru UHR) to vede k
menší hustotě impulsů v obraze a proto k vyšším
statistickým fluktuacím (vyššímu
šumu). Jinými slovy, rozlišení
a citlivost si konkurují - kolimátory s lepším
rozlišením mají nižší citlivost a naopak.
Zobrazovací
vlastnosti speciálních kolimátorů - konvergentního a Pinhole
Zobrazovací vlastnosti - měřítko zobrazení, prostorové
rozlišení a detekční účinnost (jakož i linearita) -
těchto speciálních kolimátorů se výrazně liší od
základních kolimátorů s paralelními otvory. Především,
kolimátory s paralelními otvory promítají
radioaktivní zobrazované struktury na krystal detektoru v
nezměněné velikosti - v měřítku 1:1,
zatímco speciální kolimátory poskytují zvětšené
či zmenšené zobrazení, v závislosti na
vzdálenosti zdroje od kolimátoru: právě tato závislost
měřítka zobrazení - "optický zoom"
je hlavním důvodem pro jejich použití. Prostorové
rozlišení se sice v zásadě zhoršuje se
vzdáleností, ale jiným "tempem" než u paralelních
kolimátorů. Detekční účinnost (citlivost)
je u paralelních kolimátorů prakticky nezávislá
na vzdálenosti, zatímco u speciálních kolimátorů výrazně roste
či klesá se vzdáleností (jak je vidět na obr.4.5.6 vpravo).
Uvedeme si přehled zobrazovacích vlastnosti těchto
kolimátorů podle obr.4.5.7 :
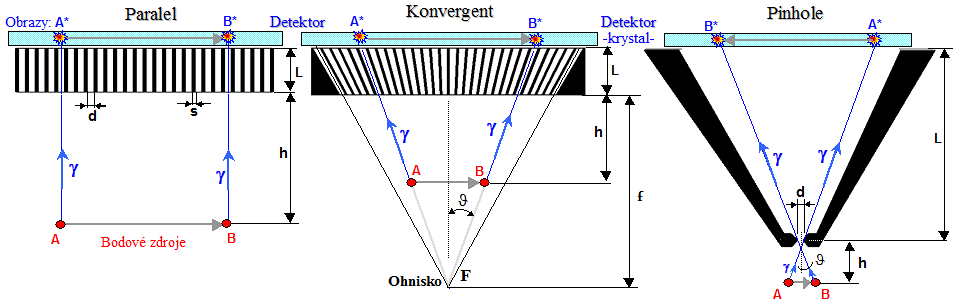
Obr.4.5.7 Geometrické uspořádání otvorů a zobrazovací
vlastnosti kolimátorů: Paralelní, Konvergentní a Pinhole.
Paralelní kolimátor
Měřítko zobrazení: M
= 1 - promítá na detektor kamery obraz bez změny velikosti,
zobrazení 1 : 1. Prostorové rozlišení:
Rkolim ~ d . (1 + h/L) (vzorec(4.5.1)) - zhoršuje se s rostoucí vzdáleností od
kolimátoru, přibližně lineárně.
Detekční účinnost (citlivost):
Skolim =
(d/L)2 . [d2/(d + s)2] . Kg . [100%] (vzorec(4.5.1) je nezávislá na vzdálenosti od kolimátoru.
Zobrazovací vlastnosti paralelních kolimátorů byly podrobně
rozebírány výše na začátku této kapitoly "Fyzikální parametry
scintigrafie" v pasážích "Rozlišovací
schopnost gamakamery" a
"Detekční účinnost gamakamery".
Konvergentní
kolimátor
Měřítko zobrazení: M
= (f+L)/(f-h) -
poskytuje zvětšení obrazu v závislosti na
vzdálenosti h zdroje od kolimátoru. Prostorové
rozlišení: Rkolim ~ [d .
(L + h)/L]. (cos q)-1
.[1 - (L/2)/(f
+L)] se zhoršuje se vzdáleností obdobným způsobem
jako u paralelního kolimátoru.
Detekční účinnost (citlivost):
Skolim =
(d/L)2 . [d2/(d + s)2] . [f2/(f -h)2] .
Kg . [100%] . U konvergentního
kolimátoru detekční účinnost roste se vzdáleností
od kolimátoru. Výrazného maxima - až 30 x vyšší než u čela kolimátoru! - dosahuje v ohnisku
(což bývá ve vzdálenosti cca 40-60cm), odkud gama záření prochází do detektoru všemi
otvory kolimátoru; za ohniskem pak již detekční
citlivost klesá - viz křivka v
rámečku na obr.4.5.6 vpravo. Tato oblast
velkých vzdáleností však není využitelná pro praktickou
scintigrafii, neboť je zde již špatné prostorové rozlišení
(a může se rušivě projevovat struktura
otvorů a přepážek, která se zvětšeně promítá na
detektor).
Konvergentní kolimátory vykazují optimální
kombinaci rozlišení, účinnosti a měřítka zobrazení
ve vzdálenosti kolem 15-20cm, což dobře odpovídá velikosti a
hloubce uložení srdce. Často se proto používaly v nukleární
kardiologii při ventrikulografii a scintigrafii perfuze
myokardu (§4.9.4 "Nukleární
kardiologie").
Pozn.: Opačná - rozbíhavá
- konfigurace otvorů, je u kolimátorů divergentních
(nyní již nepoužívaných), které poskytují zmenšení
obrazu. Divergentní
kolimátor v zásadě vznikne, když konvergentní kolimátor
obrátíme a "nasadíme opačně" na detektor kamery.
Pinhole kolimátor
Měřítko zobrazení: M = L/h - poskytuje zmenšení
nebo zvětšení obrazu, podle vzdálenosti
h. Obraz je zrcadlově obrácený. Pro
větší vzdálenosti h>L je obraz zmenšený,
pro menší vzdálenosti h<L od kolimátoru je obraz zvětšený.
Prostorové rozlišení: Rkolim = d .
(L+h)/L je velmi
dobré v malých vzdálenostech (při
průměru otvoru d=2mm se ve vzdálenostech do 10cm dosahuje
rozlišení Rkolim cca 3mm a celkového rozlišení FHHM kolem 4-5mm). Ve větších vzdálenostech se rozlišení zhoršuje,
ale stále je lepší než u ostatních
kolimátorů.
Detekční účinnost (citlivost):
Skolim =
(d/16h2) .
cos3q . Detekční citlivost
gamakamery s kolimátorem Pinhole je poměrně vysoká jen v
těsné blízkosti od otvoru (ve 3 cm je
cca 500 cps/MBq), avšak se vzdáleností prudce
klesá. Ve větších vzdálenostech je již velmi
nízká (v 10cm je cca 50 cps/MBq, ve
20cm pouhých 10 cps/MBq), pro praktickou
scintigrafii naprosto nedostatečná (snad jen pro monitorování vysokých terapeutických
aktivit 131I).
Vzhledem k těmto zobrazovacím vlastnostem se
kolimátor Pinhole hodí pro scintigrafii malých
orgánů, především štítné žlázy - viz §4.9.1 "Thyreologická
radioisotopová diagnostika", kde poskytuje zvětšený
obraz s velmi dobrým rozlišením i dostatečnou detekční
účinností.
Konvergentní
a Pinhole kolimátory vykazují určitou nehomogenitu a
nelinearitu zobrazení - rozlišení a detekční
účinnost se poněkud liší v různých
místech zorného pole, i při stejné vzdálenosti h od
čela kolimátoru. Tyto rozdíly závisejí na radiální
vzdálenosti zobrazovaného zdroje od osy kolimátoru, což
je při trigonometrické analýze vyjádřeno úhlem q
mezi osou kolimátoru a spojnicí zdroje a jeho obrazu. Odchylky
v hodnotách rozlišení a citlivosti jsou pak dány kosinem
úhlu q . V praktické scintigrafii, při dodržení
optimálních konfigutrací, nejsou tyto
odchylky příliš významné...
Zobrazovací vlastnosti
kolimátorů s různým geometrickým uspořádáním otvorů
jsou nejnázorněji vidět na obrazech lineární pravoúhlé mřížky
(její konstrukce je popsána v práci
"Fantomy
a fantomová měření v nukleární medicíně", obrázek "Mřížka")
:

U kolimátoru s paralelními otvory (jako je LE
HR, vlevo) dostáváme všude lineární
zobrazení mřížky, přičemž pro větší vzdálenosti od
čela kolimátoru se zhoršuje prostorové rozlišení
(rozmazaná mřížka). U konvergentního
kolimátoru (jako je SmartZoom s konvergentní středovou
částí) se s rostoucí vzdáleností obraz středové části zvětšuje.
U kolimátoru Fan Beam (který je konvergentní
v transverzálním směru, v axiálním směru je paralelní) se
s rostoucí vzdáleností oka mřížky zvětšují jen v
transverzálním směru, v axiálním zůstávají
stejné. Nejvýraznejší závislost na předmětové
vzdálenosti vykazuje kolimátor Pinhole:
těsně u čela dostáváme obraz mnohonásobně zvětšený,
s rostoucí vzdáleností se zoom zmenšuje a pro vzdálenosti
nad cca 20cm je obraz již zmenšený. Z
obrázků je dále vidět obecný trend zhoršování
rozlišovací schopnosti (a tím i kontrastu v obraze) se
vzdáleností od čela kolimátoru.
Homogenita (uniformita)
zorného pole kamery
Scintigrafický obraz se vytváří v gamakameře velmi
složitým způsobem, signály jdou přes řadu přesně
vyladěných elektronických a elektro-optických komponent.
Jednotlivé články tohoto řetězce však mohou vykazovat
některé změny, což může způsobovat odchylky a defekty ve
vytvářených obrazech.
Další důležitý parametr kvality
scintigrafického zobrazení - homogenita
(zvaná též uniformita) udává, zda
jednotlivá místa v zorném poli jsou zobrazována se stejnou
účinností (citlivostí). Nehomogenitou
zobrazovaného pole pak rozumíme lokální arteficielní
změny nastřádaného počtu impulsů, způsobené
lokálními změnami v citlivosti a linearitě zobrazení.
Nehomogenita bývá způsobena rozdílnou citlivostí
jednotlivých fotonásobičů či jejich odlišného
spektrometrického nastavení, odchylkami v seřízení
elektronických obvodů, defekty či nehomogenitami v kolimátoru
nebo scintilačním krystalu.
Homogenita pole charakterizuje schopnost kamery
poskytovat přesný (tj. homogenní) obraz homogenní distribuce radioaktivity. Ozářením
zorného pole kamery homogenním tokem fotonů záření g získáme obraz
homogenního zdroje, který by měl být též zcela
homogenní (až na statistické fluktuace). Případné nehomogenity na tomto obraze jsou patrné vizuálně,
lze je však vyjádřit i kvantitativně,
většinou v procentech :
| Homogenita zorného pole kamery (integrální) |
| Homogenita
zorného pole kamery je maximální odchylka skutečného
obrazu vzniklého jako odezva na homogenní ozáření
detektoru kamery, od ideálně homogenního obrazu : H = 100[%] . (Nmax-Nmin)/Nstr , kde Nmax je maximální, Nmin minimální a Nstr střední (průměrný) počet impulsů nastřádaný v pixelech obrazu homogenního zdroje. |
Takto definovaná celková homogenita zorného
pole se označuje jako integrální homogenita.
Jelikož lidské oko je při vizuálním posuzování obrazů
citlivé spíše na rozdíly jasů sousedních
oblastí, může být pro hodnocení homogenity zobrazení
užitečná i tzv. diferenciální homogenita.
Pro její kvantifikaci bylo přijato následující kritérium :
Diferenciální homogenita je podíl
největšího rozdílu počtu impulsů v sousedních
buňkách (v řádku i sloupci) v obrazu homogenního
zdroje, dělený průměrným počtem impulsů v obraze Hdif = max(Ni - Ni-1)/Nstr. Pro snížení
vlivu statistických fluktuací se stanovovaný počet impulsů průměruje
v rozsahu 5 buněk.
Celé a centrální zorné pole
Z konstrukce scintilační kamery plyne, že kvalita
scintigrafického obrazu bývá nejlepší v centrální části
zorného pole, zatímco v okrajových částech může být
poněkud zhoršená. Proto se často homogenita (a někdy i
další parametry kamery) stanovují zvlášť pro celé
zorné pole (tzv. UFOV - useful field of view) a
zvlášť pro centrální část zorného pole
(tzv. CFOV - central field of view). Jako centrální část se
většinou bere 75% z plochy celého zorného pole. U kvalitních
a správně seřízených (kalibrovaných,
vyladěných) kamer by integrální
homogenita v centrálním poli neměla být horší než asi
3,5%, v celém zorném poli pak do 5%; diferenciální
nehomogenita v centrálním poli by se měla pohybovat v rozmezí
1,5 - 3 %.
Podobně
jako u rozlišení, i u homogenity scintilační kamery
rozeznáváme :
¨
Vnitřní homogenitu
detektoru kamery (intrinsic)
- je daná hmogenitou scintilačního krystalu a jeho světelné
odezvy, sběrem světla, citlivostí a seřízením jednotlivých
fotonásobičů. Měří se homogenním ozářením krystalu bez
kolimátoru.
¨
Celkovou homogenitu
kamery ("vnější" - extrinsic)
- danou vnitřní homogenitou detektoru kamery a homogenitou (resp. příp. nehomogenitou, defekty) použitého kolimátoru. Měří se s nasazeným
kolimátorem pomocí homogenního plošného zdroje,
nejčastěji 57Co.
Korekce nehomogenity
zorného pole
Nehomogenitu zorného pole kamery lze snížit či eliminovat ve
dvou krocích :
1. Pečlivé seřízením - sladěním
jednotlivých fotonásobičů na stejnou detekční účinnost
(stejnou polohu fotopíku), tzv. tuning.
U dřívějších analogových kamer se to provádělo manuálně
pomocí potenciometrů v předzesilovačích
jednotlivých fotonásobičů, s kontrolou osciloskopem.
Nynější digitální kamery mají počítačovou proceduru,
která pro každý fotonásobič pomocí ADC<-->DAC
konvertorů nastaví zesílení tak, aby vrchol fotopíku daného
radionuklidu byl přesně uprostřed nastaveného okénka
analyzátoru.
2. Počítačová korekce
pomocí vhodné matice korekčních koeficientů
gij pro
opravu zbylé nehomogenní odezvy detektoru - obr.4.5.8.
Nastřádané počty impulsů Aij v jednotlivých elementech (i,j) původního
nekorigovaného obrazu se násobí korekčními
koeficienty gij z korekční matice, čím vznikne obraz *Aij korigovaný na
nehomogenitu :
*Aij = Aij . gij .
 |
Obr.4.5.8. Počítačová korekce
nehomogenity obrazu gamakamery. Vlevo: Obraz aij homogenního zdroje, vykazující výrazné nehomogenity. Uprostřed: Matice korekčních koeficientů gij. Vpravo: Vynásobením korekčními koeficienty vzniká korigovaný obraz *aij, který je již homogenní. Pozn.: Místo obvyklé jasové modulece je zde použito izometrické zobrazení, kde výška elementů (pixelů) nad základnou je úměrná obsaženému počtu impulsů. Křivky nahoře jsou příčné řezy, vedené středem obrazů. |
Matice korekčních koeficientů gij se získá z
nasnímaného obrazu hij homogenního zdroje (o němž víme, že by měl být v ideálním
případě homogenní - konstantní) jako
jeho normalizovaná inverzní matice. Korekční
koeficienty gij pro jednotlivé elementy (obrazové
buňky - pixely) i,j se vypočítají jako
poměr průměrného počtu [impulsů/pixel] v celém zorném poli W k počtu hij [impulsů/pixel] v daném místě
obrazu (i,j) homogenního zdroje :
gij = (i,jÎWS hij) /(N. hij ) ,
kde N = WSi +WSj je celkový počet prvků
obrazu zorného pole W. V místech (i,j) zorného pole se sníženou
detekční účinností jsou korekční koeficienty gij poněkud vyšší
než "1", v místech vyšší účinnosti jsou mírně
nižší než "1".
Obraz homogenního zdroje musí být získán za
stejných podmínek *), jako obrazy, které chceme vzniklou
maticí korigovat. Tato korekční matice gij je uložena v paměti akvizičního počítače a
jejími příslušnými koeficienty se pak při snímání
(akvizici) násobí nastřádaný počet
impulsů v daném místě zorného pole.
*) Na
čem závisí homogenita zorného pole :
Homogenita zobrazení gamakamery závisí (vedle
mechanických, detekčních, optických a elektronických
vlastností přístroje) i na na řadě
parametrů a podmínek nastavení - na šířce
a symetrii nastavení okénka analyzátoru, na energii záření,
na množství rozptýleného záření, na četnosti impulsů, na
použitém kolimátoru. Může se též měnit s časem vlivem
nestabilit v detektoru a elektronických obvodech. Pokud není
dosaženo dostatečného počtu nastřádaných impulsů v obraze
(informační hustoty), mohou se jako nehomogenita jevit též
statistické fluktuace - korekční matice musí být proto
nahrávána s co nejvyšším počtem impulsů, min. 10 000
imp./pixel. Tyto důležité aspekty měření a korekce
nehomogenity jsou diskutovány a dokumentovány na
experimentálních scintigrafických obrazech v části "Testování a kalibrace homogenity
zobrazení kamery",
pasáži "Závislost nehomogenity na
fyzikálních podmínkách".
Digitální scintigrafické
kamery mají obě tyto operace 1. a 2. zahrnuty v proceduře kalibrace homogenity a ladění
fotonásobičů (tuning).
Pravidelné
testování homogenity zobrazení gamakamery
Prakticky všechny poruchy a anomálie v zobrazovacích
vlastnostech kamery se nejcitlivěji projeví na
homogenitě zorného pole. Pro zajištění kvalitního
scintigrafického zobrazení je proto potřeba provádět pravidelné
testování homogenity - a samozřejmě též po
každém elektronickém zásahu do obvodů fotonásobičů,
zesilovačů a ADC. V případě zhoršené homogenity je nutno
provést seřízení či rekalibraci fotonásobičů (ladění - "tuning"),
aktualizaci korekční matice, v případě hrubších abnormalit
elektronický zásah či opravu. Výsledky testování homogenity
je užitečné dlouhodobě archivovat, příp. graficky
vynášet, pro analýzu časového trendu a
odhalování příčin příp. zhoršování homogenity.
Jak se měření homogenity
provádí pomocí bodových a plošných zdrojů (a doporučené
časové intervaly testování) je popsáno v práci "Fantomy
a fantomová měření v nukleární medicíně",
část "Testování a kalibrace homogenity
zobrazení kamery".
Linearita zobrazení gamakamery
Další parametr kvality scintigrafického zobrazení udává,
zda prostorová měřítka a proporce v předmětu jsou
zobrazována věrně a nezkresleně -
lineárně. Je to tedy schopnost kamery zobrazit distribuci
radioaktivity bez polohového zkreslení, zobrazit čárový
zdroj jako přesnou přímku. Pro posouzení (a příp.
kvantifikaci) linearity scintigrafického zobrazení slouží
speciální fantomy, v nichž je realizována pravidelná
geometrická struktura distribuce radioaktivity. Může
to být buď soustava většího počtu pravidelně
kvadrangulárně rozmístěných bodových zdrojů, nebo soustava
lineárních (přímkových) zdrojů (tzv. bar-fantom,
většinou transmisní). Nejdokonalejším
fantomem pro analýzu linearity zobrazení scintilačních kamer
je kartézská lineární mřížka - je popsáno v práci "Fantomy a fantomová
měření v nukleární medicíně", pasáž "Analýza linearity zobrazení gamakamer".
Scintigrafický obraz takové pravidelné
geometrické struktury by měl vykazovat rovněž geometrickou
pravidelnost. Příp. nelinearita zobrazení
se na tomto obraze projeví jako zkreslení a nepravidelnosti
v geometrickém uspořádání. Můžeme je sledovat buď
vizuálně, nebo je vyhodnotit kvantitativně :
| Linearita scintigrafického zobrazení (prostorová) |
| Linearita
scintigrafického zobrazení se charakterizuje
maximální odchylkou scintigrafického obrazu lineární
distribuce radioaktivity od přesného lineárního tvaru
: L[mm] = max(X -Xlin) , kde X jsou skutečné souřadnice v obraze a Xlin jsou teoretické hodnoty souřadnic odpovídající přesnému lineárnímu průběhu. |
Někdy se linearita vyjadřuje i
procentuálně, tj. L = 100[%].max(X -Xlin)/Xlin. Linearita se analyzuje ve dvou k sobě kolmých
směrech "X" a "Y". Podobně jako u
rozlišení a homogenity, i linearita se uvádí pro celé a
centrální zorné pole, popř. kromě celkové (absolutní)
linearity se uvádí i linearita diferenciální. Prostorová
linearita zobrazení je u kvalitních a správně seřízených
kamer lepší než cca 4mm.
Linearita <--->
Homogenita
Linearita zobrazení a homogenita citlivosti zorného pole
scintilační kamery spolu úzce souvisejí.
Nepravidelnosti v účinnosti registrace scintilací z různých
míst scintilačního krystalu kamery soustavou fotonásobičů
se projeví na obraze jako geometrická nelinearita
a zároveň i jako nehomogenita v hustotě
registrovaných impulsů. Dá se říci, že za normálních
okolností nelinearita zobrazení je hlavním zdrojem
nehomogenity obrazu. K nehomogenitě scintigrafického zobrazení
mohou dále přispívat i odchylky v pravidelném uspořádání
a velikosti otvorů a přepážek v kolimátoru,
zvláště v případě mechanického poškození kolimátoru.
Při praktickém testování vlastností (kvality)
scintilační kamery se linearita zobrazení stanovuje jen
zřídka, neboť je to složité a kromě toho i malá změna
linearity (která by se při cíleném měření linearity jen
těžko prokazovala) se podstatně zřetelněji projeví
v nehomogenitě zorného pole. Jediným případem vizuálně
pozorovatelné systematické nelinearity jsou
scintigrafické obrazy s kolimátory konvergentními a Pinhole
(§4.2, část "Scintigrafické
kolimátory").
Tomografické
rozlišení, homogenita a linearita
U všech výše uvedených parametrů klasické scintilační
kamery jsme měli na mysli běžné planární
scintigrafické zobrazení. Kvalita tomografického
zobrazení je v zásadě popsána stejnými
fyzikálními parametry jako u zobrazení planárního. Avšak
planární parametry detektoru scintilační kamery SPECT *)
nelze vždy přímočaře přenášet do tomografických obrazů
transverzálních řezů, které vznikají složitou procedurou
rekonstrukce z mnoha planárních obrazů pod různými úhly.
Parametry detektoru kamery jsou sice rozhodující i pro kvalitu
tomografických obrazů, avšak spolupůsobí zde i některé
další fyzikální a technické aspekty.
*) U kamery PET samozřejmě žádné
planární zobrazení není, všechny parametry se měří v
tomografickém režimu, na obrazech transverzálních řezů -
viz §4.3, pasáž "Prostorové rozlišení PET".
Prostorové rozlišení kamery v planárním
zobrazení se rozhodujícím způsobem promítá i do zobrazení
tomografického. Radiální tomografické rozlišení
v obraze transverzálního řezu je zhruba (1,1-1,3)-násobkem
celkového rozlišení kamery, může však být příp.
zhoršeno mechanickými posuvy centra rotace během akvizice
SPECT vyšetření. Rozlišení v axiálním směru je dáno
přímo rozlišením kamery s použitým kolimátorem (v dané
vzdálenosti zobrazované struktury od čela kolimátoru).
Případný lokální defekt v homogenitě
kamery se při rotaci kamery na obraze příčného řezu
promítá jako prstencový artefakt.
Nehomogenita v obraze příčného řezu pak ještě může být
způsobena absorbcí záření g
(atenuací) v závislosti na hloubce uložení příslušné
distribuce radioaktivity v tkáni.
Tomografické rozlišení a homogenita se měří
pomocí speciálních pomůcek - fantomů
většinou válcového tvaru, obsahujících trubičky (čárové
zdroje), různé válečky a kuličky různých velikostí, dále
též volný prostor pro homogenní distribuci radioindikátoru.
Nejčastěji používaný je fantom Jasczakův. Fantom
se naplní roztokem radionuklidu (většinou 99mTc nebo 18F), provede se jeho
SPECT či PET scintigrafie a na rekonstruovaných obrazech
transverzálních řezů v příslušných místech se hodnotí
rozlišení a homogenita analogickým způsobem jako na
planárních obrazech. Tomografické fantomy jsou popsány v
práci "Fantomy
a fantomová měření v nukleární medicíně", pasáž "Tomografické fantomy".
Energetické rozlišení a mrtvá
doba detektoru kamery
Vedle výše uvedených základních parametrů - prostorového
rozlišení, homogenity a linearity zobrazení, které mají
primární vliv na kvalitu scintigrafického zobrazení, se u
scintilační kamery uvažují i parametry detekční,
popisující její vlastnosti z pohledu scintilační detekce a
spektrometrie záření g. Tyto parametry jsou sice sekundární a pomocné,
avšak mohou zprostředkovaně ovlivňovat kvalitu zobrazení.
Jejich nepříznivé změny mohou též signalizovat nesprávnou
funkci scintilační kamery.
Energetické
rozlišení
u scintilační kamery nejen že umožňuje separovat různé
linie záření gama (např. při
současném zobrazení dvou isotopů), ale
hlavně určuje schopnost detektoru kamery odseparovat
Comptonovsky rozptýlené záření g od přímého
nerozptýleného záření (bylo
diskutováno výše v části "Prostorové rozlišení gamakamery", pasáž "Comptonovsky rozptýlené
záření", obr.4.5.4). Při správném
seřízení fotonásobičů je celkové energetické rozlišení
klasických gamakamer (Angerova typu) cca 9-12% (u nových
polovodičových CZT kamer je kolem 5%).
Mrtvá doba
(nazývaná též někdy časovým rozlišením)
je doba, po kterou detektor zpracovává signál z příchodu
jednoho detekovaného kvanta záření a není schopen
registrovat žádná další kvanta. Při scintigrafii se může
uplatňovat u zdrojů s vysokou aktivitou, tj. s
vysokým tokem fotonů záření g - při četnosti řádu
mnoha desítek tisíc registrovaných fotonů za sekundu. Mrtvá
doba kamery vede k porušení linearity
závislosti mezi aktivitou ve zdroji a registrovanou četností
impulsů v obraze, což může zkreslit výsledky analýzy
dynamiky vyšetřovaných procesů. U kvantitativních
dynamických studií, zvláště radiokardiografických, může
tak vyvstat potřeba korekce na mrtvou dobu.
Důležitá je zde celková mrtvá doba celého
systému kamera+počítač. U starších typů kamer činila
celková mrtvá doba kolem 5ms, u novějších kamer je již snížená na cca 1ms. Přetížení
gamakamery vysokou intenzitou záření vede též ke zhoršení
zobrazovacích vlastností - rozlišení, homogenity,
kontrastu obrazu. K mrtvé době přispívají všechny
registrované fotony všech energií, tedy nejen odpovídající
fotopíku v okénku analyzátoru, ale i Comptonovsky rozptýlené
záření.
Pozn.:
K podrobnostem o paralyzabilním
(kumulativním) a non-paralizybilním charakteru mrtvé
doby, jakož i k metodám jejího měření a korekce
na mrtvou dobu, můžeme odkázat ke kapitole 2, pasáž "Mrtvá
doba detektorů".
Energetické rozlišení a mrtvá doba se měří spektrometrickými
metodami popsanými v kapitole 2 "Detekce
a spektrometrie ionizujícího záření",
především v §2.4 "Scintilační
detektory".
Problematika měření
zobrazovacích vlastností gamakamer a praktické provádění
testování je rozebíráno v samostatné práci
" Fantomy a fantomová měření v
nukleární medicíně "
4.6.
Vztah scintigrafie a ostatních zobrazovacích metod
Scintigrafie je jen jednou z několika dalších zobrazovacích
diagnostických metod používaných v medicíně.
Každá z těchto metod má své možnosti použití, své
výhody a úskalí. Diagnostické zobrazovací metody můžeme v
zásadě rozdělit na dvě skupiny:
¨
Anatomicko-morfologické,
které zobrazují především velikost a strukturu tkání a
orgánů. Anatomickému zobrazení však chybí funkční aspekt
- neumožňuje rozpoznat biologickou povahu zobrazené
patologické struktury.
¨
Funkčně-metabolické,
které mapují prokrvení, metabolismus, drenáž a další
funkce orgánů. Funkční zobrazení však zpravidla
neumožňuje přesnou lokalizaci patologického děje či
ložiska v organismu - chybí zde "pozadí" ostatních
struktur, které se nezobrazují (neboť nemají příslušnou
"funkci"). Kromě toho funkční zobrazení má
zpravidla nižší rozlišovací schopnost než zobrazení
anatomické.
Pro stanovení správné diagnózy je třeba
posoudit jak anatonicko-morfologické, tak funkční a
metabolické příznaky onemocnění. Teprve kombinace obou
zmíněných obrazů umožní rozpoznat biologický charakter
zobrazovaného ložiska a jeho přesnou lokalizaci.
Pro objasnění pozice a úlohy scintigrafie ve spektru
ostatních diagnostických metod si stručně porovnáme principy
a diagnostické výpovědi nejdůležitějších
zobrazovacích metod.
Rtg
zobrazení
Nejstarší a dosud nejčastěji používanou zobrazovací
metodou je rentgenové zobrazení (viz §3.2
"Rentgenová diagnostika"), ať již se jedná a zobrazení planární,
nebo tomografické CT. Pronikavé X-záření, vznikající v
rentgence, prochází přes vyšetřovaný objekt (tkáň
organismu), přičemž část záření se absorbuje
v závislosti na hustotě tkáně, zatímco
zbylá část prochází tkání a je zobrazována
buď fotograficky, nebo na luminiscenčním stínítku, nebo
nověji pomocí elektronických detektorů. Vzniká tak rentgenový
obraz vyšetřované tkáně, který je stínovým
obrazem denzitním, zobrazujícím rozdíly v hustotě
tkání. V určitých případech lze kontrast zobrazení uměle
zvýšit aplikací vhodných kontrastních látek.
Tomografické rtg. zobrazení CT navíc poskytuje obrazy transverzálních
řezů s vysokým rozlišením (cca
1mm), z nichž lze složit trojrozměrný obraz vyšetřované
oblasti.
Ultrazvuková sonografie
Ultrazvuk je mechanické (akustické) vlnění
látky (vzduchu, kapalin, pevných látek) o frekvenci vyšší
než je lidským uchem slyšitelný zvuk, tj. vyšší než
20kHz. V látce se vlnění šíří rozkmitáváním jejích
částic kolem rovnovážné polohy. V plynech a kapalinách se
šíří jako vlnění podélné, v pevných látkách
může mít i charakter vlnění příčného.V
medicínské diagnostice se většinou používá ultrazvuk o
frekvenci 1-15MHz. Při vyšších frekvencích lze dosáhnout
lepšího prostorového rozlišení (díky kratší vlnové
délce), avšak dochází k větší absorbci ultrazvuku v
tkáni.
Ultrazvuková sonografie či ultrasonografie
je založena na šíření zvukových vln o
vysoké frekvenci (několika MHz), tj. ultrazvuku,
v pružném prostředí tkání a jeho odrazech na
nehomogenitách. Rychlost v šíření vlny v
pružném prostředí je dána vztahem v = Ö(M/r) , kde M je elasticita
(Youngův modul pružnosti) prostředí a r jeho hustota
(měrná hmotnost). Narazí-li ultrazvuková vlna na oblast
lišící se hustotou nebo elasticitou
- akustické rozhraní, dochází ke změnám
rychlosti šíření, k lomu a odrazu vlny (souvisí
se známým Huygensovým principem).
Odražené ultrazvukové vlny nesou informace o přítomnosti
struktur rozdílné hustoty a elasticity. Ultrazvuková
sonografie vytváří zobrazení těchto struktur ve
vyšetřované tkáni pomocí echolokace*)
odražených ultrazvukových vln. Odražené signály - akustická
echa - svým časovým sledem odpovídají prostorovému
rozložení odrážejících struktur ve zkoumaném prostředí.
*) Echolokace je takový
způsob získávání informace na dálku, kdy do sledovaného
prostředí je vysílán zvuk, který se od
případného předmětu částečně odráží
zpět do místa vyslání a tam je zachycen a vyhodnocen. Z časového
zpoždění, které uplyne od okamžiku vysláním zvuku
do okamžiku zpětného příjmu odražené vlny (echa -
ozvěny), lze stanovit vzdálenost
odrážejícího předmětu. V přírodě tento princip
využívají delfíni a netopýři k orientaci a k vyhledávání
potravy. V námořní technice se používá tzv. sonar,
m.j. i pro měření hloubky moře. Na podobném principu radiolokace
pracuje radar, který místo zvuku používá
elektromagnetické vlnění - radiovlny.
Vysílací piezoelektrický krystal
sondy, přiložené do mechanického kontaktu s povrchem těla (dobrý průchod vlnění do kůže se zajišťuje
vrstvičkou speciálního gelu), se
působením střídavého elektrického napětí, přivedeného
na jeho protilehlé elektrody, periodicky deformuje a tento
mechanický rozruch (vibrace) vysílá do tkáně akustické
vlny. Ve vodě a v tkáni se zvukové vlny šíří průměrnou
rychlostí 1550m/s. Když ultrazvuk prochází látkou, je jí
absorbován, rozptylován, ohýbán a částečně odrážen
zpět. K odrazu dochází na rozhraní tkání s
různou hustotou a elasticitou, v nichž se ultrazvuk šíří rozdílnou
rychlostí - tedy tkání s různou akustickou
impedancí *). Odražené ultrazvukové vlny se vracejí
zpět a vyvolávají vibrace piezoelektrického krystalu
(měniče) v přijímací části ultrazvukové sondy, což na
elektrodách krystalu generuje střídavý elektrický signál
příslušné frekvence, amplitudy a časového zpoždění,
který se dále elektronicky zpracovává.
*) Pro šíření ultrazvuku tkání je
důležitá tzv. měrná akustická impedance,
což je součin hustoty tkáně a rychlosti ultrazvuku: Z = r.v = Ö(M.r). Udává měrný
"vlnvý odpor" při šíření ultrazvuku v analogii s
Ohmovým zákonem elektřiny. Takto definovaná akustická
impedance Z je poněkud anologická reaktanci v
elektronice (kapacitní či indukční). Viskozita
prostředí, vedoucí k absorbci a útlumu ultrazvuku, je
analogická činnému ohmickému odporu. Čím je
rozdíl akustických impedancí větší, tím je intenzita
odrazů - echogenita - větší.
Sonda přiložená na povrch těla v rychlých
pravidelných intervalech vysílá krátké
(milisekundové) ultrazvukové signály, elektronická přijímací
sonda zaznamenává odražený signál ("echo")
a elektronická aparatura vyhodnocuje časové a poziční diference
vyslaného a odraženého signálu a na základě toho vytváří
na obrazovce obraz struktur podle jejich hustoty
a elasticity (tzv. echogenity či akustické
impedance). Ultrazvukové obrazy
echogenity jsou u většiny sond primárně zobrazeny ve formě
kruhové výseče v polárních souřadnicích
(r,j)
se středem v místě přiložení přijímací sondy. Radiální
souřadnice r - hloubka v tkáni - je
odvozena od časového zpoždění Dt mezi vyslaným
ultrazvukovým signálem a přijetím jeho odrazu: r[mm] = 1,55.Dt[ms] (při průměrné rychlosti
ultrazvuku v tkáni cca 1550m/s). Úhel j je u jednoduchých
přístrojů s jedním přijímacím krystalem určen kývavým
natáčením sondy (ručním či motorickým), u sond s více
směrovými přijímacími krystaly je stanovován elektronicky. Jas
jednotlivých bodů sonografického obrazu je modulován intenzitou
přijímaného odraženého ultrazvukového signálu (tato intenzita by měla být korigována na hloubkovou
absorbci ultrazvuku, viz níže), tj. echogenitou
*) odpovídajících míst v tkáni. Sonografický obraz tedy
zachycuje prostorovou distribuci struktur s
rozdílnou hustotou a elasticitou ve vyšetřované tkáni.
*) Útvary, které ultrazvuk odrážejí
méně či více než okolní tkáň, se nazývají hypoechogenní
nebo hyperechogenní. Vyšší či nižší
echogenita sama o sobě ještě není "diagnózou", ale
je to důležitý znak, podle něhož lze učit charakter
vyšetřovaného okrsku tkáně.
Některé technicky pokročilé systémy mají
počítačovou transformaci obrazu do obvyklých kartézských
souřadnic, poskytujících podstatně názornější
prezentaci. Pravoúhlé zobrazení poskytují sondy s lineárním
uspořádáním většího počtu přijímacích elementů.
Signál pocházející z větší hloubky je výrazně zeslaben
absorbcí v tkáni *) (dvojí zeslabení - vysílaného
i odraženého signálu), takže pro objektivní zobrazení je
prováděna korekce na zeslabení, buď časová
(delší čas příjmu signálu z větší hloubky), nebo
počítačová.
*) K absorbci ultrazvuku v
prostředí dochází tím, že v důsledku vnitřního tření
kmitajících částic se část mechanické energie vlnění
mění v teplo. Míra absorbce ultrazvukového vlnění je dána exponenciálním
zákonem I(d) = Io.e-m.d, kde Io je původní (vstupní) intenzita, I(d) intenzita v
hloubce d, m koeficient absorbce. Absorbční
koeficient m závisí na druhu látky (její
viskozitě) a na frekvenci. Ve většině látek
je útlum absorbcí přímo úměrný druhé mocnině frekvence.
Velkou výhodou ultrasonografie je jednoduchost
jejího provedení, neinvazivnost a
nenáročnost pro pacienty. Metoda je zcela bezpečná a neškodná
(intenzita ultrazvuku dosahuje max 1 mW/m2), nezatěžuje organismus ionizujícím zářením. U
onemocnění majících souvislost s morfologickými a
anatomickými změnami je proto ultrazvukové vyšetření
zařazováno zpravidla na začátek diagnostického
řetězce. Ultrasonografie je hojně používána i pro
hodnocení průběhu gravidity.
Dopplerovská
ultrasonografie
Moderní sonografické přístroje umožňují navíc
provádět analýzu frekvence přijímaného
ultrazvukového signálu: frekvence signálu odraženého od pohybujícího
se objektu je poněkud zvýšená nebo snížená vlivem
Doplerova jevu *), podle toho, zda se objekt
pohybuje směrem k přijímači nebo od přijímače.
Dopplerovským frekvenčním posuvem odraženého ultrazvuku lze modulovat
běžný echogenní anatomický obraz (používá se barevné
modulace) a získat tak navíc rychlostní mapu
pohybu struktur a proudění kapalin ve vyšetřovaném objektu.
Pomocí této tzv. Doplerovské ultrasonografie
je možno v kardiologické diagnostice (Dopplerovská
echokardiografie) zjišťovat např. pohyby srdečních
stěn a chlopní, či výtrysky (jety) krve z pod srdeční
chlopně při regurgitaci. Dále je možno sledovat rychlost
proudění krve v žilním systému.
*) Dopplerův jev:
Pohybuje-li se zdroj vlnění určité konstantní frekvence fo směrem k
pozorovateli (přijímači), registruje tento pozorovatel
vyšší frekvenci f, než jakou zdroj ve skutečnosti
vydává. Naopak při vzdalování zdroje od pozorovatele je
registrována frekvence nižší než skutečná. Rozdíl
skutečné fo a pozorované f frekvence (Dopplerovský
frekvenční posun) roste úměrně s rychlostí pohybu V
zdroje vůči pozorovateli: f = [1 + (V/v)].fo, kde v je
rychlost šíření daného vlnění.. Tato zákonitost platí i
tehdy, když zdrojem přijímaného vlnění je odraz
vlnění od určitého pohybujícího se objektu (včetně
proudící kapaliny). Změřením rozdílu frekvencí
primárního vysílaného vlnění a odraženého vlnění
("echa") tak můžeme stanovit rychlost
pohybu odrážejícího tělesa.
Nukleární
magnetická rezonance - metoda analytická a zobrazovací
Nukleární magnetická rezonance
(NMR) je značně složitá fyzikálně-elektronická metoda,
založená na chování magnetických momentů atomových
jader při působení střídavého radiofrekvenčního
signálu v silném permanentním magnetickém poli. Tato
původně analytická metoda byla později zdokonalena a
rozvinuta i jako důležitá metoda zobrazovací.
Pozn.:
Nukleární magnetickou rezonanci jsme zařadili mezi jaderné a
radiační metody přesto, že v ní nefiguruje žádné
ionizující záření. Jedná se však o metodu založenou na
poznatcích jaderné fyziky - na vlastnostech
atomových jader. Fyzikální jev zvaný nukleární
magnetická rezonance - NMR, byl prozkoumán ve
40.letech (F.Bloch, E.M.Purcell) a byl zpočátku využíván v chemii jako vzorková
NMR spektrometrie. V 70. a 80. letech se začaly
vyvíjet i zobrazovací metody s použitím NMR (průkopníky byli P.Lauterbuer, P.Mansfield,
A.Maudsley, R.Damadian, r.1977) - viz
níže.
Pokusíme
se zde stručně nastínit principy a metodiku NMR. Vzhledem ke
značné principiální a technické komplikovanosti NMR
(v tomto s ní může částečně soupeřit jen scintigrafie)
však musíme dodržet maximální stručnost...
Fyzikální
princip NMR
Jev nukleární magnetické rezonance může obecně
nastávat při interakcích jader atomů s vnějším
elektromagnetickým polem. Každý nukleon (proton i neutron) má
vlastní "mechanický" moment hybnosti - spin
(nukleony patří mezi fermiony se spinem 1/2, viz §1.5 "Elementární
částice"). Tento rotační
moment hybnosti nukleonů podle zákonitostí elektrodynamiky
vytváří - indukuje - vlastní elementární
magnetický moment mp = 1,41.10-27J/T,
rovný 2,79- násobku tzv. Bohrova jaderného magnetonu
*) - podrobněji je diskutováno v §1.1,
pasáž "Kvantový moment hybnosti, spin,
magnetický moment", odstavec
"Magnetický moment". Atomová jádra díky
spinům svých nukleonů vzbuzují tedy velmi slabé magnetické
pole - mají určitý magnetický moment m. Spin a
magnetický moment mají však jen atomová jádra s lichým
nukleonovým číslem, neboť spiny a magnetické momenty
spárovaných protonů a neutronů se vzájemně ruší - jsou
nulové. Magnetický moment jádra je tvořen nespárovaným
nukleonem - protonem či neutronem. Magnetickou rezonanci lze
tedy pozorovat pouze u jader s lichými nukleonovými
čísly - především vodíku 1H, dále u 13C, 15N, 19F, 23Na, 31P atd.
*) Jaderný magneton mN je fyzikální
konstanta vyjadřující vlastní dipólový magnetický
moment protonu indukovaný jeho spinem: mN = e.h/2mp ,
kde e je elementární elektrický náboj (protonu,
elektronu), h je redukovaná Planckova
konstanta, mp je klidová hmotnost protonu. V
soustavě jednotek SI je jeho hodnota přibližně mN =
5,05.10-27J/T. Je analogický Bohrovu
magnetonu elektronu me = e.h/2me , který je však 1836-krát větší, v
poměru hmotnosti protonu a elektronu. Stojí za zajímavost, že
i neutron, ač elektricky nenabitý, má nenulový magnetický
moment mn=-0,966.10-27J/T
poněkud menší a opačného znaménka než proton. Ukazuje se,
že magnetický moment nukleonů má svůj původ v jejich
kvarkové struktuře (§1.5., část "Kvarková
struktura hadronů"a
§1.1, pasáž "Magnetický moment").
Magnetické
momenty jader v magnetickém poli
Za normálních okolností jsou vlivem tepelného pohybu atomů
směry spinů a magnetických momentů jednotlivých jader
chaoticky "rozházené", jejich orientace je náhodná
a neuspořádaná (obr.3.4.4a), elementární magnetická pole se
v průměru vzájemně ruší, v makroskopickém měřítku
látka nevykazuje žádné magnetické vlastnosti (nemáme zde na mysli feromagnetické látky, kde se
jedná o efekt elektronů v atomových obalech). Umístíme-li však analyzovanou látku do silného
magnetického pole (o intenzitě či indukci B
řádově několika Tesla), zorientují se magnetické momenty
jader do směru vektoru B tototo vnějšího
magnetického pole (aspoň částečně) - magnetický moment jader je rovnoběžný se
siločárami magnetického pole (obr.3.4.4b). Čím je
magnetické pole silnější, tím je toto uspořádání
dokonalejší *). Navenek se to projeví nenulovým vektorem
magnetizace M ve směru indukce vnějšího
magnetického pole B. Velikost vektoru
magnetizace je úměrná síle vnějšího magnetického pole B
a procentu souhlasně orientovaných mag. momentů jader v
látce. Dostatečně silné magnetické pole B
se nyní většinou realizuje pomocí supravodivého
elektromagnetu, jehož vinutí musí být trvale
chlazeno kapalným héliem (fyzikální
principy supravodivých magnetů jsou stručně rozebírány v
§1.5, část "Elektromagnety v urychlovačích", pasáž "Supravodivé
elektromagnety").
*) Míra tohoto uspořádání je však ve
skutečnosti velice malá! V běžně
používaných magnetických polích 1-3T se na každých 1
milion jader vodíku nachází ve stavu souhlasné orientace v
průměru jen cca 7-20 jader. Naprostá většina jader je v
důsledku tepelného pohybu orientována v různých směrech,
včetně protisměrného (vyjadřuje to Boltzmannův
rozdělovací zákon). V tomto smyslu je nutno obr.3.4.4b brát
jen jako symbolické schéma, na němž je zachyceno pouze těch
několik jader, které nabývají souhlasné orientace...
Jelikož běžná látka, např. voda nebo tkáň,
obsahuje v 1 gramu asi 1022 jader vodíku, i tak malý
přebytek počtu orientovaných jader poskytuje měřitelnou
velikost vektoru magnetizace a odezvového radiofrekvenčního
signálu.
Larmorova
frekvence, radiofrekvenční excitace a relaxace
V magnetickém poli B se jádra (s nenulovým
magnetickým momentem m) chovají jako magnetické dipóly, na které působí
dvojice sil m.B. To způsobí, že jádro bude osou
svého magnetického momentu rotovat kolem
směru B - bude vykonávat precesní
pohyb (podobný precesnímu pohybu
gyroskopu či dětské "káči" kolem svislého směru
v tíhovém poli) tzv. Larmorovou
frekvencí
wL = g.B , neboli fL = g.B/2p ,
kde g je
gyromagnetický poměr jádra, což je poměr
magnetického momentu jádra a jeho "mechanického"
momentu setrvačnosti [ rad·s -1
·T -1 ]. Precesní pohyb
vzniká při změnách vnějšího magnetického pole nebo
změnách úhlu magnetického momentu v tomto poli a trvá tak
dlouho, dokud se mag. moment neustálí v klidové poloze.
Vyšleme-li pomocí další cívky
(vysokofrekvenční - vf, neboli radiofrekvenční - RF) do takto
magneticky polarizované látky krátký střídavý elektromagnetický
signál (jehož frekvence rezonuje
s výše zmíněnou Larmorovou precesí fLdaného
druhu jádra v magnetickém poli), vychýlí
se směr magnetického momentu jádra dočasně ze
směru určeného vektorem B vnějšího
magnetického pole (obr.3.4.4c) *). Vychýlení vektoru
magnetizace je způsobenou magnetickou složkou excitačního RF
pulsu. Úhel tohoto vychýlení je úměrný amplitudě (energii)
RF pulzu a jeho době trvání. Nejčastěji se používají RF
pulsy 90° nebo 180°.
*) Splnění
rezonanční podmínky: Jádra jsou schopna
účinně přijmout energii ze střídavého elektromagnetického
pole jen tehdy, když Larmorova frekvence precese jádra a
frekvence elektromagnetického impulsu je stejná. Precedující
jádra tak s elektromagnetickým impulsem na dané Larmorově
frekvenci rezonují - odtud název "magnetická
rezonance".
Po odeznění tohoto excitačního signálu
dochází k relaxaci (za
stálé rotace Larmorovou frekvencí), při
níž se budou vyzařovat elektromagnetické vlny
s klesající intenzitou, dokud se magnetický moment po spirále
nevrátí zase zpět do směru B. Tyto
elektromag. vlny budou v přijímacích cívkách
indukovat střídavé napětí - "echo"
radiofrekvenční signál **). Tento relaxační signál (označovaný někdy zkratkou FID - Free
Induction Decay), má sinusový průběh s
exponenciálně klesající amplitudou (viz
níže Relaxační časy). Je to
užitečný signál, který nese informace o vnitřní struktuře
analyzované látky. Frekvence tohoto signálu
je rovna výše zmíněné Larmorově precesi a pro danou sílu B
vnějšího magnetického pole je určena gyromagnetickým
poměrem g jádra, tj. druhem
jádra, amplituda relaxačního
signálu je úměrná koncentraci jader daného
druhu - takto lze nukleární magnetickou rezonanci použít k analýze
složení látek: jaké prvky a v jaké koncentraci jsou
ve vzorku obsaženy. Např. pro jádra vodíku (protony) má
gyromagnetická konstanta hodnotu g = 2,675.10-8s-1T-1 a v magnetickém
poli o indukci 1Tesla Larmorova NM rezonanční frekcence činí
42,574MHz, při 1,5T je to 63,58MHz - oblast radiovln
(krátké vlny). Pro
těžší jádra je úměrně nižší.
**) Sfázování
velkého počtu jader: Přijímací cívky NMR
samozřejmě nejsou schopny zaznamenat relaxační vyzařování
jednoho či několika jader. K získání měřitelného signálu
je zapotřebí deexcitace velikého nmožství jader (>cca
1012), a
to synchronně a ve stejné fázi! Pokud dojde k
rozfázování, MNR signál prudce poklesne či vymizí (srov.
níže "Relaxační časy - T2).
Obecná pozn.: Kvantové chování: Z důvodu lepší
srozumitelnosti výkladu jsme zde zatím explicitně nezahrnuli kvantové
chování magnetického momentu, uvažovali jsme jeho kontinuální
chování. Orientace vektoru magnetického momentu jader v
magnetickém poli ve skutečnosti nabývají diskrétních
kvantových stavů - paralelně (0°), kolmo (90°) a
antiparalelně (protichůdně, 180°) se směrem vektoru B
magnetické indukce vnějšího magnetického pole. Základní,
energetickxy nejnižší stav je paralelní, zatímco kolmá nebo
antiparalní konfigurace má vyšší energii - excitovaný
stav. Ze základního do excitovaného stavu magnetického
momentu přecházejí jádra absorbcí kvanta
elektromagnetické enerie, která musí být přesně rovna
rozdílu energií mezi oběma stavy. Příslušná frekvence
odpovídá rezonanční Larmorově frekvenci. Při
deexcitaci se pak emituje elektromagnetický
signál o téže frekvenci. Precesní rotace magnetického
momentu jader v magnetickém poli je opět jen naše modelová
představa, jak názorně vysvětlit chování jader v
magnetickém poli...
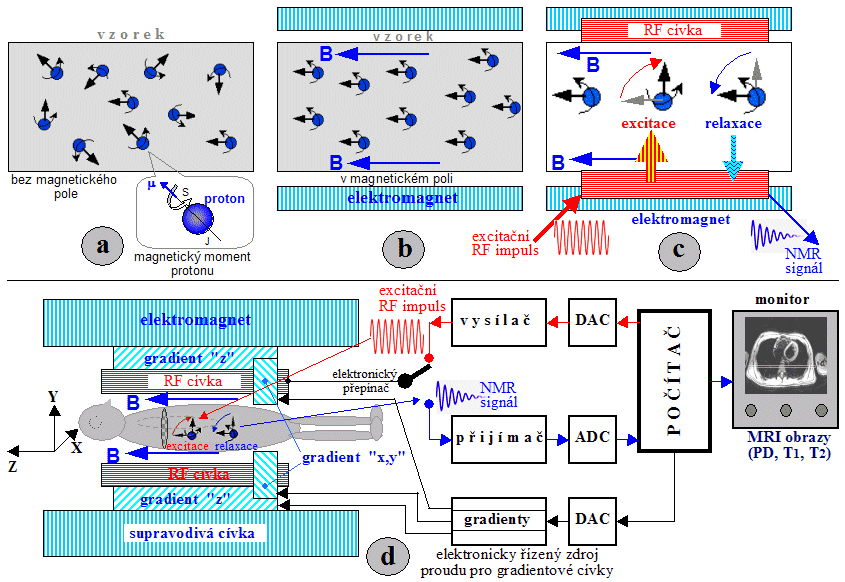
Obr.3.4.4. Nukleární magnetická rezonance -
zjednodušené schématické znázornění.
a) Magnetické momenty jader v analyzované látce mají
za normálních okolností chaoticky rozházené směry.
b) Působením silného magnetického pole B
se mag. momenty jader částečně zorientují do směru vektoru B.
c) Vysláním vf elektromagnetického pole se tato
zorientovaná jádra vychýlí ze směru B,
např. o 90°. Po vypnutí tohoto vf pole nastává relaxace,
při níž budou vychýlená jádra při svém návratu za
precesní rotace vysílat elektromag. NMR signál s
exponenciálně doznívající amplitudou.
d) Zjednodušené principiální schéma zařízení pro
NMR zobrazení. Pro jednoduchost je zakreslena jen jedna
radiofrekvenční (RF) cívka, která se elektronicky přepíná
střídavě do vysílacího a přijímacího režimu; většinou
bývají oddělené vysílací a přijímací RF cívky. (ADC=analogově-digitální konvertor,
DAC=digitálně-analogový konvertor).
Radiofrekvenční
cívky
RF cívky jsou jakýmisi "anténami"
NMR systému, které vysílají excitační RF
signály směrem do analyzované látky, anebo přijímají
odezvové RF signály z relaxujících jader v analyzované
látce. Jako vysílací a přijímací cívka může být v
zásadě použíta tatáž cívka, která se elektronicky
přepíná do vysílacího a následně do přijímacího režimu
(jak je symbolicky zakresleno na schématu
v obr.3.4.4d). Kvalitnější detekce
odezvového NMR signálu však lze dosáhnout použitím
oddělené (samostatné) přijímací RF cívky. Vzhledem k
poměrně vysoké Larmorově frekvenci (desítky MHz) mají RF
cívky velmi jednoduché provedení: jsou tvořeny smyčkou
drátu kruhového nebo obdélníkového tvaru, která se
umisťuje do blízkosti analyzovaného materiálu (vzorku, nebo
zájmové oblasti v organismu). Někdy bývají vhodně
tvarovány (ohýbány do sedlového nebo
válcového tvaru) pro dosažení lepší
homogenity RF signálu v analyzované oblasti.
Do vysílací cívky se v různých
časových sekvencích pouští krátký, ale velmi silný
radiofrekvenční střídavý proud, o vysoké amplitudě,
okamžitém výkonu až desítky kW. V přijímací cívce se pak
indukuje odezvový signál z relaxujících jader naopak o velmi nízké
amplitudě (řádově milivolty), který se pro další
elektronické zpracování musí výrazně zesílit
v úzkopásmovém vysokofrekvenčním zesilovači. Při NMRI
zobrazení (viz níže) se používají speciální přijímací
RF cívky různých velikostí a tvarů, aby těsně obepínaly
analyzovanou oblast - pro zobrazení mozku, kloubů, páteře
atd.
NMR
spektroskopie a analýza
NMR spektroskopie probíhá tak, že se zvyšuje
frekvence budícího vf signálu, tento signál přerušovaně
napájí cívky ve vysílacím režimu, nastane vždy přepnutí
do přijímacího režimu a měří se intenzita vf signálu - echa
- vysílaného vzorkem umístěným v magnetickém poli Bo při zpětné
relaxaci magnetických momentů jader. Frekvence,
při níž nastává rezonanční maximum, Larmorova
frekvence, určuje druh jádra (nejvyšší
je pro vodík - zmíněných 42,6MHz pro B = 1Tesla), intenzita
rezonančního maxima určuje koncentraci
příslušných atomů ve vzorku. Všechna jádra jednoho
isotopu, vložená do téhož magnetického pole, by sama o sobě
měla rezonovat při stejné frekvenci. Jsou-li však atomy
těchto jader součástí chemických sloučenin,
liší se rozložení elektronů v jejich okolí a tyto elektrony
způsobují elektromagnetické stínění jader.
Efektivní magnetické pole působící na jádro pak již není Bo, ale B
= Bo.(1-s), kde stínící faktor s, popisující
intenzitu stínění, jemně závisí na chemickém složení
analyzované látky. Tato změna efektivního magnetického pole
způsobuje ve spektru NMR signálu tzv. chemický posun
frekvence.
Dalším efektem, ovlivňujícím jemnou strukturu NMR
spektra, je vzájemná interakce jader sousedních atomů
zprostředkovaná valenčními elektrony. V důsledku těchto
interakcí se pozoruje rozštěpení rezonančních maxim
studovaných jader na 2-4 linie vzdálené o cca 20Hz - dochází
k multiplicitě signálu.
Detailní analýzou frekvencí, intenzit a multiplicit v NMR
spektru lze tedy získat informace o chemickém složení
a struktuře organických i anorganických
látek. Moderní NMR spektrometry jsou řízeny počítačem,
přičemž indukovaný NMR signál je analyzován s použitím Fourierovy
transformace.
Relaxační
časy
Po vypnutí vysokofrekvenčního budícího pole vychýlená
jádra v magnetickém poli relaxují - vracejí
se po spirálové dráze zpět do původního rovnovážného
stavu ve směru Bo (který si zde označíme jako osu "z"), což
se v přijímací cívce pozoruje jako volné doznívání
indukovaného vf signálu s exponenciálním poklesem amplitudy.
Rychlost této relaxace (resp. doba doznívání) je ovlivněna
interakcí jaderných spinů s okolními atomy a vzájemnou
interakcí mezi jadernými spiny. V signálu NMR je tak
zakódována i informace o okolních atomech a molekulách -
informace o chemickém složení a struktuře
látky. Doba doznívání rezonančního signálu se
charakterizuje dvěma relaxačními časy T1 a T2.
Relaxační doba T1, nazývaná
někdy spin-mřížková (název
pochází z původního používání NMR pro analýzu pevných
látek s krystalovou mřížkou),
představuje základní časovou konstantu relaxace
magnetických momentů jader z vychýlené polohy do
rovnovážné polohy ve směru permanentního magnetického pole.
Zachycuje rychlost, s jakou vychýlené jádro při relaxaci
odevzdává energii elektromagnetickým vlnám a okolnímu
prostředí, přičemž podélná magnetizace ve směru osy z
se k původní hodnotě Mo vrací podle exponenciálního zákona: MZ = Mo(1 - e-t/T1) . Definuje se jako
doba, za kterou podélná magnetizace při relaxaci dosáhne
(1-e)-násobku původní hodnoty Mo, přičemž signál poklesne na 63% (pokud byla
provedena excitace magnetického momentu jádra o 90°).
Relaxační doba T2, zvaná někdy spin-spinová,
vyjadřuje časovou konstantu, se kterou v důsledku vzájemné
interakce spinů a magnetických momentů sousedních jader,
vedoucí k defázování precesního pohybu magnetických
momentů, klesá magnetizace v příčném směru x-y: MXY =MXYo
e-t/T2.
T2 se definuje jako
čas, za který poklesne transverzální magnetizace MXY e-krát.
Pozn.: Přijímací cívka v MRI po
ukončení excitačního impulsu ve skutečnosti detekuje
kratší relaxační dobu značenou T2*. Kromě
relaxační doby T2 je způsobena strmějším poklesem
příčné složky materiálové magnetizace v důsledku
drobných změn v nehomogenitě magnetického pole,vedoucí k
desynchronizaci. U zobrazení MRI je tento jev většinou
negativní, lze jej vykorigovat či eliminovat u tzv. "spin
- echo sekvence" - viz níže.
Relaxační časy T1 a T2 jsou výsledkem vzájemného působení rezonujících
jader s jejich okolím a charakterizují chemické vlastnosti a
strukturu vyšetřovaného materiálu. Při medicínském
využití jsou často výrazně odlišné pro zdravou a
nádorovou tkáň.
V nejčastěji používaném vnějším
magnetickém poli 1,5 T mají relaxační časy T1 a T2 vody a některých lidských tkání (za
fyziologického stavu) následující přibližné hodnoty :
| Druh tkáně: | voda | krev okysličená |
krev neokysličená |
tuk | svaly | proteiny | šedá hmota mozková |
bílá hmota mozková |
játra | ledviny |
| T1 [ms] | 4300 | 1350 | 1350 | 250 | 880 | 250 | 920 | 780 | 490 | 650 |
| T2 [ms] | 2200 | 200 | 50 | 70 | 50 | <= 1 | 100 | 90 | 40 | 70 |
Relaxační časy jsou
charakteristické pro různé látky a tkáně - závisí na
koncentraci jader, teplotě, velikosti molekul, chemických
vazbách. Z tabulky je vidět, že např. jádra vodíku pevně
vázaná v molekulách tuku či bílkovin relaxují mnohem
rychleji než protony slabě vázané v molekulách vody.
NMR
zobrazení - MRI
Metoda NMR sloužila původně jako analytická metoda
složení a struktury vzorků. Pokrok v elektronice a
počítačové technice v 70. a 80. letech umožnil použití
signálu NMR pro vytvoření obrazu hustoty protonů ve
vyšetřovaném objektu. Vznikla tak metoda NMR
zobrazení (NMRI - Nuclear Magnetic Resonance Imaging;
slovo "nuclear" se často vypouští a používá se
zkratka MRI) - obr.3.4.4d.
Aby bylo možné detekovat NMR signály separátně a lokálně
z jednotlivých míst vyšetřovaného objektu (organismu či
tkáně) a pomocí něho vytvořit zobrazení,
je třeba zajistit prostorově-geometrické kódování
souřadnic ve vyšetřovaném objektu. Toho lze
dosáhnout tím, že na hlavní konstantní homogenní pole Bo superponujeme
přídavné gradientní magnetické pole ve
směru osy X,Y,Z. Tato gradientní magnetická pole ve směru
každé osy X,Y,Z se vytvářejí příslušnou dvojicí gradientních
cívek. Změnami gradientného magnetického pole
dosáhneme toho, že k magnetické rezonanci bude docházet
pokaždé v jiném místě vyšetřovaného objektu. Tímto
gradientním magnetickým kódováním prostorových souřadnic
pak můžeme provádět NMR zobrazení.
Gradientní cívky
jsou "přídavné" elektromagnety umístěné ve
vhodných místech uvnitř hlavního silného elektromagnetu.
Jsou navinuté měděným drátem nebo kovovým páskem,
dimenzované pro poměrně vysoké proudy desítky i stovky
ampér. Gradientní cívky jsou v pulzních sekvencích napájeny
poměrně silným proudem (cca 500A) z elektronicky regulovaných
zdrojů, které umožnují rychlé a přesné nastavení síly a
směru buzeného magnetického pole - přídavného gradientního
pole. Produkují gradienty v rozmezí cca 20-100 mT/m. Aby MRI
zobrazení netrvalo enormě dlouhou dobu, je třeba aby rychlost
gradientních změn byla poměrně vysoká - dosahuje se cca
100-200 T.m-1.s-1; to vyžaduje určité
napětí (cca 50-300V) k překonání indukčnosti gradientních
cívek - napájecí zdroje gradientních cívek jsou poměrně
robustní (výkonové). Silné proudové nárazy v gradientních
cívkách při interakci s magnetickým polem vyvolávají mechanické
vibrace, což způsobuje značnou hlučnost při
MRI. Podélné gradientní cívy (ve směru Z) mají
závity navinuté ve stejném směru jako hlavní cívka, X
(gradient ve směru levo-pravém) a Y (gradient ve směru
nahoru-dolů) jsou tvořeny cívkami sedlového tvaru s kolmo
navinutými závity.
Všimněme si nejprve
podélného gradientního pole Bz(z) ve směru Z.
Jeho superpozice s hlavním mag. polem Bo způsobí, že
skutečná "místní" hodnota magnetického pole B
= Bo+Bz(z) bude záviset na souřadnici z: B
= B(z). Vyšleme-li do vzorku, umístěného v
tomto mírně nehomogenním gradientním magnetickém poli
vysokofrekvenční impuls určité frekvence f, bude se
signál magnetické rezonance vysílat atomovými jádry jen z tenké
vrstvy vzorku o souřadnici z, pro kterou je
splněna rezonanční podmínka f = g.B(z)/2p. Změnou frekvence f
vysokofrekvenčních excitačních impulsů, nebo intenzity
podélného gradientního pole Bz, se mění poloha z
vrstvy, v níž se vytváří odezvový signál magnetické
rezonance. Tímto způsobem se zachytí informace o závislosti
prostorového rozložení hustoty jader ve směru osy Z -
je dosaženo elektronicko-geometrického kódování této
souřadnice - vrstvy z.
Zobrazení prostorového rozložení hustoty jader v dané
vrstvě z v příčných směrech X a Y se
pak získá působením dalšího, příčného, gradientního
magnetického pole ve směru osy X a Y, čímž se zkoumaná
vrstva rozloží na elementární objemy - "pixely",
v nichž se zjišťuje závislost intenzity relaxačního NMR
signálu a též časy jeho doznívání. Změnou těchto
gradientních polí se získávají údaje pro jednotlivá místa
ve vrstvě z a jejich počítačovou rekonstrukcí se
získá obraz příčného řezu protonové
hustoty ve vyšetřované vrstvě z (obr.3.4.4d vpravo).
Elektronickou analýzou relaxačních časů NMR signálu se
zároveň vytvářejí i obrazy příčných řezů v
relaxačních časech T1 a T2
(označují se jako T1
či T2 - vážené
obrazy). Množina obrazů příčných řezů pro různé hodnoty
souřadnice z pak vytváří 3-rozměrný
tomografický obraz vyšetřované oblasti v protonové
hustotě a relaxačních časech v jednotlivých "voxelech".
Pomocí počítačové grafiky pak již lze vytvářet obrazy
libovolných řezů vyšetřovanou oblastí, které jsou jasově
modulovány v široké škále odstínů šedi (od bílé až po
černou), k odlišení struktury tkání a orgánů.
Základním předmětem zobrazení metodou NMRI
jsou vodíková jádra - zobrazení protonové
hustoty a relaxačních časů. Někdy se proto NMRI označuje
jako "vodíkové topografické zobrazení".
Intenzita takového NMR obrazu odráží v každém místě
především množství vody ve zkoumané tkáni
a charakter vazby a rozložení molekul vodíku v buňkách a
extracelulárním prostoru, jakož i rozložení tuku a
proteinů. Na základě těchto strukturních rozdílů mohou
být v MRI obrazech od sebe rozlišeny různé tkáně
- např. voda, sval, tuk, šedá a bílá hmota v mozku.
Obecně jsou na obrazech NMRI lokálně zachyceny
dvě základní informace:
1. Distribuce hustoty jader
vytvářejících nukleární magnetickou rezonanci -
nejčastěji protonové hustoty PD vodíku v
tkáni. Obrazy PD v podstatě zachycují anatomickou
stavbu tkání a orgánů, jsou do značné míry
podobné rentgenovým obrazům CT, které mapují elektronovou
denzitu tkání.
2. Distribuce relaxačních časů
T1 a T2 souvisejících s chemickým
složením a strukturním stavem
tkáně v jednotlivých místech. Takové obrazy se nazývají T1 a T2 - vážené.
O tom, do jaké míry bude ve výsledném obrazu
MRI zastoupena protonová hustota PD, časy T1 a T2 - jak a čím bude tento obraz modulovaný
- "vážený" - rozhodují pulsní
sekvence: časový sled vysílaných RF impulsů a
odezvových signálů "echa" (bude
podrobněji diskutováno níže).
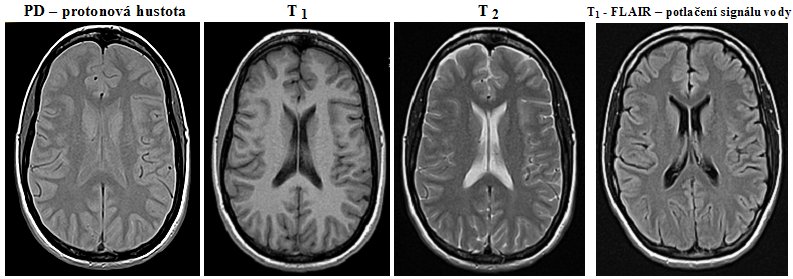
Obr.3.4.5 MRI obrazy mozku (transaxiální řez,
bez patologie) v protonové hustotě, relaxačních časech T1 a T2 a ve speciální sekvenci FLAIR pro potlačení
signálu vody.
(MRI obrázky mozku pořídil MUDr.
Jaroslav Havelka, vedoucí odd. MRI RDG ústavu FN Ostrava)
Protonové hustoty a zvláště
relaxační časy jsou jiné nejen pro různé
druhy tkání (viz výše uvedená tabulka), ale liší se i v
závislosti na fyziologickém či patologickém stavu téže
tkáně. To činí z NMRI zobrazení významnou diagnostickou
metodu v medicíně, včetně oblasti nádorové
diagnostiky.
Pozn.: Podobně
jako u rentgenové diagnostiky, i u NMRI se pro zvýšení
kontrastu zobrazení určitých struktur (např. dutin či cév)
používají kontrastní látky, avšak nikoli
na densitním, nýbrž magnetickém základě - feromagnetické
sloučeniny, většinou na bázi gadolinia.
Pulsní sekvence v
NMRI
U medicínského MR zobrazování je žádoucí vytvářet
snímky s dostatečně vysokým kontrastem mezi
různými druhy tkání, aby MRI radiolog mohl co nejlépe
odpovědět na danou klinickou diagnostickou otázku.
Optimálního kontrastu zobrazení mezi různými tkáněmi s
odlišnými densitami a rexačními časy lze dosáhnout vhodným
způsobem excitace magnetických momentů jader a následného
měření jejich odezvového MR signálu: nastavením parametrů
pulsní sekvence - časového sledu vysílaných
elektromagnetických budících impulsů RF a následných
měření "echa" elektromagnetického signálu
vydávaného relaxujícími jádry. Prvním parametrem je zde intenzita
(energie) vyslaného radiofrekvenčního excitačního pulsu (RF),
která určuje převážný úhel vychýlení (sklopení) vektoru
magnetizace analyzovaných jader - 90° nebo 180°. Čím
vyšší excitační intenzita se vyzáří do analyzované
cílové tkáně, tím vyšší je procento překlopení mag.
momentu jader a tím silnější je pak odezvový signál a více
času je potřeba pro relaxaci. Dalším parametrem je časový
interval TR, ve kterém opakovaně
aplikujeme jednotlivé radiofrekvenční excitační impulsy.
Čím kratší je tento interval, tím méně času je k T1
relaxaci. Třetím parametrem je čas TE (echo time) mezi excitačním
impulsem a detekcí odezvového rezonančního signálu. Čím
delší je tento čas, tím méně budou k měřenému
rezonančnímu signálu přispívat jádra s kratším
relaxačním časem T2. Zcela orientační hodnoty časů
pulsních sekvencí pro získání základních typů MRI obrazů
při B=1,5 T jsou:
PD: TR=1000 ms,
TE=5-30 ms ; T1-vážený:
TR=10 ms, TE=5-30 ms ; T2-vážený:
TR=1000-2000 ms, TE=80-100 ms .
V souvislosti s těmito zákonitostmi bylo
vypracovíno několik význačných sekvencí
vysílání excitačních radiofrekvenčních impulsů a
navazující detekce odezvových relaxačních signálů (v MR hantýrce se někdy nazývají "MRI
techniky") :
->
Saturation -
recovery sekvence, při níž se v pravidelných
intervalech vysílají 90° RF impulsy. Po příchodu každého
RF impulsu se vektor magnetizace otočí o 90° a začne relaxace
s různými časy T1
v různých tkáních. Když přijde další RF impuls, bude
z-složka magnetizace různá v různých tkáních. Vhodnou
opakovací periodou TR excitačních RF impulsů můžeme
nastavit optimální kontrast požadovaných tkání v časech T1. Tato nejjedenodušší MRI
technika se nyní používá již zřídka, byla nahrazena níže
uvedenou inversion-recovery sekvencí, poskytující
vyšší kontrast.
->
Spin - echo
sekvence, sestávající z 90° RF impulsu, po němž následuje
180° RF impuls. Po překlopení vektoru magnetizace do roviny xy
vlivem 90°RF impulsu nastupuje T2 (resp. T2*)
relaxace, při níž dochází k rozfázování. Následný
180°RF impuls však působí "refokusačně" -
překlopí jednotlivé spiny v rovině xy o 180° a spiny se
opět sfázují. Výsledkem je echo-signál v přijímací
cívce, jehož amplituda je závislá na relaxačních časech T1 a T2 tkáně (nepříznivý T2* se zde
neuplatňuje, neboť vliv nehomogenity mag. pole na
rozfázování se eliminuje při sfázování 180° impulsem). Charakter a kontrast zobrazení lze nastavovat pomocí
časů TR a TE . Při krátkém TR i krátkém TE dostaneme T1-vážený obraz, dlouhý TR a
krátký TE poskytne obraz protonové hustoty, dlouhý TR a
dlouhý TE poskytuje T2-vážený obraz. Vzhledem k této variabilitě
možností zobrazení je spin-echo nejčatěji
používanou MRI technikou.
->
Inversion - recovery
sekvence, tvořená sekvencí 180° a následujícího 90° RF
impulsu. Úvodní 180° puls invertuje vektor
magnetizace na opačný, načež probíhá T1 relaxace. S časovým odstupem TI -
doba inverze pak následuje 90° RF impuls, který
překlopí vektor magnetizace do roviny xy. V přijímací cívce
je detekován vf signál závislý na T1 relaxačním čase zobrazované tkáně. Kontrast
obrázku lze vhodně nastavit pomocí času TI. Lze dosáhnout
podstatně kontrastnějšího zobrazení než u saturation
recovery techniky.
Speciálním nastavením času TI = T1.ln2 se dosáhne potlačení obrazu
tkáně, která má tento relaxační čas T1. Nastavením krátkého inverzního času TI (cca 140ms
při magnetu 1,5T) - tzv. short time inversion recovery
STIR - se v obraze dosáhne potlačení signálu
tuku. Naopak prodloužením času TI (na cca 2600ms) - fluid
attenuation inversion recovery FLAIR - můžeme
dosáhnout potlačení signálu vody. Na takto
"očištěných" obrazech lze pak lépe posuzovat
ostatní jemné detaily a anomálie ve struktuře
vyšetřovaných tkání.
->
Gradient - echo
sekvence začíná 90° RF impulsem (který sklopí vektor
magnetizace do roviny xy), po kterém se aplikuje gradient
magnetického pole. Jádra v sousedních atomech tak budou
vykazovat precesi s mírně odlišnou Larmorovou frekvencí, což
způsobí rozfázování spinů. Následuje aplikace druhého
mag. gradientu s opačným znaménkem, který znovu sfázuje
spiny a v tomto okamžiku se měří echo. Používá se pro
získání T2-váženého
obrazu.
->
..........
sekvence ............?doplnit další sekvence?...........?doplnit
obrázek grafického diagramu sekvencí?...
Počítačovou analýzou MRI obrazů, získaných
s vhodnými sekvencemi (zmíněnými
výše), lze vytvářet speciální
modulace obrazů - jako je zobrazení s potlačením
signálu vody či tuku. Další speciální sekvence
se používají pro funkční MRI (zmíněnou
níže):
->
Susceptibility weighted imaging (SWI)
zobrazuje tkáně s mírně rozdílnou magnetickou
susceptibilitou. Používá k tomu prodloužených gradient-echo
sekvenci pro zobrazení v T2*.
Její hlavní variantou je Blood
oxygenation level dependent (BOLD), viz
níže fMRI.
->
Diffusion weighted imaging (DWI) zobrazuje difuzi vody uvnitř elementů
tkáně, projevující se Brownovým pohybem molekul. Používá
se spin-echo sekvence s aplikací 2 gradientů, registruje se
subtilní efekt, při němž Brownovsky pohybující se molekuly
vody vykazují odlišný vztah fázování-defázování při
obrácení mag. gradientu; vede to k nepatrně slabšímu T2 signálu.
Magnetická
rezonanční spektrometrie MRI
Zobrazení magnetickou rezonancí MRI může být doplněno magnetickou
rezonanční spektrometrií (MRS), popsanou výše,
která toto vyšetření obohacuje o další fyziologické
informace. Pomocí analýzy chemického posuvu
Larmorovy frekvence se zde provádí chemická analýza
zobrazovaných struktur in-vivo, např. úroveň cholinu či
lipidu. Chemické posuny jsou velmi jemné, takže tato metoda je
náročná nejen z hlediska signálové analýzy, ale je
zapotřebí i vysoké intenzity (dopručuje se min. 3 T) a
homogenity magnetického pole.
Funkční
zobrazování magnetickou rezonancí - fMRI
Magnetická rezonance může být vhodnou metodou pro
neinvazívní zobrazování funkce různých
tkání a orgánů (spolu s "molekulárním"
zobrazováním v nukleární medicíně - .....). fMRI zatím
nalezla uplatnění hlavně při funkčním zobrazování
mozku, mapování neuronální aktivity.
Neurony (které nemají vnitřní zásoby
energie) potřebují pro svou zvýšenou
aktivitu rychle obdržet cukr a kyslík. Hemodynamická odezva na
tuto potřebu způsobí jednak zvýšení krevní perfúze v
daném místě, hlavně však větší uvolňování kyslíku z
krve, než u neaktivních neuronů. To vede ke změně
relativních úrovní okysličeného oxyhemoglobinu a
neokysličeného deoxyhemoglobinu v krvi v místech neuronální
aktivity.
Z tohoto hlediska se používají dva základní
způsoby nepřímého mapování neuronální aktivity:
-
Lokální zvýšení perfúze
v místě zvýšené neuronální aktivity - perfúzní fMRI.
-
Změna poměru
okysličené a neokysličené krve v místě
neuronální aktivity. Metoda se nazývá BOLD fMRI (Blood
Oxygen Level Dependent). Změny relativních
úrovní oxy- a deoxy-hemoglobinu mohou být detekovány na
základě jejich mírně rozdílné magnetické susceptibility.
Základní hemoglobin bez navázaného kyslíku (deoxyhemoglobin)
má mírně paramagnetické vlastnosti, avšak pokud je
na něj navázán kyslík (oxyhemoglobin), chová se mírně diamagneticky.
Pokud se v určitém místě mozkové tkáně nahromadí více
deoxyhemoglobinu, získá se z něj poněkud silnější MRI
signál, než z míst, v nichž převažuje deoxyhemoglobin.
MRI funkční zobrazení mozku se provádí po neurologické
aktivaci, buď motorické (např.
pohyb prstů na rukou), zrakové, jazykové
nebo kognitivní .
Fyzikálně-elektronická
realizace NMRI
NMR zobrazení je nejsložitější
zobrazovací metodou. Činnost zařízení pro NMR zobrazení je
elektronicky značně komplikovaná a náročná, takže musí
být řízena výkonným počítačem s
důmyslným softwarem - obr.3.4.4d. V multiplexním
režimu je synchronně řízen proces vysílání
sekvence radiofrekvenčních impulsů, modulace gradientních
magnetických polí, snímání a analýza relaxačních
signálů magnetické rezonance, rekonstrukce a tvorba
výsledných obrazů, jakož i řada dalších transformačních
a korekčních procedur. Jelikož se jedná o harmonické
(sinusové) průběhy, provádí se snímání a rekonstrukce s
použitím Fourierovské analýzy - ve
frekvenčním tzv. K-prostoru. Je to soustava
matic vymezená v paměti vyhodnocovacího počítače MRI, do
jejchž jednotlivých elementů se nahrávají frekvence,
amplitudy a souřadnice MRI signálů. Z těchto
"surových" dat se s pomocí Fourierovy
transformace a dalších analytických metod vytvářejí
výsledné MRI obrazy.
Poznámka:
Na podobném principu jako NMR je založena i elektronová
paramagnetická rezonance (EPR). Zde se využívá
magnetických momentů elektronových obalů atomů.........
Termografie
Termografie je metoda zobrazování rozložení teploty
na povrchu analyzovaných předmětů. Medicínské použití
termografie je založeno na skutečnosti, že některé patologické
děje v organismu jsou doprovázeny změnami
teploty (např. zánětlivý proces zvýšením
teploty), které se projevují i na povrchu těla
v místě nad příslušným ložiskem. Termografické zobrazení
lze provést dvojím způsobem:
¨
Kontaktní
termografie
pomocí kapalných krystalů. Kapalné krystaly
jsou látky, které se z mechanického hlediska chovají jako
kapaliny, ale opticky jako pevné krystalické látky (jeví
optickou anizotropii). V termografii se využívá vlastnosti
některých kapalných krystalů, že v závislosti na teplotě
se různě zabarvují (teplotně-mechanické
změny se projevují na interferenci dopadajícího světla).
Vhodným složením lze připravit tekuté krystaly, které
umožňují barevně zobrazit různá rozmezí teplot. Kapalné
krystaly se dříve natíraly přímo na kůži, opatřenou
podkladem černé barvy. Nyní jsou nanesené na speciální
ohebné fólii, která se přikládá na kůži.
¨
Infračervená
elektronická termografie
pomocí snímání infračerveného záření z
povrchu vyšetřovaných těles speciální videokamerou
citlivou k infračervenému záření. Každé těleso nenulové
teploty vysílá infračervené záření (tepelné
sálání) - elektromagnetické vlnění spojitého spektra o
vlnové délce větší než viditelné světlo. Jeho intenzita
je tím větší, čím vyšší je teplota povrchu; s růstem
teploty se zároveň zmenšuje průměrná vlnová délka.
Používá se v průmyslu a stavebnictví - např. na
infračerveném snímku vytápěné budovy jsou zřetelně
jasněji zobrazena místa horší izolace s vyšším únikem
tepla.
Termografický snímek
povrchu těla, získaný citlivou infračervenou kamerou, může
zobrazit okrsky s abnormálně zvýšenou teplotou
(rozdíly mohou činit i méně než desetiny °C), které mohou
svědčit pro zánětlivý či nádorový
proces v tkáni ležící pod tímto okrskem. Nebo zase okrsky se
sníženou teplotou mohou indikovat poruchu
perfuze, třebas v důsledku uzávěru krevní cévy
(např. žilní trombózy).
Elektroimpedanční
zobrazení
Určitou informaci o vlastnostech tkání můžeme zjistit
snímáním lokální elektrické vodivosti,
resp. impedance vyšetřovaných tkání.
Pomocí elektrod rozmístěných na kůži v okolí
vyšetřované oblasti se do tkáně zavádí slabý elektrický
proud a rovněž pomocí elektrod se snímá rozdělení
elektrických potenciálů na povrchu. Z těchto údajů lze
rekonstruovat prostorové rozložení lokální impedance tkáně
- elektroimpedanční obraz. U nádorové tkáně se
pozoruje odlišná elektrická vodivost od
okolní tkáně. Tato metoda se (zatím ojediněle) používá v mamografii.
Komplementarita
metod
Z tohoto stručného přehledu principu a výpovědí několika
různých zobrazovacích metod vidíme, že každá z metod se na
vyšetřovanou tkáň či orgán dívá z jiného "zorného
úhlu" - zkoumá jiný aspekt morfologie či
funkce. Jinými slovy lze obecně říci, že
jednotlivé zobrazovací metody jsou vzájemně komplementární
- v určitých aspektech se doplňují a
skládají diagnostickou "mozaiku", kterou pak
zkušený klinik interpretuje ve výslednou diagnózu,
z níž pak vychází vhodný způsob terapie.
Status
a úloha nukleární medicíny
Scintigrafie neposkytuje obrazy s tak vysokou rozlišovací
schopností jako CT, nerozpoznává hustotu, teplotu ani
mechanickou konzistenci tkání. Hlavní "parketou"
nukleární medicíny je neinvazívní zobrazování
a kvantifikace struktur a dějů v organismu,
které se vyznačují určitou specifickou funkcí
a metabolismem, které lze
"vystopovat" vhodným radioindikátorem a zobrazit
pomocí zevní detekce záření gama. Míra lokální akumulace
radiofarmaka záleží na intenzitě místních metabolických a
funkčních dějů v orgánech a tkáních. Případné anomálie
a poruchy funkce lze pomocí scintigrafického zobrazení
lokalizovat a kvantifikovat. Poruchy funkce v mnoha případech
předchází poruchám strukturálním - anatomickým a
morfologickým. Proto lze patologické děje odhalit metodami
nukleární medicíny někdy dříve, než jinými zobrazovacími
metodami (typickým příkladem jsou
kostní metastázy karcinomu prsu, prostaty či plic). Rovněž perfuzi
tkání či orgánů a dynamiku průtoku krve
jednotlivými částmi srdce a cévami lze metodami nukleární
medicíny velmi dobře analyzovat.
Velmi důležitá je scintigrafická diagnostika nádorových
onemocnění pomocí cíleného vychytávání specifických
radiofarmak (zvláště monoklonálních protilátek), na niž
může účinně navazovat biologický cílená radionuklidová
terapie - teranostický přístup.
Fúze
obrazů PET
a SPECT s obrazy CT a NMRI
V tomto §4.6 "Vztah scintigrafie a ostatních
zobrazovacích metod" bylo průběžně diskutováno, jak se
jednotlivé diagnostické metody doplňují při
vytváření komplexního obrazu o zdravém či patologickém
stavu jednotlivých orgánů a celého organismu. Hlavním cílem
je skloubit anatomii s fyziologií, či jinak
řečeno funkci s morfologií, aby bylo možno
lépe vyjasnit lokalizaci, biologický charakter a původ
patologických ložisek a abnormalit - přiřadit
ložiska zobrazená na scintigramu konkrétním anatomickým
strukturám v organismu. V oblasti zobrazovacích metod
se při takových multi-modalitních
vyšetřeních snímají a vzájemně porovnávají obrazy CT, SPECT, PET, NMRI a sonografie.
Scintigrafické obrazy poskytují důležité
informace o funkčním stavu tkání a orgánů, avšak
většinou nejsou schopny dát dostatečnou anatomickou informaci
o přesné lokalizaci patologických abnormalit (lézí)
zobrazených scintigraficky. Do okolních anatomických struktur (např. skeletních), které
radioindikátor nevychytávají, se radioaktivita nedostane a na
scintigrafickém obraze nejsou viditelné. Pro lepší a
názornější porovnávání charakteru, velikostí a lokalizace
zobrazovaných struktur je optimální provést simultánní
zobrazení obrazů PET+CT, či NMRI nebo CT+SPECT, do
jediného vhodně barevně modulovaného obrazu - tzv. fúze
obrazů. Jednotlivé snímky jsou zde překryty
v různých barevných kombinacích. Na těchto obrazech, kde je
možno plynule modulovat procentuální
zastoupení jednotlivých obrazů (z kolika
procent se jeden obraz bude promítat do druhého), můžeme sledovat korelaci
fyziologické a anatomicko-strukturní informace. Umožní to přesně
lokalizovat scintigraficky zobrazené léze po
prostorové a anatomické stránce.
Při těchto fúzích se často naráží na
problém, že obrazy z různých modalit byly snímány v různou
dobu, při různém měřítku zobrazení a s odlišnou
geometrickou konfigurací pacienta vzhledem k
zobrazovacímu zařízení. Důmyslné programy počítačové
grafiky jsou sice schopné provádět afinní a
konformní transformace obrazů pro korekci
geometrických vlivů - úpravu měřítka a vzájemné polohy
zobrazených struktur (translace, rotace,
reorientace, zvětšování či zmenšování, křížová
korelace) a dosáhnout tím poměrně
dobrého "slícování" obrazů, avšak některé
odchylky od přesného překrývání sobě odpovídajících
struktur mohou přetrvávat. Pro tento proces geometrického
sladění obrazů se někdy používá poněkud
zavádějící název registrace či normalizace
obrazů. Procedury tohoto druhu se aplikují v řadě oblastí
počítačového zpracování obrazů (např.
v panoramatické fotografii, kartografickém snímání,
astrofotografii).
Hybridní
tomografické systémy - kombinace PET+CT, SPECT+CT, (PET+MRI)
Pro odstranění těchto
problémů, jakož i pro operativní a rychlé dosažení
komplexní diagnostiky, vznikla snaha kombinovat
některé zobrazovací metody do jednoho přístroje.
Výrobci zobrazovacích přístrojů vyvinuli tzv. hybridní
systémy, slučující dvojice přístrojů PET+CT nebo
SPECT+CT (níže je zmíněna i kombinace
PET+MRI). Tyto kombinované systémy mají
tři základní přednosti :
*) Geometrické sladění obrazů CT s
obrazy SPECT a PET
Při fúzi funkčních scintigrafických obrazů
SPECT či PET s anatomickými obrazy CT je důležité, aby se
struktury zobrazené na obou modalitách geometricky
kryly - zobrazovaly se ve stejném místě obrazu. Pro kalibraci
tohoto přesného sladění vzájemného polohového
souběhu zobrazovaných struktur SPECT<-->CT či
PET<-->CT na hybridních přístrojích se používá scinticrafické+CT
zobrazení bodových zdrojů naplněných směsí
radionuklidu (99mTc či 18F) a kontrastní látky ("Fantomy a
fantomová měření", část
"Tomografické fantomy pro SPECT, PET, CT", pasáž "Geometrické sladění obrazů CT s obrazy
SPECT a PET"). Tento
proces geometrického sladění obrazů se někdy (ne příliš výstižně)
nazývá prostorová normalizace či registrace
obrazů.
Hybridní kombinace PET/CT se v
posledních letech stala již standardním vybavením
PET-pracovišť nukleární medicíny; jeho přínos je nesporný,
zvláště v oblasti nádorové diagnostiky. Samostatné PET
kamery, bez CT, se již nevyrábějí.
I
kombinace SPECT+CT je užitečná pro upřesnění lokalizační
diagnostiky, i když zastoupení nádorového zobrazení je u
SPECT nižší. U kombinace SPECT/CT se někdy používá
jednodušší a levnější "nízkodensitní" ("low dose", "nediagnostické") lokalizační CT, avšak toto
řešení není zcela optimální; pro větší univerzálnost se
přednost dává hybridním kombinacím s plnohodnotným diagnostickým
multi-slice CT (které ostatně může být
snížením anodového proudu provozováno i v nízkodávkovém
režimu). V mnoha případech tak kombinace
SPECT/CT pomáhá fyziologicko-anatomickou korelací
zpřesnit diagnostiku.
Hybridní
kombinace PET+NMRI
Zobrazení nukleární magneticlou rezonancí NMRI poskytuje,
oproti CT, lepší rozlišení měkkých tkání, což je
výhodné zvláště v onkologické diagnostice. V posledních
letech je proto snaha vyvinout hybridní kombinaci zobrazovacích
přístrojů PET/NMRI. Přímé spojení
"klasických" technologií PET a NMRI do jednoho
systému však naráží na zásadní potíž: silné magnetické
pole supravodivého elektromagnetu NMRI ovlivňuje pohyb
elektronů mezi dynodami ve fotonásobičích prstencových
scintilačních detektorů v PET (na
elektrony působí Lorentzova síla); v
silném magnetickém poli fotonásobiče přestávají fungovat.
Vyvinuly se však technologie umožňující sloučení PET s
NMRI :
¨ Polovodičové fotodetektory.
Místo klasických fotonásobičů se v prstencovém detektoru
PET použijí polovodičové fotodiody APD
(Avalanche Photo Diode) nebo polovodičové fotonásobiče SiPM
(viz §2.4, část "Fotonásobiče"). Tyto fotodetektory nejsou citlivé na
magnetické pole.
¨ Multipixelové plně polovodičové
detektory (např. na bázi CZT) anihilačních fotonů (místo scintibloků BGO/LSO s klasickými
fotonásobiči nebo SiPm). Vedle lepší
detekční účinnosti a prostorového rozlišení se tím může
dosáhnout i poněkud kratší koincidenční doba (pro lepší TOF). Výhodou
polovodičových detektorů je též jejich nezávislost
na magnetickém poli, což umožňuje použití v
hybridních systémech PET/MR.
Pozn.: Zpočátku
se navrhovala některá provizorní suboptimální řešení :
- Modulace magnetického pole NMRI, které by se zapínalo jen po
dobu vytváření obrazů magnetickou rezonancí, zatímco při
snímání obrazů PET by bylo vypnuté.
- Optická vlákna - světelné scintilace od prstencově
rozmístěných scintilátorů PET by se pomocí optických
vláken vedly k fotonásobičům, umístěným mimo magnetické
pole NMRI.
Tyto bizarní provizorní návthy se neosvědčily,
nefungovaly a v praxi nebyly použity. Jedinou reálnou
možností hybridní kombinace PET/MR je použití magneticky
nezávislých polovodičových fotodektorů, nebo lépe
přímo polovodičových gama detektorů.
Hybridní
kombinace PET/MRI se někdy označuje zkratkou mMRI
- molekulární magneticko-rezonanční zobrazení: MRI
poskytuje zobrazení morfologických a funkčních podrobností
tkáně, PET zobrazuje metabolismus tkáně na
molekulárně-buněčné úrovni. Integrovaný systém PET/MRI
umožňuje v některých případech přesnější identifikaci a
stanovení rozsahu a vlastností maligních nádorů, což může
pomáhat při plánování účinné léčby a posléze i jejího
efektu. Systém může být s využit i v neurologii a
kardiologii.
Kombinace PET/MRI má však i
některé nevýhody, kvůli kterým zatím
nemůže fungovat jako rutinní alternativa PET/CT (dosud se
jedná spíše o specializovaná zařízení) :
- Poměrně dlouhá doba snímání obrazů magnetické
rezonance, která limituje počet pacientů vzhledem k pracovní
směně a krátkému poločasu 18-F; způsobuje též rozmazání
obrazů v oblasti hrudníku a břicha dýchacími pohyby. CT je
nerovnatelně rychlejší, prakticky neprodlužuje PET
vyšetření a poskytuje ostré obrazy i pohybujících se
orgánů.
- Časté kontraindikace MRI (kardiostimulátory,
kovové implantáty, stenty), zatímco CT
nemá žádné kontraindikace (jiné než má PET).
- Obrazy MRI zatím neposkytují přesné denzitní mapy
pro potřebnou exaktní korekci obrazů PET na atenuaci záření
g v
tkáni, tak jak je poskytují obrazy CT.
- Podstatně vyšší pořizovací cena zařízení a
vysoké provozní náklady MRI ve srovnání s CT.
Argument, že MRI je neradiační metoda s nulovou radiační
dávkou, zde není významný. PET gamagrafie samotná zatěžuje
poměrně vyšší dávkou a vhledem ke skladbě pacientů,
kteří budou většinou léčeni radioterapií s mnohonásobně
vyššími dávkami, je dávka od CT zobrazení irelevantní.
Instalovat hybridní kombinaci PET/MRI
jako první či jediný přístroj PET na komplexním
onkologickém centru proto není zcela optimální.
Vhodněší variantou je v současné době osvědčená
kombinace PET/CT; pro rozšíření komplexní diagnostiky
doplněná kvalitním přístrojem nukleární magnetické
rezonance (3 T magnet) v oddělené místnosti či pracovišti, s
využitím počítačové fúze obrazů PET+CT s obrazy MRI. Na
větších pracovištích pak i hybridní kombinace PET/MRI
může být pro řadu indikací úspěšně využívána.
Hybridní kombinace zobrazovacích
diagnostických a ozařovacích
radioterapeutických technologií je diskutována v §3.6
"Radioterapie", část "Modulace ozařovacích svazků".
4.7.
Vizuální hodnocení a matematická analýza diagnostických
obrazů
Diagnostické obrazy RTG
(planární či CT), scintigrafické
(planární, SPECT, PET) a magnetické rezonance MRI mohou
nést řadu informací o fyziologické či patologické
anatomicko-morfologické situaci a struktuře tkání a orgánů,
jejich funkci a metabolismu, přítomnosti abnormalit a
patologických lézí. Pro získání těchto důležitých
diagnostických informací - vyhodnocení obrazů
- lze postupovat v zásadně dvojím způsobem :
¨
Vizuální hodnocení
"zkušeným okem" erudovaného odborníka v oblasti
nukleární medicíny, RTG či MRI diagnostiky. Toto je
základní způsob vyhodnocení (a před
érou digitálního zobrazování to byl způsob jediný...). Na kvalitně nasnímaných obrazech (s potřebným procesingem - jasovou modulací,
filtrací, korekcemi) může zkušený
radiolog rozpoznat řadu abnormalit, poruch,
lézí. Takovýto popis pak může být důležitým vodítkem
pro odhalení a správnou terapii
příp. patologických stavů, jakož následně i pro
posuzování odezvy a účinnosti terapie.
¨
Kvantitativní zpracování,
které pomocí matematické-počítačové analýzy
poskytuje kvantitativní parametry o denzitách
různých tkání a okrsků, vychytávání radionuklidů a funkci
vyšetřovaných orgánů, o průběhu a rychlostech
funkčně-metabolických dějů ("molekulární"
zobrazení). Takto získané kvantitativní
výsledky doplňují a upřesňují vizuální
hodnocení (např. míru metabolické
aktivity vizuálně rozpoznané léze), ale
mohou mít i svou samostatnou důležitost pro posouzení
funkčních dějů v organismu (funkční
stav ledvin, srdce, jater). Nové
speciální metody filtrace a počítačového zpracování
obrazů mohou též "vytáhnout" a zdůraznit některé
detaily, na nativních obrazech nerozeznatelné
- a napomoci tak vizuálnímu hodnocení.
Multifaktoriální
statistická analýza obrazů, radiomika
Vedle základních shora zmíněných strukturních a funkčních
informací mohou diagnostické obrazy v sobě skrývat i
některé dodatečné informace, které nejsou
přímo vizuálně patrné (a neplynou explicitně ani z
kvantitativní analýzy), ale mohou být v principu extrahovány
speciálními sofistikovanými počítačovými metodami rozpoznávání
struktur a analýzy znaků v obrazech.
Příkladem může být analýza vztahu velikosti a tvaru nádoru
(povrchu a objemu), míry vnitřní homogenity či heterogenity
zobrazených lézí a dalších sémantických rysů v obrazech.
Lze analyzovat i topologický tvar a kompaktnost (jako je Hausdorfovská analýza dimenze kontury) a vztah zobrazené struktury s okolními tkáněmi.
Takovým způsobem vyextrahované faktory samy o
sobě neposkytují žádnou individuálně
validní diagnostickou informaci. Teprve když je konfrontujeme
se statistickými soubory vyhodnocení velkého počtu
obrazů stejného druhu získaných u různých pacientů se
spolehlivě popsanou diagnózou (včetně
genového charakteru), způsobem léčby,
odpovědí na terapii a celkovým výsledkem, můžeme - s
určitou pravděpodobností - odhalit některé
podobnosti a shody. To může potenciálně pomoci
zpřesnit diagnózu - nasměrováním na možnost ukázanou touto
podobností - a příp. předpovědět reakci na
příslušný druh terapie a další vývoj onemocnění.
Potřebné porovnávací databáze
lze vytvořit tak, že pro každou uvažovanou diagnózu se standardizovaným
způsobem provede multifaktoriální analýza obrazů u
mnoha pacientů s příslušnou (spolehlivě
ověřenou) diagnózou a kvantifikované
hodnoty vyextrahovaných znaků-faktorů z těchto
obrazů se postupně ukládají do speciálních souborů,
včetně vyhodnocení statistického rozptylu. Při event.
klinickém použití se pak u konkrétního pacienta provede
zobrazení, z něhož se multifaktoriální analýzou
vyextrahují potřebné znaky (stejným
standardizovaným způsobem jako bylo v porovnávací databází) a jejich hodnoty se statistickými metodami
porovnávají - konfrontují - s příslušnými
"vzorovými" hodnotami z databáze. Z "pravděpodobnostních
průsečíků" hodnot několika faktorů lze usuzovat
na určitý pod-typ patologie a příp. předpovědět její
chování.
Tyto metody, založené na "strojovém
učení" a umělé inteligenci, jsou zatím ve
stadiu experimentálního vývoje, vytváření potřebného
softwaru, pokusného sestavování databází faktorů ze
"vzorových" obrazů (template). Pro soubor
těchto metod, využívajících sofistikovaných metod analýzy
obrazů ve spojení se statistickým zpracováním, se v
posledních letech používá název radiomika.
Její perspektivou je stát se "mostem" mezi
radiometrickým zobrazováním a personalizovanou medicínou.
Matematická analýza a
počítačové vyhodnocování v nukleární medicíně
---------------------------- é kliknout é --------------------------
Jako relikt dřívější struktury monografie "Jaderná
fyzika a fyzika ionizujícího záření", v níž byla
zařazena kapitola "Fyzikální a technická problematika v
nukleární medicíně", je počítačové vyhodnocování
scintigrafických studií tvořeno samostatným souborem "Matematická analýza a počítačové
vyhodnocování v nukleární medicíně", na nějž pak navazuje opět samostatná
podrobná monografie "Komplexní počítačové
vyhodnocování funkčních scintigrafických vyšetření na PC - systém
OSTNUCLINE", popisující
konkrétní postupy a algoritmy matematické analýzy a
vyhodnocování scintigrafických studií jednotlivých orgánů.
V této kapitole "Radionuklidová scintigrafie"
je provádění a vyhodnocování klinických scintigrafických
vyšetření popisováno v §4.9 "Klinická scintigrafická
diagnostika v nukleární medicíně".
Dále pak s tímto tématem souvisí práce "Filtry
a filtrace v nukleární medicíně".
4.8.
Radionuklidy a radiofarmaka pro scintigrafii
Abychom pomocí scintigrafie
vůbec mohli něco diagnosticky zobrazit, je třeba vpravit do
organismu g-radioaktivní látku - radioindikátor
či radiofarmakum, jejíž distribuci v
různých tkáních a orgánech pak zobrazujeme. Využívá se
indikátorového či stopovacího principu:
radioisotopy se chemicky chovají úplně stejně jako stabilní
isotopy téhož prvku, avšak jsou prostřednictvím svého
záření "viditelné", což umožňuje jejich
sledování v systému pomocí detektorů ionizujícího
záření, v případě scintigrafie navíc zobrazení
jejich distribuce.
Radiofarmaka jsou speciální
diagnostické či terapeutické přípravky, obsahující radionuklidy,
které jsou zdrojem záření. V jejich molekulách je zabudovám
radioaktivní atom - radionuklidem značíme
vhodnou sloučeninu, která určuje farmakokinetiku dle našich
diagnostických či terapeutických požadavků. Radiofarmakum je
složeno ze dvou hlavních částí :
×
Nosič - specifická biochemická látka
zajišťující farmakokinetické zacílení či
nasměrování ("targeting") do požadovaného
místa, tkáně či orgánu, který chceme zobrazit (nebo
léčit). Nosič je vlastní indikátor funkce,
který se aktivně či pasivně účastní vyšetřovaného
nebo terapeutického procesu v cílové
struktuře. V nejjdnodušším případě je nosičem voda (fyziologický roztok), v níž je
radionuklid rozpuštěn a unášen krevním oběhem, popř.
vzduch při vyšetření plicní ventilace. Většinou se však
jedná o složitější biochemicky aktivní látky
- od anorganických solí, přes cyklické uhlovodíky, cheláty,
disperzní koloidní částice, peptidy, proteinové nosiče,
monoklonální protilátky, imunoglobuliny, radioaktivně
značené buňky (erytrocyty či lymfocyty) - které se selektivně vychytávají
v cílových tkáních. Nosič radionuklidu se volí podle
požadovaného diagnostického či terapeutického výkonu.
×
Radionuklid navázaný na tento nosič,
zajišťující svou emisí ionizujícího záření záření
"zviditelnění" - signalizaci či indikaci
polohy molekul indikátoru (nosiče) v organismu - v našem
případě zobrazení jeho distribuce. Při terapii
pak způsobuje biologické účinky na buňky
tkáně. Vazba radionuklidu by měla být taková, aby nezměnila
biochemické vlastnosti nosiče.
Radiofarmaka pak mohou obsahovat ještě některé pomocné
látky stabilizující či antioxidační.
Radiofarmaka jsou otevřenými
radioaktivními zářiči a po aplikaci do organismu
vstupují do různých metabolických dějů v
závislosti na své (bio)chemické struktuře.
Chemická skladba radiofarmaka určuje jeho začlenění do
kinetiky či do určitých metabolických procesů, zabudovaný
radionuklid svým vyzařováním pak umožňuje buď zevní
detekci distribuce této látky (u
scintigrafie), nebo sledování jeho
množství v odebraných vzorcích (biologických
tekutin, většinou krve nebo moči). V
případě terapie pak záření radionuklidu
vykonává biologické účinky na buňky
tkáně, v němž se radiofarmakum akumuluje (např. likviduje nádorové buňky - §3.6, část
"Radioisotopová terapie
otevřenými zářiči").
Zvolené radiofarmakum by se mělo kumulovat
ideálně pouze v požadovaných cílových oblastech.
V praxi se však radiofarmaka ve větší či menší míře
vychytávají i v jiných tkáních a orgánech,
příp. vytvářejí kontinuální tkáňové pozadí.
Tuto nežádoucí farmakokinetiku je třeba
zohlednit při hodnocení scintigrafických obrazů, jakož i
při posuzování vedlejších účinků - radiotoxicity
- při biologicky cílené radionuklidové terapii (§3.6, část "Radioisotopová terapie").
Radioindikátory v nukleární medicíně jsou
aplikovány v nepatrném stopovém množství,
cca 10-9-10-12 gramu (piko- či nanomolární koncentrace v tkáních) a proto samy nemohou ovlivnit funkci
vyšetřovaných orgánů, ani nemohou způsobovat nějaké
vedlejší či toxické účinky na organismus. Radiofarmaka
proto, vzhledem k nepatrnému a prakticky neměřitelnému
váhovému množství, nelze dávkovat podle jejich hmotnosti
[mg] - hmotnosti "účinné látky", jak je obvyklé u
léků. Radiofarmaka se dávkují pomocí aplikované
aktivity v [MBq].
Pozn.: V tomto ohledu se
radioindikátory používané v nukleární medicíně podstatně
liší od kontrastních látek používaných v rtg
diagnostice. Rentgenová kontrastní látka se aplikuje v
poměrně větším množství (až desítky
gramů), potřebném k vyvolání dostatečného kontrastu
absorbce X-záření. Dochází k její poměrně vysoké
koncentraci v krvi a tkáních, která vzhledem k chemickému
složení kontrastních látek (většinou sloučeniny jódu)
funkci vyšetřovaných orgánů může výrazně ovlivňovat.
Některé kontrastní látky mohou mít i nežádouci až
toxické účinky, mohou vyvolávat alergické reakce. Naproti
tomu radioindikátory používané pro diagnostiku v nukleární
medicíně jsou biochemicky bezpečné a nemají
většinou žádné kontraindikace.
Určitou výjimkou z této
biochemické bezpečnosti jsou radiofarmaka na bázi myších
monoklonálních protilátek. U nich se mohou u
určitého malého procenta pacientů vyskytovat alergické
reakce, způsobené přítomností tzv. HAMA
protilátek (Human Anti-Mouse Antibodies); může pak
dojít k nežádoucí imunitní odpovědi na
přípravek - produkci lidských protilátek proti
monoklonálním myším protilátkám. Před použitím těchto
radiofarmak je proto žádoucí provést laboratorní
biochemický test na HAMA protilátky, jeho pozitivita by pak
měla být kontraindikací k použití těchto přípravků.
Oproti jiným
farmaceutickým přípravkům mají radiofarmaka ještě dvě
další specifika :
«
Časově proměnný obsah látky
nesoucí diagnostický či terapeutický účinek - množství
použitého radioisotopu se vlivem radioaktivní přeměny s
časem exponenciálně snižuje (rychlost tohoto úbytku je různá pro jednotlivé
radionuklidy, podle jejich poločasu rozpadu). S tím souvisí krátká expirační doba
(kterou nelze nijak prodloužit, nezávisle
např. na teplotě skladování).
«
Působení na dálku - emitované
ionizující záření, především pronikavé gama, může
vykazovat biologické účinky - v tomto případě nežádoucí
- i mimo tkáň kde se farmakum distrubuovalo (či dokonce i na jiného pacienta, který se nachází
v blízkosti).
Pro využití scintigrafie v nukleární
medicíně je k dispozici několik g-radionuklidů
(smíšených b-g, čistých g, pro PET pak b+ s následnou emisí
anihilačního g záření) v chemické formě řady radiofarmak,
umožňujících zkoumat různé funkční pochody v organismu.
Způsoby výroby a fyzikální (jaderné) charakteristiky
jednotlivých radionuklidů jsou podrobně uvedeny v §1.6 "Radionuklidy", kde jsou i jejich změřená spektra. Zde
zvlášť zmíníme vlastnosti nejdůležitějších
radionuklidů používaných v nukleární medicíně. Pro
každý takový radionuklid nakreslíme jeho rozpadové schéma,
popíšeme způsoby jeho radioaktivních přeměn, druhy a
energie emitovaného záření. Nakonec pro každý radionuklid
uvedeme spektrum záření gama změřené
scintilačním spektrometrem s mnohokanálovým analyzátorem -
takové spektrum můžeme pak v praxi pozorovat i na
scintilační kameře (je uvedeno i
podrobnější polovodičové spektrum).
Radionuklidy a radiofarmaka pro
jednofotonovou gamagrafii - planární a SPECT
Radiojód 131I
(+ 125I + 123I )
Prvním radionuklidem, používaným v klinické nukleární
medicíně, byl radiojód 131I (T1/2=8 dnů, b- s max. energií
606keV, hlavní energie g je 364keV), který má klíčový význam pro
diagnostiku a terapii onemocnění štítné žlázy
(§4.9.1 "Thyreologická radioisotopová diagnostika"). Aplikuje se perorálně
ve formě 131I-jodidu sodného. Několik let se
používal i radiojódem značený 131I-o-hippuran pro radionuklidovou nefrografii a příp.
scintigrafii ledvin, později byl vytlačen radiofarmaky
značenými 99mTc (viz níže).
Radionuklid
131I se (podle rozpadového schématu na
obr... vlevo) b--radioaktivitou
přeměňuje na excitované stavy dceřinného nuklidu xenonu 131Xe, který je již
stabilní (neradioaktivní). Dominantní "kanál"
beta-přeměny je na excitovanou hladinu 364,5 keV
(89%), která v 81% deexcituje na základní stav 131Xe a v 6% deexcituje
na hladinu 80keV (která vzápětí deexcituje na základní
stav). Ve 2% nastává rozpad na excitovanou hladinu 722keV, v 7%
na hladinu 637keV. Jednou z excitovaných hladin 131Xe je metastabilní
131mXe hladina o energii 164keV, která se
s poločasem T1/2=12 dní deeexcituje na základní stav jádra 131Xe. Na tuto
metastabilní hladinu probíhá jen 0,38% rozpadů 131I a navíc její
deexcitace podléhá vnitřní konverzi, takže jen cca 0,021% je
emitováno jako záření gama 164keV. Po cca 14 dnech je
dosažena radioaktivní rovnováha, kdy aktivita 131I se rovná
aktivitě 131mXe.

Obr.... Rozpadové schéma a gama-spektrum radiojódu 131I
Ve spektru záření gama 131I dominuje hlavní fotopík zachycující energii
záření g 364keV. Směrem k vyšším energiím
jsou patrné dva slabší píky 637 a 723 keV. V oblasti
nižších energií pak vidíme rovněž slabší píky 284 a 80
keV, úplně na začátku spektra pak charakteristické
X-záření Ka,b xenonu 30keV (nízkoenergetické
linie La,b 4-5keV na běžném scintilačním detektoru nevidíme). Slabý fotopík 164keV z metastabilního 131mXe není příliš
patrný, protože leží v oblasti Comptonova rozptylu hlavní
energie 364keV (interferuje s píkem zpětného rozptylu)- je
analyzováno v "131I".
Pro
in vitro radioimunoanalýzu (RIA, RSA) se
pak používá radiojód 125I (T1/2=60
dnů, EC, X 27+31keV, g 35keV) ....
Pro scintigrafii se používá i radiojód 123I (T1/2=13,1
hod., EC, g 159keV, X 27+31keV ), který má pro tento účel
výhodnější fyzikální vlastnosti než 131I - vhodnější energii g a nepřítomnost b, což vede k
nižší radiační zátěži. Radiofarmaka značená 123I se ojediněle
používají pro scintigrafii ledvin (o-jodhipuran), častěji
štítné žlázy (NaI), srdce (MIBG), dále pro scintigrafii
receptorových systémů v mozku - 123I-ioflupane, 123I-IBZM (§4.9.8, část "Scintigrafie receptorových systémů v
mozku"). Oproti 99mTc má 123I nevýhody ve vyšší ceně, obtížné distribuci
(krátký T1/2) a
poněkud vyšší radiační zátěži.

obr.... Rozpadové schéma a gama-spektrum radiojódu 123I
Technecium
99mTc
Pro nukleární medicínu je vůbec nejdůležitějším
radionuklidem metastabilní technecium 99mTc
(T1/2=6hodin), které
je čistým zářičem gama (Eg=140keV) a
získává se většinou beta-rozpadem molybdenu 99Mo (T1/2=66hod.) v tzv. generátoru
(viz §1.2. "Radioaktivita",
část "Záření gama "). 99mTc je téměř ideálním radionuklidem
pro scintigrafii, na němž byl v podstatě založen celý rozvoj
nukleární medicíny v 60.-90.letech; má
následující výhody:
× 1. Čistý gama-zářič
s krátkým poločasem rozpadu 6 hod. umožňuje, bez rizika významně zvýšené
radiační zátěže, aplikovat pacientům značně vysokou
aktivitu 99mTc (řádu stovek MBq) potřebnou pro získání
kvalitních obrazů u SPECT či dynamické scintigrafie.
Pozn.: Po
deexcitaci 99mTc vzniká 99Tc v základním stavu. To je také
radioaktivní: b--přeměnou se rozpadá na stabilní jádro 99Ru (viz obr.4.8.2),
avšak poločas rozpadu je zde velmi dlouhý - 2,11.105 roků. Jelikož
aktivita preparátu obsahujícího daný počet No radioaktivních jader
je A = No.l, je poměr aktivit
mateřského a dceřinného radioisotopu v poměru jejich
rozpadových konstant l, neboli v obráceném poměru jejich poločasů rozpadu
T1/2. Vztah mezi
aktivitou 99mTc a aktivitou vzniklého 99Tc je tedy dán koefientem »4.10-9. Při aplikované aktivitě řádu 100MBq 99mTc bude aktivita
výsledného 99Tc činit pouhých cca 0,4 Bq, což je hodnota prakticky nulová (neměřitelná,
hluboko pod úrovní přírodního radioaktivního pozadí např.
40K). Z
hlediska nukleární medícíny můžeme tedy výsledné 99Tc
považovat za neradioaktivní.
Opačná situace je však v oblasti jaderných reaktorů (viz
§1.3 "Jaderné reakce", pasáž "Štěpení
atomových jader"), kde 99Tc, vznikající ve
značném množství jako jedna ze zplodin štěpení uranu, je
obtížnou složkou jaderného odpadu s dlouhým poločasem
rozpadu, potenciálně ohrožující životní prostředí.
× 2. Záření g o energii 140 keV
lze velmi dobře kolimovat a účinně
dekovat v tenkém velkoplošném scintilačním krystalu
gamakamery, což poskytuje obrazy s relativně dobrým
rozlišením a citlivostí.
× 3. 99mTc se snadno získává z Mo-Tc-generátoru
(fyzikálně-chemický princip
radionuklidových generátorů je posán v §1.2, část "Záření
gama", pasáž "Radionuklidové
generátory" a v §1.4 "Radionuklidy", část
"Výroba umělých radionuklidů", pasáž "Radionuklidové generátory"). Tyto generátory jsou většinou elučního
typu. Molybdem 99Mo je v "chromatografické" kolonce
nasorbován na nosiči (většinou Al2O3)
v nerozpustné formě oxidu. Po radioaktivní
přeměně jádra 99Mo na dceřinné jádro 99mTc se vzniklý atom technecia vyváže z nerozpustné
vazby; spojí se se 4 atomy kyslíku za vzniku aniontu 99mTcO4- pertechnetátu. Tento dceřinný
produkt je rozpustný ve vodě, čímž může
být promýváním vodou - elucí - odseparován
od výchozího molybdenu (obr.4.8.1 vlevo). Jelikož se eluce
provádí fyziologickým roztokem obsahujícím sůl
NaCl, anionty pertechnetátu se okamžitě vážou iontovou
vazbou se sodíkem za vzniku technecistanu sodného
Na99mTcO4-. V této chemické formě získáváme technecium z
elučního generátoru.

Obr.4.8.1. Eluční 99Mo-99mTc generátor.
Vlevo: Principiální funkční schéma
elučního generátoru. Uprostřed: Technické
provedení sterilního generátoru s evakuovanou eluční
lahvičkou.
Vpravo: Rozpadové schéma molybdenu 99Mo na technecium 99mTc, deexcitace na 99Tc a pomalé
přeměny na stabilní ruthenium 99Ru.
Nové typy sterilních elučních generátorů
používají evakuovanou eluční lahvičku, do
níž se po "napíchnutí" vlivem atmosférického
podtlaku automaticky nasaje fyziologický roztok hadičkou
vedoucí ze zásobní lahvičky přes sorbční kolonku
generátoru s 99Mo (obr.4.8.1 uprostřed). Během cca 30 sekund se
lahvička naplní eluátem 99mTc.
V
§1.2, části "Exponenciální zákon radioaktivního
rozpadu", pasáž "Směsi radionuklidů, rozpadové
řady, radioaktivní rovnováha"
byla odvozena obecná rovnice následného rozpadu radionuklidů A(lA)®B(lB)®C(stabilní).
Aplikujeme-li tuto rovnici (vynásobenou faktorem lTc, abychom z okamžitého počtu jader dostali okamžitou
aktivitu v [Bq]) na náš případ Mo-Tc generátoru 99Mo(lMo=0,0105hod-1)®99mTc(lTc=0,1155hod-1)®99Tc("stabilní")
a vezmeme v úvahu, že 87% 99Mo se rozpadá na metastabilní vzbuzenou hladinu 99mTc, dostáváme pro
časovou závislost okamžité aktivity požadovaného technecia 99mTc vztah: A99m-Tc(t) = 0,957.AMo(t=0) . (e-0,0105.t - e-0,1155.t ),
kde AMo(t=0)
je aktivita 99Mo v čase t=0 předchozí eluce, čas t je v
hodinách. Aktivita 99Mo se s časem T mění podle rozpadového
zákona AMo(T)
= AMo(0).e-lMo.T = AMo(0).e-0,0105.T. Dosazením
tohoto základního rozpadu molybdenu získáme výsledný vztah
pro okamžitou aktivitu eluovaného 99mTc
v čase T od dodávky molybdenového generátoru a v čase
t od poslední eluce:
A99m-Tc(T,t) = 0,957.AMo(0).e-0,0105.T . (e-0,0105.t - e-0,1155.t ) ,
kde AMo(0)
je aktivita 99Mo v čase T=0 dodávky generátoru, časy t a T
jsou v hodinách. Pro stanovení skutečně eluované aktivity 99mTc musíme dále
vzít v úvahu účinnost eluce, která bývá
přibližně 75-85%. Tato časová dynamika aktivity 99mTc při opakovaných
elucích Mo-Tc generátoru je vynesena na obr.2.1.B (d), který
si zde pro názornost uvádíme znovu :

Obr.2.1.B. Časová dynamika radioaktivity ve směsi dvou
radionuklidů.
a) Ve směsi dvou nezávislých radionuklidů X,Y se každý z nich
přeměňuje podle svého vlastního poločasu a celková
aktivita preparátu je daná součtem obou exponenciálních
funkcí.
b),c) V rozpadové řadě dvou
genericky souvisejících radionuklidů X-->Y dynamika rozpadu
závisí na poměru poločasů rozpadu primárního mateřského
radionuklidu X a dceřinného, dále se rozpadajícího radionuklidu Y; v závislosti na
této relaci lX a lY se posléze může ustavit tranzientní nebo
sekulární rovnováha obou radionuklidů.
d) Specifická radioaktivní dynamika u
radionuklidového molybden-techneciového generátoru při
opakovaných elucích dceřinného 99mTc, vznikajícího přeměnou mateřského 99Mo.
Po eluci aktivita 99mTc v generátoru klesne téměř k nule, pak stoupá a
dosahuje (lokálního) maxima za 23 hod. od předchozí eluce,
načež nastává radioaktivní rovnováha a aktivita 99mTc klesá
exponenciálně s poločasem 67 hod. 99Mo. Po 23 hod. od poslední eluce je tedy výtěžek
eluce 99mTc
největší; generátor lze samozřejmě podle potřeby eluovat i
za kratší dobu, avšak s menším výtěžkem 99mTc.
Tyto eluční cykly je možno opakovat
mnohokrát, dokud aktivita mateřského radionuklidu nepoklesne
pod použitelnou mez; pro Mo-Tc generátor o počáteční
aktivitě cca 10-40 GBq
je to cca 7-15 dnů. Relativně dlouhý poločas přeměny
mateřského radionuklidu umožňuje dlouhodobé používání
generátoru a krátký poločas přeměny vznikajícího
dceřinného radionuklidu zajišťuje nízkou radiační zátěž
pacienta.
Pozn.: Dříve se
ojediněle používaly i generátory extrakčního typu
(průchodem melyl-etyl-ketonu vodným roztokem 99Mo se extrahuje
technecistan 99Tc a odděluje se z vodné fáze od mateřského
molybdenu) a sublimačního typu (kde se využívá
rozdílu těkavosti oxidu molybdenového a vznikajícího oxidu
technecistého). Pro přílišnou složitost a provozní
náročnost se nyní již nepoužívají, byly vytlačeny
generátory elučními.
Podrobné rozpadové
schéma 99mTc
je na obr.4.8.2. Výchozí metastabilní hladina 142keV
izomerně přechází nejdříve na hladinu 140,5 keV, odkud se
vyzařuje základní záření gama o energii 140,5keV.
S velmi malým zastoupením 0,02% dochází k přímé deexcitaci
na základní stav, při němž je emitována energie 142,7keV.
Fotony velmi měkkého záření gama 2,17keV prakticky
nepozorujeme, neboť téměř ve 100% podléhají vnitřní
konverzi. Jádro technecia 99Tc v základním
stavu (po izomerním přechodu z 99mTc) je beta-radioaktivní a s velmi dlouhým poločasem 200
000 let se pomalu přeměňuje na stabilní ruthenium 99Ru.
Ve zcela nepatrném procentu dochází k přímé beta-přeměně
99mTc z metastabilní hladiny 142keV na 99Ru
(základní stav jádra 99Tc je
"bypassován") - především na
excitované hladiny 322 a 90 keV 99Ru. Jejich
deexcitací vzniká g-záření o energiích 322, 232 a 90 keV, ovšem zcela
nepatrného zastoupení. Při radioaktivitě 99mTc je
dále emitováno měkké charakteristické X-záření
o energiích » 2-3keV (L-série) a »18-22keV (K-série), jakož i větší počet
nízkoenergetických konverzních a Augerových
elektronů (cca 4 elektrony/1přeměnu), většinou o
energiích »1,6-3 keV, menší množství »120-140 keV.
Ve standardním scintilačním spektru 99mTc
(na scintilačním spektrometru nebo gamakameře) pozorujeme
pouze jeden výrazný fotopík energie 140keV -
obr.4.8.3 vlevo (na polovodičovém
spektrometru můžeme rozlišit i slabou linii 142,7keV). Slabé píky z excitovaných hladin 99Ru (vznikajících z 99mTc
"bypassováním" 99Tc),
především 322keV, můžeme spektrometricky vidět až po
odfiltrování silné přezařující linie 140keV vrstvou cca
4-5mm olova - obr.4.8.3 vpravo v pasáži "Radionuklidová
čistota".

Obr.4.8.2. Energetické hladiny, radioaktivní přeměny a
záření beta a gama 99mTc.
Vlevo: Vznik 99mTc b-přeměnou 99Mo. Vpravo: Podrobné rozpadové
schéma 99mTc.
Energie jednotlivých jaderných hladin jsou v levé části
obrázku počítány od základního stavu 99Tc,
zatímco v pravé části jsou stanovovány od základního stavu
99Ru.
Anionty technecistanu 99mTcO4- se
relativně snadno vážou na řadu biologicky důležitých
látek (po příp. předchozí redukci
technecistanu např. cínatými ionty). 99mTc je schopno
vytvářet cheláty s funkčními skupinami různých
organických látek a poskytovat tak celou řadu radioaktivních
preparátů lišících se svou kinetikou v organismu a
vychytáváním v jednotlivých orgánech.
Radioaktivně 99mTc značená radiofarmaka
Vznikají tak techneciem značená radiofarmaka,
která se po aplikaci do organismu selektivně
vychytávají v určitých cílových tkáních či
orgánech, které mohou být pak na základě zevní detekce
vycházejícího záření g zobrazovány scintilační kamerou. Techneciem
značená radiofarmaka nacházejí široké uplatnění při
statické i dynamické scintigrafii ledvin, jater, plic, srdce,
mozku a dalších orgánů, jakož i v nádorové diagnostice.
Vyjmenujeme zde několik nejčastěji používaných 99mTc-radiofarmak:
V některých aplikacích vystačíme se samotným
eluátem v chemické formě technecistanu sodného Na99mTcO4-, neboť techneciové ionty se chovají podobně jako
ionty jódové. Je to především scintigrafie štítné
žlázy, vyšetření Meckelova divertiklu,
radiokardiografie. V ostatních aplikacích se atomy 99mTc chemicky
navazují na složité biochemické molekuly.
Pro dynamickou scintigrafii ledvin
(§4.9.2., "Dynamická scintigrafie ledvin") se používá nejčastěji
99mTc MAG3
(merkaptoacetyltriglycin)
pro diagnostiku tubulární funkce a drenáže ledvin a DTPA
(kyselina dietylentriaminopentaoctová)
pro zachycení glomerulární filtrace. Pro statickou
scintigrafii ledvin je to pak DMSA
(dimerkaptosukcinát), které se akumuluje v ledvinách úměrně
funkci příslušných míst a několik hodin tam zůstává
fixováno v kortikální zóně v buňkách proximálních
ledvinných tubulů.
Pro dynamickou scintigrafii jater
(cholescintigrafii - §4.9.3 "Dynamická
scintigrafie jater") se používají deriváty iminodioctové kyseliny - 99mTc HIDA
(.......) nebo EHIDA (.........), které se z
krevního oběhu vychytávají polygonálními jaterními
buňkami a dále procházejí intrahepatálními a posléze
vývodnými žlučovými cestami do duodena.
Pro dynamická radiokardiografická
vyšetření (bolusovou
radiokardiografii a rovnovážnou hradlovanou ventrikulografii -
§4.9.4 "Radionuklidová
ventrikulografie" ,"Dynamická
radiokardiografie") se používají 99mTc- značené erytrocyty (většinou
značené in vivo za pomoci premedikace Sn-pyrofosfátem), které po dobu dynamické studie setrvávají v
krevním oběhu.
Pro scintigrafii perfuze tkání
a jejich viability se používají 99mTc-isonitrilové komplexy, které ve
formě lipofilních kationtů pasivně pronikají buněčnou
membránou, vstupují do buněk a váží se tam na cytosolické
proteiny a v mitochondriích viabilních buněk. Radiofarmakum se
akumuluje, v závislosti na prokrvení, ve zdravých viabilních
buňkách, zatímco v buňkách poškozených (např. v důsledku
ischemie) či dokonce odumřelých a nahrazených jizevnatou
fibrózní tkání, k akumulaci nedochází. Distribuce
radioindikátoru v jednotlivých místech vyšetřované tkáně
je pak proporcionální regionálnímu krevnímu průtoku a
viabilitě tkáňových buněk. Pro scintigrafii perfuze
myokardu se nejčastěji používá 99mTc-MIBI
(methoxyisobutyl-isonitril) a 99mTc-Tetrofosmin (§4.9.4
"Scintigrafie
perfuze myokardu"). Isonitrilová radiofarmaka se též používají pro
nespecifickou nádorovou diagnostiku - vykazují
zvýšenou akumulaci ve viabilních buňkách s vyšším
energetickým obratem (uskutečňujícím se prostřednictvím
mitochondrií). Pro scintigrafii perfuze mozku
se používá 99mTc-exametazim HMPAO (hexamethylpropyleneamine
oxime)- §4.9.8 "Perfuzní scintigrafie mozku".
Pro scintigrafii perfúze plic se
aplikují 99mTc značené makroagregáty MAA sérového
albuminu, jehož částice se zachycují v kapilárách plicního
řečiště, úměrně prokrvení jednotlivých částí plic.
Pro ventilační scintigrafii plic se inhaluje
aerosol vhodného radioaktivně značeného inertního
preparátu (většinou 99mTc-DTPA); lepší možnost je inhalace inertního
radioaktivního plynu (viz níže "...").
Pro scintigrafii skeletu se
používají značené fosfátové komplexy (pyrofosfáty a
polyfosfáty), které jsou osteotropní a
vážou se na krystaly hydroxyapatitu; umožňují zobrazit
kostní přestavbu. Nejčastěji používaný je 99mTc-MDP
(metylendifosfonát) - §4.9.7 "Scintigrafie
skeletu".
Další
radionuklidy pro g scintigrafii
Z dalších radionuklidů pro jednofotonovou (planární a SPECT) scintigrafii
můžeme stručně jmenovat např. :
Thalium 201Tl (ve formě chloridu) pro scintigrafii perfuze
myokardu, které jakožto analog draslíku vstupuje do
myocytu přes buněčnou membránu a hromadí se tam
proporcionálně krevnímu průtoku daného místa srdečního
svalu.
Galium 67Ga-citrát pro scintigrafii nádorů a zánětlivých
ložisek.
Pro podobný účel se používá i indium 111In; ve formě 111In značených protilátek pak pro imunoscintigrafii,
např. značený somatostatinový analog 111In-pentetreotid (OCTREOSCAN) pro diagnostiku
neuroendokrinních nádorů - §3.6, část "Diagnostika nádorových onemocnění", pasáž "Molekulární gamagrafické
zobrazení".
Pro radionuklidovou cisternografii
nebo perimyelografii se používá intratekální aplikace 169Yb-DTPA nebo výhodněji 111In-DTPA.
Obr... Rrozpadové schéma a gama-spektrum india 111In
Pro ventilační scintigrafii plic
se dříve používal plynný xenon 133Xe
(komplexní dynamická scintigrafie), nyní se používá plynný
radioaktivní krypton 81mKr, získávaný z generátoru 81Rb (T1/2=4,85hod.) (EC)® 81mKr (T1/2=13s). Proud vzduchu, vedený
trubičkou přes nádobku obsahující vrstvičku mateřského
radionuklidu 81Rb, odnáší uvolňovaný dceřinný 81mKr, který pacient
vdechuje a scintilační kamera pomocí zevní detekce záření g zobrazuje
distribuci tohoto 81mKr v plicních alveolách - statická
ventilační scintigrafie plic. Pro komplexnější
plicní diagnostiku je vhodné kombinovat perfuzní i
ventilační scintigrafii.
Princip generátoru 81Rb/81mKr je v levé části obr....
Mateřské rubidium 81Rb je fixováno v pevné fázi v malé kolonce, přes
kterou se pomocí ventilátoru (vzduchového
čerpadla s regulovatelným výkonem) vede proud elučního
vzduchu. Radioaktivním rozpadem rubidia-81 průběžně
uvolňovaný dceřinný plynný krypton 81mKr je unášený procházejícím vzduchem a vedený do dýchací
masky, z níž pacient vdechuje směs vzduchu a
radioaktivního 81mKr. Do obvodu dýchací masky jsou zařazeny jednocestné
ventily, dále je předřazen směšovací ventil
vnějšího vzduchu pro zajištění volného dýchání.
Vydechovaný vzduch se vede do vymírací nádoby (objemu cca 30 litrů), z níž
vzhledem k velmi krátkému poločasu rozpadu 81mKr vychází již
prakticky neradioaktivní vzduch.
Při
tomto vyšetření plicní ventilace se
vdechovaný vzduch se stopovým obsahem radioaktivního 81mKr dostává do plicních
alveol, přičemž emitované záření gama 191keV je
snímáno gamakamerou. Na scintigrafickém
obraze místa se sníženou aktivitou ukazují oblasti plic se zhoršenou
ventilací, kam se krypton-81m, a tím pádem ani
vzduch, nedostává (buď vůbec, nebo sníženě) - viz §4.9.5
"Scintigrafie plic
(nukleární pneumologie)".

Obr.... Generátor 81Rb/81mKr.
Vlevo: Princip činnosti generátoru. Uprostřed:
Jedno z konstrukčních uspořádání Rb-Kr generátoru. Vpravo:
Rozpadové schéma 81Rb a 81mKr; v černém
poli je scintilační spektrum záření gama 81mKr.
Radionuklidy a radiofarmaka pro PET
Z více než 100 pozitronových radionuklidů většina není
vhodná pro PET zobrazování - z důvodů příliš krátkého
či dlouhého poločasu rozpadu, nevhodných radiochemických
vlastností, nízkého zastoupení pozitronů a vysoké intenzity
nežádoucího elektronového a tvrdého gama záření. Pro
medicínské využití pozitronové emisní tomografie
je k dispozici jen několik b+-radionuklidů,
avšak v chemické formě řady radiofarmak, umožňujících
zkoumat různé metabolické pochody v organismu. Pro
diagnostické zobrazování metodou PET se využívá
koincidenční detekce dvojic fotonů g vznikajících v tkáni
při anihilaci pozitronů z radioindikátoru s elektrony (podrobně bylo popsáno výše "Pozitronová
emisní tomografie"). Používají se především následující
pozitronové radionuklidy :
Radioisotopy galium 68Ga <-versus-> fluor 18F
V současné nukleární medicíně se pro PET zatím
nejčastěji používají radionuklidy 18F (daleko nejčastěji) a 68Ga. Jaké jsou výhody a nevýhody těchto radionuklidů
z hlediska použití v pozitronové emisní tomografii?
Fluor-18 jako radionuklid má velmi dobré vlastnosti pro PET:
Vysoký výtěžek pozitronů (97%) o relativně nízké energii
(max. 633keV) a tím nízkého doletu v tkáni (cca 0,9mm) -
výborné energetické rozlišení PET. Cyklotronem lze
produkovat značně vysoké aktivity 18F mnoha gigaBq. Jeho poločas rozpadu necelé 2 hodiny
umožňuje dopravu na pracoviště nukleární medicíny
vzdálená cca 200-300 km od produkčního cyklotronu. Vedle
základní široce používané 18F-fluor-deoxyglokózy FDG je k dispozici řada dalších
radioindikátorů (zmíněných níže). Donedávna se však
nedařilo fluotem-18 efektivně značit některé peptidy a
monoklonální protilátky.
Galium-68 má o něco menší zastoupení pozitronů (89%). Vyšší
energie emitovaných pozitronů (2900keV) vede k většímu
doletu pozitronů v tkáni (cca 4mm), což má za následek
horší prostorové rozlišení - sníženou schopnost detekovat
malé a blízko sebe uložené léze. 68Ga má relativně krátký poločas rozpadu 68
minut, což omezuje zpožděné PET zobrazování při
pomalejší farmakokinetice radioindikátoru. Též transport do
vzdálenějších PET pracovišť je problematický či
nemožný. Avšak možnost získávat 68Ga pomocí komerčně dostupného 68Ge/68Ga generátoru umožňuje jeho aplikaci na PET
pracovištích bez cyklotronu. Je to však laboratorně a cenově
náročné a množství eluované aktivity 68Ga je poměrně malé (pro cca 2-4 pacienty).
Tyto převažující nevýhody galia-68
vedly ke snaze vyvinout metody, které by i ty ligandy, které se
dosud značily 68Ga (jako jsou ligandy na somatostatinové
neuroendokrinní receptory a především prostatické anti
PSMA), mohly být označeny fluorem 18F. Výrazných úspěchů se dosáhlo především u prostatického
specifického nádorového antigenu PSMA, kde dosavadní 68Ga-PSMA-617
může být nahrazen např. 18F-PSMA-1007 a dalšími
deriváty, včetně teranostické 18F-rhPSMA-7 (srov.
§4.9, část "Kombinace
diagnostiky a terapie - teragnostika", pasáž "Radiohybridní
teranostická radiofarmaka").
Fluoro-deoxy-glukóza
18FDG
Daleko nejčastěji používaným radiofarmakem pro PET je
2-deoxy-2-18F-D-glukóza, zkráceně nazývaná
fluoro-deoxy-glukóza (18FDG). Metabolismus FDG je poněkud odlišný od
metabolismu normální glukózy. Podobně jako obyčejná
glukóza, má i FDG afinitu k buňkám se zvýšeným
metabolismem (zvýšená potřeba cukru - glukózy), kam
se dostává přes příslušné transportní proteiny a
následně je fosforylována. Na rozdíl od pravé glukózy však
FDG není dále metabolizována a v buňce se
proto hromadí. V důsledku toho dochází k
výrazně zvýšené akumulaci FDG v
nádorových buňkách, takže nádorové ložisko se zobrazí s vysokým
kontrastem vůči tkáňovému a krevnímu pozadí. Onkologická
diagnostika proto činí více než 90% všech PET
vyšetření (§3.6, část "Diagnostika
nádorových onemocnění"). 18FDG se též používá k vyšetření myokardu,
kde na základě konsumpce FDG lze posuzovat viabilitu myokardu.
Glukóza
se z extracelulárního prostoru do buněk dostává pasívní
transportem prostřednictvím transmembránových proteinů -
glukózových transportérů. Po vniknutí do buňky je glukóza
hexokinázou fosforylována na glukózo-6-fosfát (analogicky
FDG-6-fosfát). Normální glukóza pak může být konvertována
na glykogen nebo metabolizována na vodu a oxid uhličitý. Tento
metabolismus však u FDG neprobíhá, takže FDG je
"uvězněna" a má tendenci se v buňkách hromadit.
Pro FDG je jediná cesta pro vyloučení zpět z buňky - pomocí
glukózo-6-fosfatázy. V buňkách obsahujících málo
glukózo-6-fosfatázy je koncentrace FDG úměrná spotřebě
glukózy. Naopak ve tkáních, které obsahují hodně
glukózo-6-fosfatázy, je akumulace FDG nižší než odpovídá
metabolismu glukózy. Defosforylace pomocí glukózo-6-fosfatázy
obecně probíhá velmi pomalu, takže se koncentrace
FDG-6-fosfátu v tkáních udržuje stabilní po několik hodin.
Po radioaktivním rozpadu vzniká z 18F neradioaktivní kyslík 18O a z FDG-6-fosfátu vzniká ODG-6-fosfát, který pak
prochází buněčnou glykolýzou jako běžná glukóza.
Nemetabolizovaná 18FDG je odstraňována glomerulární filtrací v
ledvinách a odchází močovými cestami (s
poločasem exkrece asi 2hod.).
18FDG se nejdříve začala používat v nenádorové
diagnostice pro zobrazení lokálního metabolismu glukózy v
mozku a metabolismu glukózy v myokardu. Nyní však má hlavní
uplatnění v onkologii jako radioindikátor pro zobrazení
zvýšené metabolické aktivity nádorových tkání. A naopak
se nehodí pro diagnostiku mozkových nádorů. A není vhodná
též pro diagnostiku ca prostaty - z důvodu poměrně pomalého
metabolismu těchto nádorových buněk a blízkosti močového
měchýře s podstatně vyšším obsahem FDG.
18F-fluorid
sodný (NaF)
se používá pro PET scintigrafii skeletu. Na PET se zobrazují
oblasti v kostech s osteoblastickými a osteoklastickými
změnami, které mohou souviset s nádorovou přestavbou, ale i s
benigními změnami skeletu. Výhodou Na18F je vysoká (až 50% aplikované
aktivity) a rychlá absorbce v kostech,
spolu s rychlým odbourávání nenavázaného radioindikátoru v
krvi. Vede to k získání kontrastních obrazů v krátkém
čase (za méně než 1 hodinu po i.v. aplikaci).
NaF je
iontová sloučenina Na+ a F- iontů. Po i.v. aplikaci je NaF dopraven ke kostem a
fluoridové ionty difundují přes krevní kapiláry do
extracelulární tekutiny. Dochází k výměně 18F-iontů za OH-ionty hydroxyapatitu
Ca10(PO4)6(OH)2 za vzniku floroapatitu. Následně dochází k
zabudování 18F-iontů do krystalické struktury hydroxyapatitu v
kosti. Zvýšený příjem 18F-fluoridu probíhá v maligních kostních lézích v
důsledku většího krevního zásobení, zvýšené
permeability stěn kapilár a rychlejší přestavbě kostní
tkáně. Výhodou Na18F je, že prakticky veškerý 18F-fluorid, který je
krví dopraven ke kostem, se v nich zachytí a naopak vazba na
sérové proteiny je minimální. Vede to k rychlému odbourání
nenavázaného preparátu z oběhu a získání
"čistých" kontrastních obrazů skeletu v krátkém
čase.
Speciální
radiofarmaka pro "molekulární zobrazení" *)
S rozvojem organické chemie, biochemie a
buněčné biologie byla vyvinuta některá radiofarmaka,
jejichž značené molekuly mají afinitu ke zcela určitým
specifickým druhům buněk či procesům na subcelulární
úrovni. Pomocí scintigrafie a vhodného radiofarmaka tak lze
cíleně vyšetřit nejen funkci určitého orgánu či tkáně,
ale selektivně postihnout i zcela určitý typ metabolické nebo
transportní cesty, např. enzymové či receptorové vazby nebo
reakce antigenu s protilátkou. Pro tento účel byla vyvinuta a
stále se vyvíjení speciální radiofarmaka (jak pro
diagnostiku, tak pro terapii), která jsou charakterizována
svými účinky na molekulární úrovni. S
trochou nadsázky se tyto metody lokálního měření a
zobrazení fyziologické odezvy označují jako "biochemie
in vivo".
*) Název "molekulární
zobrazení" samozřejmě neznamená, že
bychom snad zobrazovali přímo samotné molekuly (to bohužel
nedokážeme...), ale zobrazujeme takovou distribuci
radioindikátoru, která je důsledkem a odrazem specifických
biochemických reakcí na molekulární úrovni.
Pro onkologickou diagnostiku je důležité
zobrazení viabilních a proliferujících
nádorových buněk a tkání - §3.6, část "Diagnostika nádorových onemocnění". Vedle shora zmíněné a nejčastěji
používané fluor-deoxy-glukózy 18FDG jsou některá další nádorová
radiofarmaka :
18FLT (18F- 3-fluoro-3-deoxy-thymidin)
je radioaktivně značená forma pirimidinového nukleosidu.
Výrazně se akumuluje v proliferujících buňkách
- zobrazuje aktivitu enzymu thymidinkinázy,
charakterizující intenzitu buněčného dělení. Jelikož
podstatné zvýšení rychlosti mitózy a proliferace buněk je
typickým znakem maligní nádorové tkáně, funguje 18FLT jako tumor-specifický
PET radioindikátor. Poskytuje zpravidla
kontrastnější obrazy proliferujících nádorových lézí
než 18FDG.
Je zvláště vhodný pro monitorování odezvy
maligních nádorů na terapii. Chemoterapií a
radioterapií vzniká často v nádoru i okolí tkáni
zánětlivá reakce, která výrazně zvyšuje akumulaci 18FDG a tím značně
ztěžuje hodnocení ústupu či progrese léčeného tumoru; 18FDG proto není
úplně ideální radioindikátor pro odezvu maligních nádorů
na léčbu, vhodnější je 18FLT.
Thymidin je nezbytný pro
replikaci v dělících se buňkách. Po průchodu thymidinu
buněčnou membránou dochází k jeho fosforylaci, která je
katalyzována cytosolickým izoenzymem thymidinkinázou-1
(TK1), a následně k inkorpopraci do DNA (v průběhu fáze DNA
syntézy buněčného cyklu). Zabudováním fluoru do polohy 3' v
thymidinu však u FLT brání jeho další inkorporaci do DNA.
FLT monofosfát není začleněn do DNA a buněčná membrána je
pro něho neprostupná - je proto metabolicky
"uvězněn" uvnitř buněk. PET zobrazením 18FLT je detekována
enzymová aktivita TK1, stopování obnovy nukleosidů z
degradované DNA. Příjem a akumulace 18FLT tak korespoduje s mírou buněčné proliferace. 18FLT slouží jako
indikátor změn růstu nádorových buněk. Pro
podobný účel byl používán i 11C-thymidin.
18F-fluorocholin (18FCH) je fluorem-18 značený analog cholinu,
základní stavební látky buněčných fosfolipidových
membrán. Slouží pro vizualizaci fosfolipidového
metabolismu v tumorech. Jeví zvýšené vychytávání v
tumorech mozku, prostaty, prsu, plic, jícnu.
Cholin je důležitou
složkou fosfolipidů v buněčných membránách. Cholin je
uvnitř buňek pomocí cholin-kinázy fosforylován na
fosforylcholin a po několika dalších biosyntetických
procesech je nakonec začleněn do fosfolipidů. Stejně se
chová i 18Flourocholin.
Buňky s vysokým metabolismem mají i zvýšený příjem
cholinu v souvislosti s vyššími požadavky na syntézu
fosfolipidů ve svých buněčných membránách.
Pro pozitronovou emisní tomografii se někdy používá i 11C-cholin, jeho
nevýhodou však je krátký poločas rozpadu 11C (20min.).
18F-fluciclovin slouží pro
scintigrafickou PET diagnostiku nádorů prostaty, především u
recidivujícího onemocnění.
Fluciclovin je analog
aminokyseliny L-leucin, který se zde označuje 18F Akumuluje se v
nádoru prostřednictvím aminokyselinových transportérů.
Vzestup transmembránového transporzu aminokyselin se vyskytuje
v ca prostaty v důsledku zvýšeného metabolismu aminokyselin
pro syntézu energie a bílkovin. Na rozdíl od přirozených
aminokyselin fluciclovin není metabolizován a akumuluje
se v nádorových buňkách - pozitivní PET
zobrazení tumoru.
18FET (18F- O-(2-fluorethyl)-L-tyrosin)
je analog aminokyseliny tyrosinu, na které je přes atom
kyslíku navázána ethylová skupina značená 18F. Zobrazuje
akumulaci aminokyselin v buňkách. Je vhodný pro zobrazení
mozkových nádorů glyomů, jejich rozsahu, ke
zjištění recidivy po terapii a jejímu odlišení od nekrózy.
Tyrosin je jedním ze stavebních kamenů
bílkovin. Ke zvýšené absorbci v buňkách dochází v
důsledku vyššího obsahu aminokyselinových transportérů
typu L. Fluorovaný analog FET však na rozdíl od tyrosinu
nevstupuje do metabolismu bílkovin. PProto se 18FET akumuluje v
buňkách a mapuje zvýšenou spotřebu aminokyselin v důsledku
zvýšeného metabolismu bílkovin v nádorových buňkách. 18FET se (na rozdíl od 18FDG či 11C-MET) neabsorbuje v makrofázích
a umožňuje rozlišení nádorové tkáně od zánětlivé.
Pro diagnostiku mozkových nádorů se někdy používají i
jiné značené aminokyseliny: 11C-methyl-L-methionin (11C-MET), 3-123I-jodo-a-methyl-L-thyrosin (123I-IMT), zkoušely se i dva další analogy L-tyrosinu L-11C-tyrosin a 2-18F-fluoro-L-tyrosin.
Všechny tyto látky mají podobné vlastnosti.
18F- FMISO (18F-fluoromisonidazol) a 18F- FETNIM (18F-fluoroerythronitroimidazol)
jsou radioindikátory zobrazující buněčnou hypoxii,
která je důležitá z hlediska nádorové angiogeneze a pro
plánování radioterapie (radiosenzitivita, kyslíkový efekt -
viz §3.6, část "Fyzikální a radiobiologické faktory
radioterapie ").
Nitromidazoly pasivní
difusí prostupují buněčnou membránou do cytoplasmy, kde jsou
redukovány intracelulárními nitroreduktázami. Vzniklý
nitro-radikál R-NO se dále může redukovat na R-NH2, které jako silné
alkylační činidlo reaguje s makromolekulami - s DNA, RNA, s
proteiny. V buňkách s dostatkem kyslíku je ale redukovaný
nitromidazol rychle (re)oxidován a odstraňován ven, další
reakce již nepokračují a reakční zplodiny se tam nehromadí.
V buňkách se sníženým obsahem kyslíku však dochází ke
shora uvedené posloupnosti redukčních reakcí za vzniku
stabilnějších kovalentních vazeb s biomolekulami, jejichž
rychlost je nepřímo úměrná intrecelulární koncentraci
kyslíku. 18F značené deriváty nitromidazolu jsou tak
"uvězněny" v buňkách hypoxické tkáně. K této
akumulaci 18FMISO přitom dochází pouze u buněk s aktivními
nitroreduktázami, takže k hromadění radioindikátoru
dochází pouze v živých hypoxických buňkách, nikoli v
nekrotických.
Dalším PET radiofarmakem pro zobrazení hypoxie je 64Cu-ATSM
(acetyl-methyl-thiosemikarbazon).
18F- Florbetaben, 18F- Flutemetamol, 18F- Florbetapir
jsou 18F-značené
polyetylelenglykol stilbenové deriváty s vysokou
specifickou afinitou pro beta-amyloidní plaky.
Používá se pro scintigrafickou vizualizaci amyloidózy
především u Alzheimerovy choroby v mozku, lze jej použít
též u amyloidózy myokardu.
Imunoscintigrafie
Důležitou metodikou "molekulárního zobrazení" je imunoscintigrafie,
založená na vysoce specifickém charakteru imunologických
reakcí antigen-protilátka. Protilátka, označená vhodným
radionuklidem (99mTc, 18F, 68Ga, 111In, 131I, 123I), se po aplikaci selektivně naváže na příslušný
nádorový marker (antigen), načež vnější
detekcí záření gama pomocí gamakamery můžeme lokalizovat
příslušný nádor. Potřebné protilátky jsou buď
humánního původu, nebo se získávají ze séra imunizovaných
zvířat metodou tzv. lymfocytární hybridizace, která
umožňuje připravit homogenní tzv. monoklonální
protilátku - §3.6, pasáž "Monoklonální protilátky". Používají se především v nádorové
diagnostice, ale i např. v diagnostice zánětlivých
ložisek pomocí antigranulocytárních
monoklonálních protilátek, jako jsou 99mTc-sulesomab a 99mTc-besilesomab (§4.9.6 "Scintigrafie
zánětlivých ložisek").
Neuroendokrinní nádory
Pro gamagrafické zobrazení neuro-endokrinních nádorů
(včetně pankreatických) jsou vhodné radioindukátory
vychytávající se vazbou na somatostatinové receptory.
Používá se např. 68Ga-DOTATOC (zkoušel
se též 11C-5-hydroxy-tryptophan
5-HTP). Tato diagnostika může sloužit i
pro posouzení (predikci) následné radionuklidové terapie
pomocí 90Y-
nebo 177Lu-DOTA
radiofarmak - teranostika (je diskutováno v §4.9, pasáž "Kombinace
diagnostiky a terapie - teranostika").
V poslední době se pro
nádorovou diagnostiku zkoušejí receptory gastrin
uvolňujících peptidů (GRP) na bázi bombesinu, značené
např. 18F.
Bombesin *) je peptid složený ze 14
aminokyselin. Tvoří se v tenkém střevě a antru, má
stimulační účinek na pankreatickou a žaludeční sliznici.
Je silným antagonistou neurotransmiteru gastrin releasing
peptidu (GRP). Ukázalo se, že může být exprimován
několika buněčnými liniemi karcinomu, kde může endokrinním
způsobem stimulovat růst nádorových buněk přes
bombesin-receptory na membránách těchto buněk. Bombesin tak
může být nádorovým markerem pro karcinom prostaty,
plic, žaludku, neuroblastom a další.
*) Poněkud bizarní název "bombesin"
vznikl při objevu této látky, která byla poprve izolována z
kůže žáby kuňky obecné (lat. Bombina bombina).
.........doplnit............
Nádory prostaty
Velmi perspektivním pro zobrazování a terapii karcinomu
prostaty se jeví membránový antigen PSMA
specifický pro prostatu. Radioisotopově označené malé
molekuly inhibitorů PSMA se s vysokou afinitou
vážou k nádorovým buňkám ca prostaty (které
vysoce exprimují PSMA), což umožňuje
scintigrafické zobrazování těchto lézí i jejich
radionuklidovou terapii - v závislosti na použitém
radionuklidu. Pro scintigrafické zobrazení
planární a SPECT lze použít 99mTc-MIP-1404, pro PET zobrazení 18F-DCFBC nebo 68Ga-HBED-PSMA, nověji 68Ga-PSMA-11. Nejlépe se pro PET
scintigrafii prostatických nádorů osvědčuje 18F-PSMA
(18F-PSMA-1007).
Pro cílenou radionuklidovou terapii ca prostaty
se zkoušel 131I-MIP-1095, nejlépe se však zatím osvědčuje 177Lu-J591
a nověji 177Lu- či 225Ac-PSMA-617.
Vedle diagnostiky se rozpracovávají i možnosti terapeutického
využití monoklonálních protilátek jakožto nosičů
vhodných radionuklidů beta či alfa s radioterapeutickým
účinkem, příp. vhodných chemoterapeutických látek.
Použití monoklonálních protilátek v (neradioisotopové)
chemoterapii (biologické léčbě) nádorových onemocnění je
diskutováno v §3.6, část "Terapie
nádorových onemocnění",
v radionuklidové terapii pak v části "Radioimunoterapie".
Značená
cytostatika
Pro monitorování a predikci
chemoterapie nádorových onemocnění byly vyvinuty metody
radioaktivního označení různých druhů cytostatik (o cytostatikách je podrobněji pojednáno v §3.6,
část "Terapie
nádorových onemocnění"). Diagnostická aplikace takových radiofarmak
umožňuje zobrazit, kde se tyto cytostatika vychytávají a
nakolik pronikají do nádorových ložisek. Takto se budou
příslušná cytostatika vychytávat i při vlastní
chemoterapii - podle toho lze usuzovat na účinnost léčby ("teranostika").
Jedním z takových radioisotopově
značených cytostatik je 18F-paclitaxel (zatím se zkouší v
preklinických studiích). Pro předběžné mapování
distribuce některých cytostatik lze použít i 99mTc-MIBI,
které má podobnou kinetiku buněčného vychytávání jako doxorubicin
a cisplatina.
Apoptická
radiofarmaka
Novou zajímavou skupinou jsou radiofarmaka
pro zobrazení buněčné apoptózy. Jedná se o
organické molekuly (buď proteiny, nebo poměrně malé
molekuly) značené vhodným radionuklidem (např. 99mTc, 18F), které mají
afinitu k buňkám, jež jsou v ranném stádiu apoptózy
(programované buněčné smrti - viz §5.2
"Biologické účinky ionizujícího
záření", pasáž "Mechanismy buněčné smrti"). Proteiny se navazují na
jejich povrch (na fosfolipidy odkryté na povrchu apoptických
buněk), malé molekuly pronikají přes membránu buněk a
akumulují se v cytoplasmě. Výsledkem je selektivní akumulace
radioindikátoru v apoptických buňkách a tkáních, zatímco
do tkání tvořených normálními viabilními buňkami, ani do
tkání nekrotických, téměř nevstupují. Gamagrafickým
zobrazením distribuce těchto radioindikátorů získáme
pozitivní obrazy těch míst, kde nejintenzívněji dochází k
apoptóze - ať již v důsledku ozáření, vlivem
cytotoxických látek, či ischemie. Molekulárním zobrazením
distribuce buněčné apoptózy můžeme tak monitorovat velmi
ranou odezvu buněk a tkání na terapii (radioterapii
či chemoterapii), již na začátku a v průběhu terapie - viz
§3.6, část "Diagnostika
nádorových onemocnění".
Mohou sloužit i ke zobrazení ischemických ložisek
při srdečním či mozkovém infarktu. V klinické praxi byly
úspěšně odzkoušeny dva druhy takových radiofarmak pro
zobrazení apoptózy (třetí je ve stádiu
laboratorního zkoušení):
- 99mTc-annexin V - je to protein, který se
váže na fosfolipidy, odkrývané na povrchu buněk
podléhajících apoptóze. Annexin V se získává z placenty a
techneciem se značí prostřednictvím hydrazino nicotinamidu: 99mTc-6-hydrazinonicotin
(HYNIC)-annexin V. Pro podobné vlastnosti
se zkouší 99mTc-Duramycin;.
- 18F-ML-10
[2-(5-Fluoro pentyl)-2-metyl malonic acid] - proniká
depolarizovanou buněčnou membránou a akumuluje se v
cytoplasmě apoptických buněk;
- Peptid
18F-CP18
[pentapeptid obsahující triazol] - mapuje Caspase-3 aktivitu,
akumuluje se v apoptických buňkách.
Radionuklidy
pro terapii v nukleární medicíně (metodická
poznámka)
Do oblasti nukleární medicíny (jejíž
hlavní metodou je zde pojednávaná scintigrafie) je
organizačně začleněna i terapie otevřenými
radionuklidy. Z hlediska našeho fyzikálního pohledu,
a též z hlediska mechanismu účinku a cíle použití, jsme
však tuto radioinuklidovou terapii zařadili do §3.6 "Radioterapie",
část "Radioisotopová terapie
otevřenými zářiči".
Tam tedy nalezneme i radionuklidy používané v nukleární
medicíně pro terapeutické účely.
Příprava radiofarmak
Jak bylo výše uvedeno, radiofarmaka jsou složena za dvou
základních obsahových složek: radionuklid
emitující ionizující záření a nosič na
který je navázán a který jej v organismu přivádí k
potřebnému cíli - do určitých buněk, cílových tkání a
orgánů.
K přípravě radiofarmak - radioisotopovému značení
- se vyžívají tři základní radiochemické metody :
×
Isotopová
výměnná reakce,
při níž je určitý stabilní isotop ve sloučenině nosiče
chemicky nahrazen (vyměněn, "vytěsněn") svým
radioaktivním isotopem, přidaným do reakční směsi. Takto
vzniklá značená látka má stejné chemické i biologické
vlastnosti jako látka výchozí, neboť její molekuly jsou
chemicky shodné s molekulami původními.
×
Chemická
syntéza,
při níž se radioaktivní atomy chemicky zabudují na
příslušné místo do molekuly nosiče, nejčastěji pomocí
koordinačně kovalentní vazby, tak aby vzniklá komplexní
sloučenina měla požadované vlastnosti. K tomuto
značení se často používají tzv. cheláty (jako je EDTA, DTPA), které se
jednou svou částí navazují na molekulu nosiče a jejich
druhá část váže atom radionuklidu.
×
Biochemická
syntéza
využívá enzymů a mikroorganismů. Radionuklid, přidaný do
kultivačního prostředí, v živých mikroorganismech vstupuje
do jejich metabolických pochodů a je pak zabudovám v jejich
příslušných metabolitech.
Z hlediska organizace přípravy můžeme radiofarmaka rozdělit
do dvou skupin :
¨ Hotová radiofarmaka - hromadná
výroba,
vyrobená a radioaktivně označená v radiochemické laboratoři
výrobce, dodávaná na pracoviště nukleární medicíny (o
patřičné aktivitě a objemu) a připravená k přímé
aplikaci pacientům. Takto se dodávají radiofarmaka značená
radionuklidy s delším poločasem rozpadu (> cca 2 dny). Jsou
to např. radiofarmaka značená jódem 131I a 123I, dále 111In, 201Tl, 67Ga, 169Yb, v poslední době i krátkodobým 18F a další.
¨ Radiofarmaka připravovaná na pracovišti
- individuální příprava
Požadovaná biochemická látka - nosič - se na
pracovišti nukleární medicíny, v laboratoři radiofarmak,
označí potřebným radionuklidem (příprava "magistraliter").
Tak se připravují především radiofarmaka značená
krátkodobými radionuklidy, hlavně techneciem 99mTc z generátoru,
někdy i 18F.
Vlastní syntéza se dříve prováděla za použití
základních chemikálií, nyní se používají tzv. kity
(angl. kit = souprava nářadí,
stavebních dílů) - kompaktní
souprava neradioaktivních ingrediencí dodávaných
farmaceutickým výrobcem, k nimž se jen přidá roztok
vlastního radionuklidu a příslušná reakce označení již
proběhne automaticky.
Na pracovištích nukleární medicíny se
přípravou a rozplňováním radiofarmak k jejich aplikaci
zabývá radiofarmaceutická laboratoř.
Provádí se většinou ve speciálních boxech
či digestořích opatřených vzduchotechnikou,
zajišťující laminární proudění vzduchu.
Nynější požadavky na čistotu vzduchu (často
přehnané! - viz níže)*) vedou ke
značně složitým a nákladným vzduchotechnickým systémům.
Nové alternativní řešení, zajišťující (bez digestoře a vzduchotechniky)
sterilitu radiofarmak a radiační ochranu pracovníků,
představují kompaktni automatická zařízení
pro počítačem řízené rozplňování
radiofarmak, někdy doplněná možností automatické aplikace
připraveného roztoku radiofarmaka pacientovi. Používají se
zejména v PET pro 18FDG.

Příprava a rozplňování radiofarmak na pracovišti
nukleární medicíny.
Vlevo: Laminární digestoř pro eluci Mo/Tc
generátoru, přípravu a rozplňování radiofarmak na Klinice
nukleární medicímy FN Ostrava.
Vpravo: Kompaktní zažízení pro automatické
počítačem řízené rozplňování radiofarmak.
*) Poznámka autora
- přehnané
požadavky pro přípravu radiofarmak na pracovištích
nukleární medicíny
Z hlediska svého dlouholetého působení v oboru nukleární
medicíny bych si dovolil drobnou kritickou připomínku
k současným normám a předpisům pro přípravu a
rozplňování radiofarmak na pracovištích nukleární
medicíny. Do zhruba 90.let se na pracovištích dělala
skutečná laboratorní radiochemická příprava
radiofarmak, při níž se daným radionuklidem značily
sloučeniny připravované v laboratoři radiofarmak pomocí
chemických postupů (ve zkumavkách,
kádinkách, penicilinkách). Provádělo
se to v běžných chemických digestořích s příp. olověným
stíněním (někdy s odsáváním vzduchu,
jindy ne...), umístěných ve
standardních laboratorních místnostech. Při dodržování
zásad správné laboratorní praxe přitom
nikdy nedocházelo k problémům se sterilitou
výsledených radiofarmak ("žádnému
pacientovi se nikdy nic nestalo").
Od 90.let se stále častěji používaly kity
(podstatně usnadňující přípravu) a již hotová
dodávaná radiofarmaka, která přicházejí sterilní a na
pracovištích se pouze rozplňují k aplikaci
pacientům.
A v této době se paradoxně začaly objevovat a
stále zpřísňovat požadavky na sterilitu prostředí,
v nichž se tyto již podstatně jednodušší manipulace
provádějí..!.. Vede to k enormním investičním a provozním
nákladům, které jsou podle mého názoru fakticky zbytečné
(vyhazují se statisíce ba miliony!)... Jádro nedorozumění je zde v záměně
drobné "magistraliter" přípravy na pracovišti (či
dokonce jen rozplňování), na kterou se úředníci snaží mechanicky
přenášet náročné požadavky, normy a předpisy z
hromadné výroby léků ve farmaceutických
provozech, kde jsou tyto přísné normy samozřejmě
opodstatněné. Lékař v interní ordinaci při natahování
sterilního injekčního preparátu z ampulky či penicilinky do
stříkačky k i.v. aplikaci též nepracuje v aseptickém
prostředí třídy "A" (byl by
to nesmysl)..!..
Dále, úzkoprsé normy a předpisy ohledně
"registrace u nás" jsou
vážným omezujícím faktorem při závádění nových
perspektivních radiofarmak, ve světě již
osvědčených a registrovaných. Vede to k zaostávání
oboru nukleární medicíny u nás, na úkor
pokročilejší diagnostiky a terapie pacientů.
Ostatně, s podobnými
byrokratickými přístupy se setkáváme i v oblasti radiační
ochrany (srov. §5.8, závěrečná poznámka "Byrokratické požadavky radiační ochrany").
Způsoby podávání
radiofarmak
Z hlediska aplikační formy se používají tři druhy
radiofarmak :
- Parenterální
radiofarmaka podávaná nejčasteji intravenózně,
někdy subkutánně či intralubálně. Jsou to
většinou vodní roztoky, disperze, koloidy, suspenze. Jsou zde
kladeny vysoké požadavky na sterilu a apyrogenitu.
- Perorální
radiofarmaka mohou být ve formě roztoků i tuhých
látek. Nejčastěji to jsou roztoky či kapsle radiojódu
podávané při terapii štítné žlázy, nebo tekutá či
pevná sousta polykaná při vyšetření jícnu a evakuace
žaludku.
- Inhalační
radiofarmaka jsou předeším radioaktivní plyny
(jako je krypton 81mKr), nebo plynné disperze značených
radiofarmak (např. 99mTc DTPA) produkované v nebulizátorech,
vdechované spolu se vzduchem při vyšetření plicní
ventilace.
Kvalita a čistota radiofarmak
Vlastnosti použitého radiofarmaka primárně ovlivňují
scintigrafickou diagnostiku; nevhodný, nekvalitní či
znečistěný radioindikátor může vést k nepřesné ba
chybné diagnostice, k neúčinné radionuklidové terapii,
popř. může mít i nežádoucí vedlejší účinky pro
pacienta. Z našeho fyzikálního a metodického hlediska je
důležtou vlastností především čistota
radiofarmaka, kterou lze rozdělit na dvě kategorie :
v Radionuklidová
čistota
Jaderné reakce (viz §1.3
"Jaderné reakce a jaderná energie", část "Druhy jaderných reakcí"
a §1.4, část "Výroba umělých
radionuklidů"), kterými se vyrábějí vlastní radionuklidy
používané pro značení radiofarmak, většinou probíhají různými
způsoby a vedle požadovaného radionuklidu mohou vést
ke vzniku i jiných radionuklidů (téhož prvku
nebo i jiného prvku). Množství těchto radionuklidových
nečistot závisí na použitém terčíku, druhu a energii
ozařujících částic a posléze i na způsobu separace
a izolace daného radionuklidu.
Jsou tři základní zdroje
radionuklidových nečistot (+ jeden speciální u
radionuklidových generátorů) :
1. Materiál
terčíku se nikdy nepodaří
připravit ve 100% "mononuklidové" čistotě
požadoveného terčíkového nuklidu. Vždy jsou přítomny
stopy jiných isotopů daného prvku, nebo i jiných prvků.
Jaderné reakce pak mohou z těchto příměsí v terčíku
produkovat jiné radionuklidy než je požadovaný.
2. Různé
jaderné reakce - i při stejném
nuklidovém složení terčíku mohou jaderné reakce probíhat
různými "kanály" s různou pravděpodobností. Při
ozařování neutrony jsou to nejčastěji reakce (n,g), ale mohou
nastávat i (n,p) nebo (n,d) a pod., při ozařování protony
pak reakce(p,g), (p,n), (p,d) a pod.; podstatně to závisí na
energii. I ve zcela čistém terčíku tak může vznikat směs
různých radionuklidů.
3. Radiochemická
separace směsi radionuklidů,
vzniklých jadernými reakcemi při ozařování, je
technologicky obtížný proces, který se nemusí dařit se
100%-ní účinností. V konečném produktu tak mohou být
obsažena stopová množství jiných radionuklidů - radionuklidové
nečistoty.
4. U
generátorových radionuklidů se
do požadovaného dceřinného radionuklidu může dostat
radionuklidová nečistota dvěma způsoby :
¨ Z
radionuklidových nečistot obsažených v mateřském
radionuklidu.
¨ Do
dceřinného radionuklidu se může uvolňovat i stopové
množství mateřského radionuklidu. Např. v Mo-Tc generátoru
do eluátu 99mTc může pronikat malé množství mateřského 99Mo, nebo v Ge/Ga
generátoru se do eluátu dceřinného 68Ga může uvolňovat i malé množství mateřského 68Ge.
Radionuklidová čistota je
podíl radioaktivity požadovaného (deklarovaného) radionuklidu
na celkové aktivitě preparátu. Obvykle se však udává
opačná veličina - obsah radionuklidových nečistot
- kontaminantů; vyjadřuje se většinou v procentech.
Přípustný obsah radionuklidových nečistot je pro každý
radioindikátor uváděn v příslušné normě pro jeho
přípravu (např. pro eluát 99mTc nesmí
radionuklidové nečistoty přesahovat 0,1%).
Měření
radionuklidových nečistot
Přesné stanovení obsahu radionuklidových
nečistot se provádí spektrometrickým měřením
záření g pomocí scintilačního NaI(Tl) nebo polovodičového
Ge(Li) detektoru spojeného s mnohokanálovým analyzátorem.
Změřit velmi nízkou (stopovou) radioaktivitu kontaminantu na
pozadí o mnoho řádů vyšší aktivity základního
radionuklidu není nikterak snadné - slabé záření
kontaminantu je zcela "přezářeno" radiací
základního radionuklidu. Šanci změřit radionuklidovou
čistotu máme v zásadě ve dvou situacích:
1. Vysokoenergetický
kontaminant,
emitující záření gama o podstatně vyšší energii než
základní radionuklid. V tomto případě lze k oddělené
detekci kontaminantu s výhodou použít metodu filtrace
stínící absorbční vložkou: lahvičku se zkoumaným
preparátem umístíme do olověného stínění vhodné
tloušťky (cca 2-5 mm), které téměř úplně pohltí
intenzívní nízkoenergetické záření g základního radionuklidu,
avšak propustí značnou část slabého, avšak
vysokoenergetického g-záření kontaminantu.
2. Dlouhodobý
kontaminant
s poločasem rozpadu několikanásobně delším než má
základní radionuklid. Změříme-li takový preparát s
odstupem 10 či více poločasů rozpadu základního
radionuklidu, obdržíme aktivitu či spektrum kontaminantu,
které již není přezářeno silnou radiací základního
radionuklidu. Tato metoda má nevýhodu, že se jedná o
měření "ex post", za dlouhou dobu po
přípravě a použití preparátu. V některých případech
však jiná možnost není.
Typickým
příkladem vysokoenergetické kontaminace je eluát 99mTc (Eg=140keV), který
může být kontaminován mateřským 99Mo s výraznou linií Eg=740keV. K odstínění
silného záření 140keV použijeme malý olověný kontejner
tloušťky stěny »4-5mm, prošlé záření 740keV můžeme již měřit
scintilačním detektorem, bez nebezpečí jeho zahlcení
mohutným primárním zářením 99mTc, které je Pb-stíněním pohlceno. Pro
kvantitativní stanovení je samozřejmě třeba mít detektor
pro danou stínící a geometrickou konfiguraci předem
okalibrován etalonem 99Mo. Takto změřenou aktivitu kontaminantu pak
podělíme celkovou aktivitou 99mTc a získáme podíl radionuklidové nečistoty 99Mo.
Na obr.4.8.3 je v levé části standardní
scintilační spektrum 99mTc (lahvička s aktivitou cca 10kBq přiložená přímo
ke scintilačnímu detektoru). Zobrazuje se pouze výrazný
fotopík 140keV. V pravé části obrázku je lahvička s 1GBq
eluátu 99mTc
umístěná v olověném kontejnerku s tloušťkou stěn 5mm.
Kromě zbytkového (olovem velmi zeslabeného) píku 140keV na
spektru vidíme pík charakteristického X-záření olova kolem
80keV a v oblasti vyšších energií "vylezly" dva
slabší píky:
- 322keV pochází z deexcitace
vzbuzené hladiny ruthenia 99Ru, na kterou se s nepatrným zastoupením
beta-radioaktivitou rozpadá metastabilní hladina 142keV 99mTc (viz přeměnové
schéma na předchozím obr.4.8.2 vpravo).
- 740keV pochází ze stopové
kontaminace eluátu mateřským molybdenem 99Mo (srov. předchozí obr.4.8.2 vlevo).
Právě z intenzity tohoto píku se spektrometricky stanovuje radionuklidová
čistota eluátu 99mTc.
Stejná měření na polovodičovém detektoru. jsou v dolní
části obrázku.

Obr.4.8.3. Spektrometrické měření radionuklidové čistoty
eluátu 99mTc
(nahoře - scintilační spektrum, dole
- polovodičové spektrum).
Vlevo: Základní spektrum záření gama 99mTc. Vpravo:
Spektrum záření gama měřené přes stínící vrstvu 5mm
olověného kontejnerku.
Pro zjednodušené měření radionuklidové
čistoty eluátu 99mTc se však na většině pracovišťpoužívá běžný
měřič aktivity s ionizační komorou,
opatřený vhodnou stínící vložkou (a
kalibrací). Vhledem k nízké citlivosti těchto měřičů zde
však můžeme stanovit až radionuklidové nečistoty 99Mo přesahující
stovky kBq (pro Tc-eluáty o aktivitě desítky GBq je však pro
kontrolu dodržení normy citlivost postačující). Měření
radionuklidové čistoty eluátu 99mTc stačí provést jen pro 1.eluci z
daného generátoru, kde je riziko potenciální kontaminace 99Mo nejvyšší; pokud
je zde výsledek vyhovující, bute to téměř s jistotou platit
tím spíše i pro další eluce.
v Radiochemická
čistota
Ani chemické reakce, jimiž jsou radiofarmaka
připravována značením požadovaným
radionuklidem, neprobíhají se stoprocentním výtěžkem. Proto
se ve výsledných přípravcích kromě vlastní účinné
radioaktivní látky vždy vyskytuje malé množství nenavázané
aktivity a příp. jiných sloučenin
radioaktivních látek, které nejsou nositeli diagnostického
nebo terapeutického účinku a mohou působit rušivě
či způsobovat nežádoucí radiační zátěž v jiných než
cílových tkáních. Radiochemická čistota je
podíl deklarované chemické sloučeniny daného radionuklidu na
celkové aktivitě přípravku.
Pro kontrolu radiochemické čistoty
připravovaných radiofarmak se používají nejčastěji metody chromatografické
(převážně na papíře či na tenké
vrstvě) - §2.7, pasáž "RadioChromatografie", někdy též elektroforéza -
viz tamtéž pasáž "RadioElektroforéza".
Radionuklidem bývá značena jen určitá část
molekul biologické látky - hovoříme o radioaktivní látce s nosičem
; tzv. beznosičová radioaktivní látka, kde je
radionuklid obsažen ve všech molekulách dané látky, se
obtížně připravuje a používá se jen pro speciální
účely.
Aplikace radiofarmak
Pro vlastní použití v nukleární medicíně (diagnostické
nebo terapeutické) se radiofarmaka aplikují do
organismu, nejčastěji intravenózně, příp. perorálně či
inhalačně (jak bylo uvedeno výše). Pro každý druh
scintigrafického vyšetření je stanoveno určité optimální
množství daného radiofarmaka, vyjádřené v
jednotkách aktivity *) [MBq] radionuklidu,
navázaného v radiofarmaku - s normalizací na tělesné
proporce, většinou váhu pacienta.
*) Radiofarmaka nelze dávkovat podle
jejich hmotnosti [mg] - hmotnosti "účinné látky",
jak je obvyklé u léků. Hmotnosti aplikovaných radiofarmak
jsou totiž neměřitelně malé (často dokonce na hranici
chemické prokazatelnosti). Je to dáno vysokou měrnou aktivitou
používaných radionuklidů s krátkým poločasem rozpadu.
Jedinou možností dávkování radiofarmak je pomocí aplikované
aktivity v [MBq]. Aktivita radiofarmaka k aplikaci se měří v
metrologicky kalibrovaném měřiči aktivity (§2.3, pasáž "Studnové ionizační měřiče
aktivity"). Směrné
hodnoty doporučené aplikované aktivity pro různé druhy
radiofarmak jsou uvedeny v tabulce v §5.7 "Radiační zátěž při radiační diagnostice a
terapii", pasáž "Radiační
zátěž pacientů z radionuklidových vyšetření".
Další vlastnosti radiofarmak, jako je sterilita,
apyrogenita, obsah pomocných látek a jiných
neradioaktivních složek, stejně jako podrobnosti postupů
přípravy konkrétních radiofarmak, jsou sice důležité z
hlediska medicínského použití, jejich diskuse však již
leží mimo rámec našeho fyzikálně a metodicky koncipovaného
pojednání...
4.9.
Klinická scintigrafická diagnostika v nukleární medicíně
4.9.0.
Společné obecné principy klinické scintigrafie
Obecné ideje scintigrafické diagnostiky byly podány na
začátku §4.1 (část "Úloha a definice scintigrafie ; nukleární medicína"). V dalším textu kapitoly
4 byly pak podrobně rozebírány fyzikální principy
gamagrafického zobrazení, fyzikálně-elektronická realizace
různých scintigrafických metod a počítačové zpracování
scintigrafických dat. Zde si tuto fyzikální část doplníme
některými konkrétními klinickými aplikacemi.
Nejprve ale učiníme pár obecných poznámek :
Lidský organismus (jakož i
organismy všech vyšších živočichů)
je velice složitý systém jak svou anatomickou stavbou, tak
především různorodostí vnitřních funkcí a metabolismu. Zobrazovací
metody poskytují některé cenné možnosti jak
"nahlédnout" dovnitř tohoto složitého systému.
Jejich základním výstupním výsledkem je obecně jasově
modulovaný obraz: jas každého elementu obrazu je
určen fyzikálními či chemickými charakteristikami
odpovídajícího místa v tkáni. U rtg zobrazení
je to absorbční koeficient daný hustotou, tloušťkou
a složením tkáně. U sonografie se zobrazuje akustická
impedance daná hustotou, pružností a disipační
viskozitou tkáně. Nukleární magnetická rezonance
zobrazuje hustotu rezonujících jader (především
vodíkových) a relaxační parametry závislé na
vazbě atomů v tkáni. Scintigrafie zobrazuje distribuci
radioindikátoru, ukazující pohyb radiofarmaka a jeho
biochemické vychytávání, přeskupování a vylučování v
důsledku místních metabolických a funkčních dějů (na "molekulární" úrovni).
Většina zobrazovacích modalit - RTG
diagnostika, magnetická rezonance, sonografie - poskytuje obrazy
anatomické struktury tkání a orgánů -
jejich velikosti a tvaru, uložení, nehomogenity hustoty.
Scintigrafické obrazy (planární, SPECT, PET) naproti tomu
mají principiálně funkční charakter.
Nezobrazují žádné "reálné-hmatatelné" objekty,
žádnou morfologii, ale zachycují distribuci -
průchod, akumulaci, vylučování - specifických radioaktivně
značených látek. Míra lokální akumulace radioindikátoru
záleží na intenzitě místních metabolických a funkčních
dějů, což se odrazí v jasové modulaci odpovídajících
míst (pixelů) scintigrafického obrazu. Pokud se radiofarmakum
do vyšetřované tkáně dostává krevní cestou, z míry
vychytávání radioindikátoru lze posuzovat nejen funkci, ale i
míru prokrvení - perfúzi této tkáně či
orgánu (§4.9.4, část "Scintigrafie perfuze myokardu" a §4.9.8, část "Perfúzní scintigrafie mozku").
Funkční zobrazení distribuce radioindikátoru v
příslušných tkáních, orgánech a lézích pak slouží
především k diagnostickým účelům, ale
může být i důležitým východiskem pro radioterapii, v
nukleární medicíně pro biologicky cílenou
radionuklidovou terapii :

Obr.4.9.1 Scintigrafická diagnostika a
radionuklidová terapie v nukleární medicíně
Statická scintigrafie
Statické scintigrafické obrazy zachycující vychytávání
radioindikátoru se hodnotí zpravidla vizuálně,
avšak lze provést i semikvantitativní hodnocení
pomocí poměrů akumulace radioindikátoru v příslušných
oblastech zájmu (ROI) či tkáňovém pozadí. Získávají se
tím určité relativní číselné hodnoty - indexy *).
Série scintigrafických obrazů se hodnotí jak vizuálně, tak
kvantitativně pomocí výpočetních algoritmů (viz níže "Akumulace (uptake) radiofarmaka"
a "Dynamická scintigrafie").
*) Některé softwary umožňují i porovnávání s databázemi
normálových pacientů a stanovení určitých tzv. score
- dohodnutých kvantitativních parametrů usnadňujících
rozhodování mezi normálním a patologickým nálezem.
Radionuklidová gamagrafie tedy zobrazuje
funkční a metabolické děje v tkáních a orgánech, nikoli
jejich anatomickou či morfologickou strukturu. Určité
informace o morfologii však mohou
scintigrafické obrazy poskytovat nepřímo -
odvozením od zobrazení distribuce radioindikátoru ve funkční
tkáni určitého orgánu, či v nádorové tkáni. Nefunkční
okrsky tkání a obecně místa, kam nepronikne radioidikátor,
se nezobrazují. Bývá často užitečné scintigrafické
funkční obrazy doplnit a zkombinovat ("zfúzovat") s
anatomickými obrazy rentgenovými (především SPECT či PET s
CT) - uskutečnit funkčně-anatomickou korelaci
(bylo rozebíráno výše v §4.6 "Vztah scintigrafie a
ostatních zobrazovacích metod",
část "Fúze
obrazů PET a SPECT s obrazy CT a NMRI"). To může vést k
přesnější a komplexnější diagnostice.
Poruchy funkce často předcházejí
poruchám anatomické struktury - zvláště když je tato
porucha způsobena změněnými molekulárně biochemickými
procesy na buněčné úrovni. Radioisotopovými metodami
nukleární medicíny lze proto patologické změny často odhalit
dříve než jinými diagnostickými postupy - ještě
předtím, než jsou strukturální změny viditelné.
Scintigrafie má sice menší prostorovou rozlišovací schopnost
než RTG nebo MRI, ale díky registraci jednotlivých fotonů g je velmi citlivá
na jemné změny distribuce radiofarmaka v důsledku anomálií
metabolismu.
Akumulace (uptake)
radiofarmaka
Míra vychytávání - akumulace
aplikovaného radiofarmaka - ve vyšetřovaných tkáních a
orgánech je důležitým indikátorem jejich fyziologické či
patologické funkce. Tento parametr, zvaný
též uptake (angl. up=nahoru,
take=vzít --> uptake=absorpce) můžeme na scintigrafickém obraze určit na základě
změřeného počtu impulsů ve vyznačené zájmové
oblasti (ROI) vyšetřované struktury, který je v
zásadě přímo úměrný akumulované
aktivitě. Tento počet fotonů, emitovaných z naakumulované
radioaktivity léze či orgánu směrem do detektoru kamery, je
však ovlivněn třemi faktory :
- Je snížený o fotony absorbované nebo
rozptýlené v tkáních nacházejících se mezi vyšetřovaným
orgánem a povrchem těla (pro gama 140keV
to činí cca 50% na 6cm měkké tkáně).
- Může být zvýšený o fotony pocházející
z radiofarmaka shromážděného v okolních tkáních před a za
vyšetřovanám orgánem - tělesné pozadí.
- Nejdůležitější faktor: Radioaktivita ve
vyšetřovaném orgánu je určena aplikovanou aktivitou
a podílem akumulace této celkové aktivity v daném orgánu (tento podíl odpovídá funkční mu stavu orgánu). Naměřený počet impulsů je pak přímo úměrný aktivitě,
akvizičnímu času a citlivosti gamakamery.
Pro stanovení procenta akumulace musíme v prvé
řadě převést aktivitu aplikovanou pacientovi
v [MBq] na odpovídající počet impulsů a
akviziční čas, který detekuje gamakamera. Lze to udělat buď
vynásobením koeficientem citlivosti kamery (§4.5, pasáž "Citlivost (detekční účinnost)
gamakamery")
pro daný radionuklid a kolimátor (pokud
jej máme předem změřený), nebo ad
hoc nasnímáním obrazu aplikované aktivity (stříkačky)
s radiofarmakem (s odečtením aktiity
"prázdné" stříkačky po aplikaci a korekcemi na
poločas přeměny radiofarmaka a akviziční časy). Dále je žádoucí pro upřesnění provést korekci
na absorpci (zeslabení) záření gama ve vrstvě
tkání mezi měřeným orgánem a povrchem těla (§4.3, pasáž "Nepříznivé vlivy u SPECT a jejich
korekce", bod "Absopce
záření gama").
Stanovení procentuální akumulace může být
užitečné především pro posouzení akumulační
schopnosti štítné žlázy (§4.9.1
"Thyreologická
diagnostika", především před
léčbou radiojódem - §..., pasáž "..."), relativní funkce ledvin (§4.9.., "Nefrologická diagnostika") a akumulace radiofarmaka v nádorech při
biologicky cílené radionuklidové terapií (§3.6, část "Radioisotopová terapie"). Na těchto obrazech
nádorových lézí (především na
tomografických PET obrazech s 18FDG) se pro posouzení nádorové
viability často používá standardizovaná hodnota akumulace SUV
(podrobněji popsaná výše v §4.2,
pasáž "Kvantifikace pozitivních
lézí na gamagrafických obrazech - SUV").
Specifičnost
scintigrafické diagnostiky
Specifičnost scintigrafických metod může
být nižší i vyšší než u ostatních
modalit, v závislosti na mechanismu farmakokinetiky použitého
radioindikátoru. Např. u scintigrafie skeletu (§4.9.7 "Scintigrafie skeletu") jsou kostní metastázy vidět dříve než rtg
nebo MRI snímku, ale nelze je odlišit od ložiskových změn
způsobených jinými mechanismy zvýšené osteoblastické
aktivity (záněty, zlomeniny) - vysoká citlivost,
ale nízká specificita. U scintigrafických
metod mapujících cílenou a specifickou vazbu radiofarmaka na
buňky vyšetřované tkáně (scintigrafie nádorů, perfúzní
scintigrafie myokardu či mozku, receptorová diagnostika) může
být scintigrafická diagnostika vysoce specifická.
Dynamická scintigrafie
Vedle zobrazení a lokalizace struktur, v nichž se fyziologicky
či patologicky akumuluje určité radiofarmakum, bývá někdy
důležité posoudit i časovou dynamiku této
akumulace či průchodu radioindikátoru vyšetřovanými
orgány. To je úkolem dynamické scintigrafie,
zachycující časový průběh distribuce radioindikátoru -
jednotlivé fáze průchodu radiofarmaka vyšetřovaným orgánem
- pomocí série sekvenčních snímků
vyšetřované oblasti, snímaných postupně ve zvolených
časových intervalech *). Akviziční časy snímků se volí s
ohledem na rychlost studovaného děje; pohybují se od desetin
sekundy (u rychlých dějů např. kardiologických) až do
desítek sekund či několika minut (ledviny, játra). Celková
doba snímání je dána trváním vyšetřovaného děje,
pohybuje se od jedné minuty do jedné hodiny. Získanou sérii
snímků můžeme hodnotit jednak vizuálně
(sledovat průchod, hromadění a únik radioindikátoru v
různých místech), především ale kvantitativně.
Na obrazech zakreslujeme zájmové oblasti (ROI)
význačných struktur, z nichž konstruujeme křivky
časového průběhu distribuce radiofarmaka. Můžeme pak
provádět matematickou
analýzu křivek - pro význačné body a
úseky křivek se stanovují různé časové intervaly,
poměry, integrály a jiné veličiny, prokládají se
příslušné funkce metodou
nejmenších čtverců, počítají se rychlostní koeficienty nárustu či úniku radioaktivity, křivky se derivují, integrují,
provádějí se filtrace, dekonvoluce a pod. - podle použitého matematického modelu vyšetřovaného procesu. Touto matematickou analýzou křivek časové
závislosti radioaktivity indikátoru v příslušných tkáních
a orgánech můžeme získat diagnosticky důležité kvantitativní
parametry jejich funkce, celkové i regionální.
*) Speciálním druhem dynamické scintigrafie je fázová
scintigrafie srdečního cyklu - EKG hradlovaná
ventrikulografie. Nevzniká prostým sekvenčním
snímkováním, ale periodickým nahráváním a synchronním
skládáním velkého počtu po sobě jdoucích snímků v
různých sobě odpovídajících fázích srdečního cyklu -
vzniká podrobná dynamická scintigrafie jednoho
reprezentativního srdečního cyklu (podrobně bylo
popsáno v §4.4 "Hradlovaná fázová scintigrafie").
Funkční
parametrické obrazy
Při vyhodnocování dynamické scintigrafie můžeme získat
různé kvantitativní parametry funkce nejen
celkové, ale i regionální, lokální. V
krajním případě si můžeme představit, že každý
obrazový prvek - pixel (i,j) obrazové matice budeme
považovat za malou elementární oblast zájmu
(mikroROI). Z této mikroROI můžeme sestrojit křivku
časového průběhu distribuce radioindikátoru v
odpovídajícím místě a matematicky ji zpracovat
pomocí určitého modelu: např. jí proložit exponenciální
či jinou vhodnou funkci a stanovit určitý diagnosticky
vypovídající dynamický parametr - např. rychlostní
koeficient, gradient strmosti, poločas nárustu či poklesu
radioaktivity. Hodnotu tohoto lokálně vypočteného parametru
pak uložíme do stejně lokalizovaného elementu
(i,j) nové obrazové matice, kterou si v paměti počítače
deklarujeme. Toto je provedeno pro všechny pixely obrazu
vyšetřované oblasti. Takovým zpracováním časových křivek
ze všech mikroROI, tj. ze všech pixelů (i,j)
obrazu, dostáváme nový uměle vytvořený
obraz, který již nevyjadřuje naměřené počty impulsů na
scintigramu, ale zobrazuje distribuci určitého
diagnosticky významného parametru vyšetřované
funkce - funkční parametrický obraz,
přehledně mapující lokální rozložení funkce
vyšetřovaného orgánu. Parametrický obraz tedy v
jednotlivých pixelech, místo počtu impulsů, obsahuje číslo,
které charakterizuje nějaký funkční parametr.
Funkční parametrické obrazy se nejčastěji
používají při vyhodnocování hradlované ventrikulografie -
tepový obraz, paradoxní obraz, Fourierovské obrazy fáze a
amplitudy pulzace v jednotlivých místech srdeční komory (viz
níže "Hradlovaná
ventrikulografie", nebo
podrobněji v "Radionuklidová ventrikulografie" knihy "Ostnucline"). Speciální
parametrické obrazy poskytuje tzv. faktorová analýza (popsaná v pracech M.Šámala a H.Trojanové ........).
Clearance
Důležitým globálním parametrem, který může být získán
pomocí dynamické scintigrafie, je tzv. clearance
(ang. clear = čistit). Je to množství (objem) krve či plasmy v organismu,
které se za jednotku času "očistí" od určité
sledované látky. Po jednorázové intravenózní aplikaci
příslušného radioindikátoru sledujeme nejprve jeho akumulaci
a pak jeho únik z krve či plasmy. Rychlost
poklesu koncentrace aktivity v plasmě *) závisí na
eliminační výkonnosti vyšetřovaných orgánů - ledvin nebo
jater; při zhoršené funkci příslušných eliminačních
orgánů se hodnota clearance snižuje. Při dynamické
scintigrafii zkonstruujeme křivku (histogram) ze zájmové
oblasti mimo eliminační orgány, nejlépe z oblasti prekordia
nebo plic. Tato eliminační křivka reprezentuje
časový průběh koncentrace radioindikátoru v krvi/plasmě.
Tuto křivku z "blood poolu" pak vyhodnocujeme
pomocí kompartmentové analýzy - metodou
nejmenších čtverců jí prokládáme bi- či multi-exponenciální
funkce. Eliminační křivka v záseadě vzniká složením
dvou exponenciálních funkcí. První, rychlejší exponenciela,
je projevem poměrně rychlého vyrovnávání koncentrace
radioindikátoru mezi krevním (intravaskulárním)
objemem a intersticiálním prostředím (filtrací plasmy z krevních kapilár do tkáňového
moku při přenosu živin a kyslíku k buňkám) - dilucí do celého distribučního prostoru daného
radiofarmaka. Druhá, pozvolnější složka, je odrazem vlastní
orgánové clearance eliminačním orgánem (ledvinami či
játry). Proložením biexponenciální funkce matematicky
odseparujeme obě složky, přičemž rychlostní koeficient v
pozdější a pomalejší exponenciele udává hledanou hodnotu plasmatické
clearance. Pokud se použitý radioindikátor vylučuje
pouze ve vyšetřovaném orgánu, je to zároveň hodnota orgánové
clearance. Hodnota získaná tímto výpočtem je
relativní [sec.-1]; skutečnou (absolutní) clearanci v [ml./sec.]
získáme vynásobením rychlostního koeficientu hodnotu
celkového distribučního volumu použitého
indikátoru v organismu. Výpočet clearance je popsán v
pasáži "Zpracování křivky blood-poolu - clearance" v knize "OSTNUCLINE".
*) Plasmatická clearance se
dříve měřila vzorkovými metodami: po i.v.
aplikaci radioindikátoru se v určitých časových intervalech
odebíraly vzorky krve a v jejich plasmě se pomocí
scintilačních detektorů měřila aktivita. Pomocí
zjednodušené kompartmentové analýzy se z nich kalkulovaly
(původně grafickou analýzou na semilogaritmickém papíře)
hodnoty clearance.
Tranzitní funkce, tranzitní časy
Eliminační křivku blood poolu lze dále zkombinovat s
orgánovými křivkami a použít ji k tzv. dekonvoluční
analýze, pomocí níž získáme tzv. tranzitní
funkce pasáže radioindikátoru eliminačními orgány
a jejich částmi (např. parenchymem a dutým systémem ledvin,
nebo jaterním parenchymem). Modeluje to hypotetickou situaci,
kdy bychom radioindikátor aplikovali přímo do vstupní cévy
zasobující daný orgán a sledovali dynamiku průchodu tohoto
"bolusu" radioindikátoru vyšetřovaným orgánem.
Na
tranzitních křivkách se dále odečítají tzv. tranzitní
časy, vyjadřující dobu (v sekundách či minutách),
za jakou radioindikátor projde vyšetřovaným orgánem nebo
jeho částí. Hodnotí se minimální, střední a maximální
tranzitní čas.
Matematický
popis dekonvoluční analýzy, získání tranzitních funkcí,
jejich analýzy a interpretace je v pasáži "Dekonvoluce,
tranzitní funkce",
obr.3.4.3 v §3.4 "Dynamická scintigrafie ledvin" knihy "OSTNUCLINE - Matematická analýza a
počítačové vyhodnocování funkční scintigrafie".
Kombinace
diagnostiky a terapie - teragnostika
Teragnostika je obecně léčebná strategie,
která cíleně kombinuje diagnostiku s
terapií. Nové diagnostické zobrazovací metody, zvláště molekulární
zobrazení v nukleární medicíně, umožňují integrovat
individuální (personalizovanou) diagnostiku a cílenou terapii (příp. i prevenci) závažných
onemocnění do společného oboru, pro který se nově začal
používat název teranostika či teragnostika
(vzniklý složením názvů: terapie
+ diagnostika => teragnostika,
angl. theranostics).
Jedná se o jakousi "diagnostiku terapie".
Analýza diagnostiky a možností terapie u individuálního
pacienta umožňuje určit, zda zvolená terapie bude účinná,
a to ještě před jejím zahájením. A dále posuzovat
odpověď na prováděnoui terapii.
V nukleární medicíně teranostika spočívá v
"párování" terapeutických a diagnostických
radionuklidů chelatačně navázaných na vhodnou sloučeninu -
přenašeč/vektor - zaměřenou na konkrétní klinický cíl
(orgán, tkáň, skupinu buněk). Diagnostické radioisotopy při
své radioaktivitě emitují záření gama (buď přímo z jádra, nebo při anihilaci pozitronů), které umožňuje scintigraficky zobrazit
cílovou tkáň. Terapeutické radioisotopy při svém rozpadu
uvolňují nabité energetické částice, jako
jsou alfa, beta (event. Augerovy elektrony), které jsou svými
ionizačními účinky schopné inaktivovat a zabíjet
buňky v cílové tkáni. U takového teranostického
páru ("sladěné dvojice radionuklidů")
diagnostický protějšek může efektivně předpovídat
biologickou distribuci terapeutického radionuklidu.
Pro teranostiku v nukleární medicíně je
optimální, když atom diagnostického gama-radionuklidu (jako je 99mTc, 18F, či 68Ga) má podobnou chemickou
koordinaci elektronů ve valenční slupce jako terapeutický
beta či alfa radionuklid (90Y, 131I, 177Lu, či 225Ac). To umožňuje použít stejnou biochemickou
vektorovou molekulu pro scintigrafickou diagnostiku i
pro následnou radioisotopovou terapii - jen se označí jiným
radionuklidem. Diagnostické farmakum je pak zaměřeno na stejný
molekulární cíl jako terapeutické radiofarmakum, což
umožňuje dopředu stanovit optimální aplikovanou
aktivitu a odhadnout účinnost léčby --> teranostika
:

Obr.4.9.2 Princip teragnostiky při
scintigrafické diagnostice a biologicky cílené radionuklidové
terapii v nukleární medicíně.
Nahoře: Tatáž ligandová cílená
biomolekula se pomocí vhodného chelátoru označí nejprve
diagnostickým radionuklidem (gama nebo pozitronovým) a potom
terapeutickým radionuklidem (beta nebo alfa). Dole: Použití
takto vzniklého diagnostického radiofarmaka pro scintigrafii,
nebo terapeutického radiofarmaka pro biologicky cílenou
radionuklidovou terapii.
Scintigrafie umožňuje stanovit koncentrace
biologicky účinných látek přímo v místech jejich
cíleného působení, což umožňuje optimální a
individuální dávkování, s možností predikce účinků a
monitorování vysledků terapie. Příslušnou biologicky
cílenou látku označíme nejprve diagnostickým
gama-radionuklidem, aplikujeme nízkou aktivitu
a provedeme scintigrafické zobrazení. V případě
úspěšného vychytávání v cílových tkáních (a dostatečně nízkého nežádoucího vychytávání
ve zdravých tkáních - v kritických orgánech) označíme tutéž látku terapeutickým beta- či
alfa-radionuklidem a aplikujeme pacientovi vysokou
aktivitu (na základě
scintigrafie individuálně stanovenou).
Lze téměř s jistotou předpokládat, že tato terapie bude úspěšná..!..
Teranostické
radionuklidy
Radionuklidy vhodné pro theragnostiku mohou být v zásadě
trojího druhu :
1. Jeden radionuklid se smíšenou
radiací beta-+gama, beta-+beta+, alfa+gama, nebo alfa+beta+,
kterým je se označí příslušné biologicky cílené
radiofarmakum. Gama či pozitronová emise umožňuje
scintigrafické zobrazení planární/SPECT nebo PET. Emitované
elektrony beta nebo částice alfa způsobují radiobiologický
terapeutický efekt požadované likvidace patologických buněk
v cílové tkáni, kde se radiofarmakum vychytalo - teranostika.
Takovýto radionuklid, který je schopen zároveň
umožňovat diagnostiku i terapii, můžeme (pracovně) nazvat "monoteranostický radionuklid".
Nejznámějším příkladem takového "monoteranostického"
radionuklidu je klasický radiojód 131I, jehož gama záření energie 364keV umožňuje
provést scintigrafii (planární či
SPECT), zatímco elektrony beta-
mohou vykonávat terapeutický účinek - při podstatně
vyšší aplikované aktivitě. Používá se již celá
desítiletí u radioisotopové diagnostiky+terapie štítné
žlázy (hypertyreózy a metastáz
diferencovaného karcinomu, viz níže §4.9.1), i když název
"teranostika" tehdy nebyl zaveden. Nověji se
používá i monoklonální protilátka tositumomab
značená jódem-131 (Bexxar) pro terapii lymfomů.
V principu lze pro teranostické účely využít
i některé další "monoteranostické" radionuklidy se
smíšenou radiací, jako je lutetium 177Lu. Zatím experimentálním teranostickým radionuklidem
je terbium 149Tb se smíšenou radiací alfa-beta+: pro diagnostiku PET lze využít anihilační
záření z pozitronů+, emitované částice alfa způsobují terapeutický
účinek (doprovodné záření gama zde
pro teranostiku není příliš vhodné; hlavním problémem
149-Tb je složité přeměnové schéma s řadou sekundárních
radionuklidů - viz 149Tb).
2. Dva radioisotopy téhož prvku, z
nichž jeden emituje fotony gama či pozitrony beta+ pro scintigrafickou
diagnostiku, druhý isotop vyzařuje elektrony beta-
nebo alfa-částice pro terapeutický účinek. Označíme-li
těmito dvěma různými isotopy tutéž biochemickou látku,
dostaneme diagnostické radiofarmakum pro scintigrafii a
tepapeutické radiofarmakum, které budou mít identické
biochemické vlastnosti pro dosažení úspěšné
teranostiky.
Příkladem je jód 123I pro scintigrafii a jód 131I pro terapii (používá se
především v thyreologii). Zatím
experimentálními dvojicemi teranostických radionuklidů je
pozitronový isotop 64Cu pro zobrazení PET a beta- isotop 67Cu
pro terapii, podobně 64Sc /67Sc, nebo dvojice 86Y pro PET
diagnostiku a 90Y pro beta-terapii.
3. Dva různé radioisotopy různých prvků,
z nichž jeden emituje fotony gama či pozitrony beta+ pro scintigrafii,
druhý radionuklid je zářičem beta- nebo alfa pro
terapii. Každý z těchto radionuklidů se chelatačně naváže
na tutéž biochemickou látku, čímž
dostaneme příslušné diagnostické a terapeutické
radiofarmakum. Jejich identické biochemické vlastnosti zde již
nejsou 100%-ně zajištěny, mohou být
ovlivněny různými chelátory a složitými chemickými vazbami
- je třeba pečlivě ověřit... V pozitivním
případě bude teranostický přístup rovněž úspěšný.
Novou zajímavou metodou 100% zajištění identické
farmakokinetiky diagnostického a terapeutického radiofarmaka
jsou níže popsaná radiohybridní teranostická
radiofarmaka.
Tento způsob teranostiky se provádí, zatím
většinou experimentálně, s použitím několika
radionuklidů, u řady monoklonálních protilátek za pomoci
různých chelátorů. Pro scintigrafické zobrazení
planární/SPECT/PET se používají radionuklidy 99m-Tc, 111-In,
18-F, 68-Ga, 89-Zr, 124-I, které se kombinují s beta-
radionuklidy 90-Y, 177-Lu, či s alfa-radionuklidy 212-Bi,
227-Th, 225-Ac - při označení vždy téže
monoklonální protilátky. V poslední době se jako
perspektivní jeví např. kombinace (68Ga/177Lu)-PSMA J591 či
(68Ga/225Ac)-PSMA-617 u metastatického ca prostaty.
Radiohybridní
teranostická radiofarmaka
Nově vyvíjenou zajímavou "fintou" je navázat na
cílenou ligandovou molekulu současně (hybridně)
dva chelátory se dvěma potřebnými
atomy, zatím neradioaktivními. Například
přírodní fluor 19F a přírodní lutetium natLu (tvořené 97,4% 175Lu a 2,6% 176Lu). Přidáme-li pak k takovému
preparátu příslušný radioaktivní isotop - buď 18F
nebo 177Lu, označí se mechanismem isotopové
výměny jedním nebo druhým radionuklidem. Podle
potřeby buď 18F pro diagnostiku (lutetium zůstává neaktivní),
nebo 177Lu pro terapii (zde zase fluor zůstává neaktivní). Automaticky to též zajišťuje identickou
farmakokinetiku látky značené diagnostickým a
terapeutickým radionuklidem ve smyslu výše uvedeného bodu 3,
neboť obě molekuly jsou atomově-chemicky identické,
liší se jen isotopově. Je to ideální vlastnost pro teranostiku.
Zatím se zkouší u PSMA 18F/177Lu.

Obr.4.9.3. Princip radiohybridní teranostiky. Nahoře:
Ligandová vektorová biomolekula se dvěma navázanými
chelátory s neradioaktivními atomy (zde přírodního fluoru a
lutetia). Uprostřed: Navázání
radioaktivních atomů fluoru 18F nebo lutetia 177Lu isotopovou výměnou s neaktivními atomy. Dole:
Použití takto vzniklého diagnostického
radiofarmaka pro scintigrafii (PET), nebo terapeutického
radiofarmaka pro biologicky cílenou radionuklidovou terapii.
Zatím
se tento přístup zkouší u PSMA, bylo vyvinuto
radiohybridbí rhPSMA-7, především pro značení 18F/177Lu,
s použitím akceptoru fluoridu křemíku pro efektivní
isotopovou výměnu neaktivního fluoru 19F za beta+ radioaktivní fluor 18F.
Radionuklidová
vyšetření v nukleární medicíně
V nukleární medicíně byla vypracována
řada metod pro radionuklidová vyšetření
různých tkání a orgánů za účelem zjišťování jejich
normálních či patologických stavů.
V počátcích oboru
nukleární medicíny (60.-80.léta 20.stol.) se často
používaly vzorkové metody - pomocí
detektorů (většinou dutinových scintilačních) se měřily
vzorky krve či plasmy, odebrané pacientům po aplikaci
radioindikátoru. Z naměřené aktivity těchto vzorků (ve
vztahu k aplikované aktivitě) se pomocí většinou
empirických metod, dilučních principů a pod., stanovovaly
parametry funkce - clearance, distribuční objemy
-příslušných radiofarmak ve sledovavých orgánech či
krevním oběhu. Nebo se koncentrace radioindikátoru v organismu
měřila pomocí scintilačních sond
nasměrovaných na zájmové orgány (např. ledviny, srdce).
Během 80.-90.let a první dekády 21.stol. se tyto metody
postupně opouštěly. Byly to často metody "naslepo",
z dnešního pohledu při větší pracnosti poskytovaly méně
přesné a méně spolehlivé výsledky, s možnostmi značných
individuálních chyb; jsou již většinou opuštěné.
Nyní platí jednoduchá "rovnice", že :
současná (a budoucí) nukleární medicína =
scintigrafie + radionuklidová terapie otevřenými radionuklidy.
Příprava pacienta před
scintigrafickým vyšetřením závisí na vyšetřovaném
procesu, použitém radiofarmaku, zdravotním stavu a předchozí
medikaci pacienta. Především je před vyšetřením, s
určitým časovým odstupem, nutno vysadit takové léky, které
by nežádoucím způsobem ovlivňovaly biodistribuci použitého
radioindikátoru nebo funkci vyšetřovaného orgánu (u vyšetření štítné žlázy jsou to jódové
preparáty, u kardiologických nitráty, betablokátory,
diuretika, kardiotonika). Před
netyreologickými vyšetřeními se časo podává Chlorigen pro
zablokování štítné žlázy. Před vlastním scintigrafickým
vyšetřením musí být na pracovišti nukleární medicíny
připraveno příslušné radiofarmakum (§4.8 "Radionuklidy a radiofarmaka pro scintigrafii"), přichystané v
injekční stříkačce s konkrétní aktivitou, optimalizovanou
individuálně pro jednotlivé pacienty (většinou
na základě tělesné váhy) *). Aktivita
radiofarmaka k aplikaci se měří v metrologicky kalibrovaném měřiči
aktivity (§2.3, pasáž "Studnové ionizační měřiče aktivity").
*) Směrné hodnoty doporučené
aplikované aktivity pro různé druhy radiofarmak jsou uvedeny v
tabulce v §5.7 "Radiační zátěž
při radiační diagnostice a terapii", pasáž "Radiační zátěž
pacientů z radionuklidových vyšetření".
Časový průběh
scintigrafického vyšetření závisí především na tom, zda
se jedná o statickou nebo dynamickou gamagrafii, jaký je
průběh vyšetřovaného děje v organismu a jak rychlá je
farmakokinetika použitého radioindikátoru. U statické
scintigrafie se aplikace radiofarmaka provádí většinou mimo
kameru (v aplikační místnosti), na objemu a rychlosti aplikace
v podstatě nezáleží. Vlastní zobrazení se pořizuje
následně s určitým časovým odstupem; je
třeba vyčkat až se radioindikátor dostatečně vychytá a
akumuluje v požadovaných tkáních - může to být i za 2
hodiny (u scintigrafie skeletu nebo u PET
zobrazení akumulace 18FDG v nádorových lézích).
Při dynamické scintigrafii se
radioindikátor aplikuje přímo pod scintilační kamerou,
jejíž zorné pole je nastaveno na vyšetřovanou oblast
pacienta, přičemž dynamické snímkování se spouští okamžitě
s aplikací. U dynamické scintigrafie rychlých dějů
(jako je průtok krve srdečními síněmi
a komorami při angiokardiografii, nebo sledování dynamiky
perfúzní fáze u mozku či ledvin) je
nutno provést tzv. bolusovou aplikaci: rychlou
aplikaci radioindikátoru o vysoké objemové aktivitě v malém
objemu cca 0,5 ml. - kompaktního bolusu, s
okamžitým spuštěním dynamické scintigrafie s dostatečně
vysokou snímkovou frekvencí (jeden či
několik snímků/sec.).
Stručně zde popíšeme některé
důležitější metody scintigrafické diagnostiky (podrobnější popis některých scintigrafických
metod a zejména jejich vyhodnocování je v knize "OSTNUCLINE
- Komplexní vyhodnocování
scintigrafie"). V úvodu jednotlivých okruhů scintigrafické
diagnostiky nejprve uvedeme stručný nástin stavby a
biologické funkce vyšetřované tkáně či orgánu a
jeho nejčastějších patologií, na jehož
základě pak budeme analyzovat metodické přístupy
k diagnostice příslušných poruch a onemocnění. U každé
konkrétní metody uvedeme její medicínský účel,
použitá radiofarmaka, provedení
vyšetření a nakonec jeho zpracování a vyhodnocení
s ukázkami scintigramů a výsledků normálních a
patologických (všechny uvedené
scintigrafické obrazy byly pořízeny a vyhodnoceny na Klinice
nukleární medicíny FN Ostrava). Jelikož
scintigrafických metod v nukleární medicíně je celá řada,
rozdělili jsme toto téma do několika číslovaných podkapitol
podle vyšetřovaných orgánů, systémů či samostatné
problematiky :
4.9.1.
Thyreologická radionuklidová diagnostika
Štítná žláza je
uložená v přední části krku a přes své nevelké rozměry
(cca 5´7cm)
je poměrně důležitým orgánem, zasahujícím do řady dějů
v celém organismu. Funkce štítné žlázy je úzce spjata s metabolismem
jódu v organismu. Do thyreoidálních buněk jodid
sodný NaI proniká transportem prostřednictvím Na/I
symportéru (což je transmembránový glykoprotein
molekulové hmotnosti 37kDa) - "jódová pumpa".
Uvnitř buňek štítné žlázy se jód váže v molekule
tyreoglobulinu za vzniku monojód- a dijód-tyrozinu. Jejich
spojením pak vznikají hormony štítné žlázy
- trijódthyronin (T3) a tetrajódthyronin (thyroxin T4). Proto
je štítnou žlázou účinně vychytáván i radiojodid.
Hormony štítné žlázy vstupují do buněk v těle a
účastní se při regulaci řady metabolických procesů v
organismu. Ovlivňují transportní podmínky na buněčných
membránách pro vstup cukrů a aminokyselin do buněk. T3 se
váže na příslušné T3-receptory na povrchu mitochondrií a
reguluje tím nitrobuněčný metabolismus. Též se váže na
T3-responsivní domény v jaderné DNA a iniciuje tvorbu mRNA pro
proteosyntézu v buňkách.
Patologie štítné
žlázy
Nejčastějšími funkčními patologiemi štítné
žlázy jsou:
- hypertyreóza - zvýšená funkce
štítné žlázy s nadměrnou produkcí hormonů (T3, T4).
- hypotyreóza - snížená funkce
štítné žlázy.
- funkční autonomie - nezávislost
funkce určitých oblastí ve štítné žláze na regulačních
mechanismech.
Častým morfologickým postižením bývá zvětšená
štítná žláza neboli struma, která
může být difúzní nebo uzlová - nodózní.
Podle funkce může být struma eufunkční, hyperfunkční nebo
hypofunkční. Uzly - okrsky zvýšené hustoty,
se v tkáni štítné žlázy vyskytují dosti často. A to nejen
jeden uzel - unifokální, ale i více uzlů - multifokální
postižení. Z hlediska funkce mohou mít stejnou funkci
jako okolní tkáň, nebo jsou hyper- či hypofunkční.
.........
Nejzávažnějším postižením štítné žlázy je její
nádorové onemocnění - karcinom štítné žlázy.
Z histologického hlediska se vyskytují 3 základní typy
nádorů štítné žlázy:
- Diferencovaný adenokarcinom, který
se dále dělí na folikulární, papilární a smíšený. Folikulární
karcinomy (15-30% výskytu ze všech malignit štítné žlázy)
jsou většinou unifokální a šíří se především krevní
cestou. Papilární a smíšené karcinomy jsou
nejčastější (30-70%), bývají většinou multifokální a
metastázují především lymfatickými cestami. Diferencované
karcinomy štítné žlázy si zachovávají akumulaci
jódu a jsou proto úspěšně léčitelné aplikací radiojódu
131I (§3.6, část
"Radioisotopová
terapie ", pasáž "").
- Medulární karcinom (cca 5-10%
výskytu) vychází z parafolikulárních C-buněk,
šíří se převážně hematologicky a jeho léčba je
obtížnější než u diferencovaného. Často nereaguje na
radiojód .....
- Nediferencovaný (anaplastický)
karcinom (cca 10% výskytu) vychází z folikulárních buněk,
metastázuje krevní i lymfatickou cestou. Bývá značně
agresívní s invazí do okolních tkání i tvorbou
vzdálenějších metastáz. Jeho léčba je obtížná a
většinou málo úspěšná (na radiojód nereaguje).
Z obecného hlediska je problematika nádorových
onemocnění podrobněji rozebírána v §3.6 "Radioterapie",
radionuklidová terapie pak speciálně v části "Radioisotopová
terapie", a to nejen
nádorových onemocnění, ale i např. hypertyreózy.
Radioisotopová diagnostika
štítné žlázy je nejstarší metodou nukleární
medicíny (poprve bylo vyzkoušeno v
r.1938). Je to dáno výraznou schopností
štítné žlázy akumulovat jód - a tím i radiojód,
jeho radioaktivní isotopy. Dříve se prováděly pouze prosté akumulační
testy s radiojódem 131I, jehož množství ve štítné žláze se měřilo
jednoduchou gama-sondou; zjišťovalo se jaké procento z
aplikovaného množství radiojódu se vychytá ve štítné
žláze. Později se zavedly metody scintigrafické.
Akumulační
test štítné žlázy
se nyní provádí jen před radionuklidovou terapií
radiojódem pro stanovení aplikované aktivity. Pacientovi se
podá cca 0,5-1 MBq radiojódu, perorálně ve
formě roztoku radiojodidu sodného. Po jeho vstřebání z GIT
jsou jódové ionty vychytávány funkční tkání štítné
žlázy (příp. i metastázami
diferencovaného ca štítné žlázy). Za
6 či 24 hodin se měří vychytaná aktivita ve štítné
žláze buď prostou kolimovanou radiometrickou sondou
(viz obr.2.4.3b v §2.4,
pasáž "Scintilační sonda"), nebo gamakamerou
(s vyznačením a kvantifikací ROI na
obraze štítné žlázy) a srovná se s
aktivitou podaného radiofarmaka - výsledkem je procentuální
množství vychytaného radiojódu *). Normální
hodnoty jsou cca 5-15% za 6 hodin a 10-30% za 24 hodin. Toto
měření se může provádět i opakovaně po
několik dní pro stanovení dynamiky postupného úniku
(clearance) radiojódu ze štítné žlázy.
*) Výsledky mohou zkreslit některé léky
obsahující jód, který saturuje vychytávací mechanismy a
zmenší akumulaci radiojódu - ty je nutno vysadit!
Měření akumulace
radiojódu ve štítné žláze, jakož i jeho clearance - efektivního
poločasu, je důležité pro individuální stanovení
požadované aplikované aktivity radiojódu k dosažení
optimálního terapeutického účinku u hypertyreózy a
autonomních adenomů - viz §3.6, část
"Terapie
štítné žlázy radiojódem 131I", pasáž "Individuálně
aplikovaná aktivita - Marinelliho rovnice".
Scintigrafie
štítné žlázy
Účel:
V primární diagnostice zobrazit distribuci funkční
tkáně štítné žlázy, její lokalizaci, tvar a
velikost a odhalit příp. anomálie - okrsky zvýšené či
snížené funkce ve tkáni štítné žlázy, nalezení
ektopické thyreoidální tkáně. Dále prokázání funkčních
vlastností hmatných uzlů a funkční autonomie. V kombinaci s
laboratorním stanovením hladin T3, T4, TSH posouzení hyper-
či hypotyreózy. Při terapii karcinomu
štítné žlázy scintigrafie slouží k prokázání rezidua
akumulující tkáně a odhalení vzdálených akumulujících metastáz
diferencovaného karcinomu štítné žlázy.
Radiofarmaka:
Základní metoda spočívá v perorální aplikaci radiojódu
131I ve formě jodidu sodného Na131I. Vzhledem k vyšší radiační zátěži (zářením b, které je k
diagnostice nevyužielné) se však 131I již k primární diagnostice nepoužívá, je
nahrazen isotopem jódu 123I, nebo 99mTc-pertechnetátem, který se
též vychytává a akumuluje v buňkách štítné žlázy
podobně jako jodid, ale na rozdíl od něho se neváže v
tyreoglobulinu a nevstupuje do dalších metabolických reakcí. 131I (aplikace cca 10MBq) se používá
jen u pacientů s prokázanou tyreopatií před terapií
radiojódem.
Pro zjištění méně diferencované nádorové
tkáně a metastáz se dále používají 99mTc-MIBI, 99mTc-Tetrofosmin. Pro zobrazení medulárního karcinomu
(který obsahuje somatostatinové receptory) se dále používá 111In-pentetreoid,
dále 123,131I-MIBG.
Provedení:
Pro scintigrafii štítné žlázy, jakožto malého orgánu,
používáme kolimátor s vysokým rozlišením
za použití ZOOMu, nebo kolimátor pinhole
(který zvětší průmět štítné žlázy na větší užitnou
plochu scintilačního detektoru kamery). Po i.v. aplikaci 99mTc-pertechnetátu
(cca 100-200 MBq) se po asi 30 minutách snímá planární obraz
v projekci AP. Pro lepší morfologickou orientaci je vhodné
pořídit i obrázek se značkami pomocí bodového
"pointeru".
Hodnocení:
Normální obraz štítné žlázy má "motýlovitý"
téměř symetrický tvar, s přibližně homogenní
distribucí radiofarmaka v obou lalocích parenchymu.
Patologický obraz vykazuje nehomogenní distribuci
se "studenými" uzly snížené funkce či
"horkými" uzly zvýšené funkce tkáně štítné
žlázy. Příp. funkční autonomii horkých uzlů
můžeme zjistit opakovanou supresní scintigrafií
štítné žlázy po několikadenním podávání
trijódthyroninu. U funkční autonomie se akumulace radiofarmaka
v "horkém" ložisku nezmění, zatímco v ostatním
parenchymu (paranodulární tkáni), v důsledku hormonální
suprese, akumulace podstatně klesne nebo vymizí (§3.9 "Kvantitativní scintigrafie štítné žlázy" v knize OSTNUCLINE).
| Normální scintigram štítné žlázy |
 |
Celotělová scintigrafie po terapii štítné žlázy radiojódem. Zobrazila se mnohočetná akumulující ložiska v obou plicních křídlech - metastázy ca štítné žlázy. Za příznivých okolností mohou být tato maligní ložiska úspěšně zlikvidována radiojódovou terapií. |
| Hyperfunkční uzel v pravém laloku št. žlázy |
||
| Nodózní struma s afunkčním uzlem vlevo |
||
| Ukázky typických obrazů
scintigrafie štítné žlázy (scintigramy pořídil MUDr.V.Dedek, PhD.) |
Při vyhledávání funkčních metastáz
diferencovaných karcinomů štítné žlázy je vhodné použít
celotělovou scintigrafii s radiojódem (aplikace cca 100-200 MBq). Na
thyerologickou diagnostiku v nukleární medicíně může pak
navazovat radionuklidová terapie štítné žlázy
- léčba hypertyreózy, autonomního adenomu, karcinomu
štítné žlázy (viz §3.6 "Radioterapie",
část "Radioisotopová terapie
otevřenými zářiči"). Po terapii následuje s určitým časovým odstupem kontrolní
scintigrafie štítné žlázy nebo metastáz.
Scintigrafie
příštítných tělísek (parathyroid)
Příštítná tělíska jsou 2 páry
drobných útvarů nacházejících se na zadní straně obou
laloků štítné žlázy. Jsou to žlázy produkující parathormon,
který ovlivňuje obsah vápníku - uvolňuje jej z kostí do
krve.
Účel: Pomocí scintigrafie se snažíme
zobrazit hyperfunkční parenchym zvětšených
příštitných tělísek (většinou se jedná o jejich adenom),
která svou zvýšenou produkcí parathormonu nepříznivě
ovlivňují obrat vápníku v organismu.
Radiofarmaka: Jelikož nejsou k dispozici
radioindikátory které by se selektivně vychytávaly v
příštítných tělískách, používají se kationtové
komplexy 99mTc-MIBI a 99mTc-Tetrofosmin, které se však současně akumulují i
v parenchymu štítné žlázy.
Provedení a vyhodnocení: Zobrazit drobná
příštítná tělíska na pozadí mnohem větší tkáně
štítné žlázy není nijak snadné. Můžeme si pomoci dvojím
způsobem:
- Dvoufázová scintigrafie využívající
rychlejšího vyplavování 99mTc-MIBI z tyreoidální tkáně než z příštítného
tělíska postiženého zvětšením či adenomem. Za asi 15-30
minut po i.v. aplikaci radiofarmaka (cca 700-800MBq) nasnímáme
první obraz, další pak za 2-3 hodiny.
- Subtrakční scintigrafie provádějící
počítačové odečtení obrazů. Obraz štítné žlázy
pořízený po aplikaci samotného 99mTc-pertechnetátu (cca 200MBq) se odečte od
"sumačního" obrazu [štítné žlázy +
příštítných tělísek], pořízeného po následné aplikaci
99mTc-MIBI
nebo 99mTc-Tetrofosminu.
Oba obrazy musí být snímány za identických podmínek, bez
změny polohy. Po odečtení obrazu tkáně štítné žlázy v
"sumačním" obraze pak zbude obraz samotného
příštítného tělíska.
4.9.2. Nefrolologická radionuklidová
diagnostika
Močové vylučovací ústrojí, tvořené systémem [ledviny -
močovody - močový měchýř - močová trubice], se souhrnně
nazývá uropoetický systém.
Ledviny *) slouží především k filtraci
krve (kterou do ledvin přivádějí renální tepny),
čímž se z organismu odstraňují produkty metabolismu a jiné
nepotřebné či škodlivé látky, které se pak odvádějí
jako moč ven z těla. Jsou takto odstraňovány odpadové
produkty - katabolity - dusíkového metabolismu (urea,
kreatinin), kyselé katabolity, voda a elektrolyty, čímž se
udržuje stálé vnitřní prostředí. Ledviny mají dále
funkci regulační - zajišťují homeostázu organismu
- vody, solí, minerálů, acidobazickou rovnováhu, podílejí
se na udržování krevního tlaku. Základní stavební a
funkční jednotkou parenchymu ledviny je nefron.
Lidská ledvina obsahuje cca 800 000 až 1,5 milionu nefronů.
*) Ledviny se latinsky nazývají ren,
řecky nefros - od toho ve vyšetřovacích metodách
synonima renografie = nefrografie.
Nefron začíná klubíčkem vlásečnic zvaném glomerulus,
kam rozvětvující se renální tepna přivádí krev. V
glomerulách probíhá základní clearanční funkce ledvin - glomerulární
filtrace, což je proces ultrafiltrace krevní
plasmy pod tlakem přes glomerulární membránu. Podílí se na
něm mikroporézní struktura glomerulární stěny (která
brání průtoku plasmatických bílkovin větších než cca 100
kDa) a elektrostatická bariéra glomerulární membrány
(negativní náboj polyanionických makromolekul membrány a
negativní náboj většiny plasmatických bílkovin zabraňuje
přestupu i menších bílkovin s molekulovou hmotností nad cca
60 kDa). Glomerulárním ultrafiltrátem je primární moč,
což je v podstatě plasma bez buněk a velkých molekul
plasmatických bílkovin; denně se jí v ledvinách vytvoří
více než 150 litrů. Vedle odpadních metabolických produktů
obsahuje řadu látek a živin (jako je glukóza), které by v
organismu měly zůstat.
Glomerulární filtrát vstupuje do dutého
kanálku nefronu, zvaného tubulus. Zde
probíhá tubulární resorbce, při níž se
část látek z glomerulární filtrace zpětně vstřebává a
vrací se do krve, odcházející přes cévní řečiště kolem
tubulů odvodnou cévou z ledviny. Resorbcí se do krve vrací
většina vody, glukóza, aminokyseliny, minerály. Udržuje se
tím homeostáza - rovnováha vody a solí v těle. Vedle
resorbce zde dochází i k tubulární sekreci -
buňky tubulů aktivně vychytávají některé látky z krve
(např. kreatinin) a transportují je do dutin tubulů, tj. do
moči. Celkové množství látky vyloučené močí je dáno
součtem: (glomerulární filtrace) - (tubulární resorbce) +
(tubulární sekrece).
Po průchodu tubulárním systémem vzniká
definitivní sekundární moč, která se skládá z
vody s rozpuštěnou močovinou, chloridem sodným a menším
množstvím dalších látek; vyloučí se jí asi 1,5-2 litry za
den. Tubuly ústí do silnějších sběracích kanálků,
nálevkovitě rozšířených kalichů a nakonec do
ledvinové pánvičky (pelvis renalis) dutého systému
ledviny, odkud moč odtéká přes uretery do močového
měchýře. Odtud pak po uvolnění svěrače vytéká močovou
trubicí ven z těla.
Patologie ledvin a
močových cest
Ledviny jsou poměrně často postihovány zánětlivými a
infekčními onemocněními. Pyelonefritida je
bakteriální hnisavý zánět ledvin (pánvičky-pyelos
i parenchymu), který může být akutní i chronický a při
opakování nebo vleklém průběhu může vést ke zhoršování
funkce ledvin. Glomerulonefritida je
zánětlivé onemocnění postihující především glomeruly v
ledvinách, které může vznikat po infekcích (především
streptokokových), autoimunitními procesy a dalšími
příčinami. Některá onemocnění ledvin mohou vést ke zhoršování
renální funkce, které může být i nevratné (zánik
nefronů), v krajním případě může vyústit až v selhání
ledvin.......
Velmi častým postižením ledvin a močových
cest je lithiáza (urolithiáza) -
"ledvinové kameny", vznikající nahromaděním a
zvýšenou koncentrací minerálních solí, které vykrystalizují
v močových cestách, především v pánvičce ledvin
nebo v měchýři. Nejobvyklejší jsou kameny ze šťavelanu
vápníku nebo z kyseliny močové. Mohou dorůstat do různé
velikosti, od drobných částeček "písku" až k
větším kamenům (>1cm), které mohou zablokovat odtok moči
z ledviny. Tato obstrukce ureteru způsobuje
městnání v dutém systému ledviny, které zatěžuje i
parenchym (který musí filtrovat proti tlaku); při delším
trvání obstrukce se nevratně poškozuje renální funkce.
Při poškození renální funkce dochází ke
snížení glomerulární filtrace a tím k zadržování
odpadních látek v těle a ke snížení tubulární resorpce, k
poruše vstřebávání elektrolytů a vody. Dochází tím též
k ovlivnění krevního tlaku a může dojít k poruchám
acidobazické rovnováhy, příp. i krvetvorby.
Parenchym ledvin bývá postižen cystickým
(často polycystickým) onemocněním. Poměrně méně časté
jsou nádory ledvin, jako je Grawitzův
tumor .................
Ledviny a jejich
vylučovací funkce se již v začátcích oboru nukleární
medicíny staly vhodným objektem pro radioisotopovou
diagnostiku.
Do 70.-80.let byla jedním z
nejfrekventnějších nukleárně medicínských vyšetření radioisopová
renografie. Po aplikaci nefrotropního radioindikátoru 131I-hippuranu se
dvěma kolimovanými scintilačními renografickými sondami
(viz obr.2.4.3b v §2.4,
pasáž "Scintilační sonda"), přiloženými na záda
pacienta v lokalizaci ledvin, snímal průběh radioaktivity v
ledvinách. Elektrický signál z detektorů se vedl do
dvojitého registračního zapisovače, jehož pisátka
vykreslila na papíře tzv. nefrografické křivky.
Z tvarů nefrografických křivek bylo možno usuzovat na různé
patologické stavy a poruchy funkce ledvin, jakož i odtoku moče
z ledvin. Někdy se prováděla i semikvantitativní analýza
nefrografických křivek. Bylo to však jen přibližné
vyšetření "naslepo", bez možnosti regionálního
posouzení. Nahrazení izotopové nefrografie dynamickou
scintigrafií podstatně zpřesnilo diagnostiku a
poskytlo mnohem komplexnější informace :
Dynamická
scintigrafie ledvin
Účel:
Je to nejdůležitější metoda nukleární nefrologie. Slouží
ke komplexnímu posouzení a kvantitativní analýze perfúze a
vylučovací funkce ledvin (a jejich částí),
clearance a drenáže - dynamiky odtoku moči z ledvin. Může
poskytovat i určité informace o morfologii ledvin, které jsou
však odvozeny od zobrazení distribuce radioindikátoru ve
funkční tkáni ledvin (parenchymu) a od odtoku či hromadění
radioindikátoru v dutém systému.
Radiofarmaka
:
- 99mTc-DTPA (kyselina
dietylentriaminpentaoctová), která se vylučuje pasívní
ultrafiltrací v glomerulech (v tubulech se neresorbuje). Kromě
funkčního zobrazování je vhodná i pro stanovení
glomerulární filtrace metodou plasmatické clearance.
- 99mTc-MAG3 (merkaptoacetyltriglycin),
který se váže na transportní plasmatické bílkoviny a
vylučuje se tubulární sekrecí (v glomerulech se téměř
nefiltruje). Poskytuje kontrastní obrazy funkčního parenchymu
ledvin, dobře zachycuje dynamiku odtoku moče z ledvin, lze jej
použít ke stanovení efektivního průtoku plasmy ledvinami
(ERPF) pomocí plasmatické clearance. Pro tento účel se někdy
používá i ortojodhippuran značený 123I (dříve 131I), který se
vylučuje z asi 80% tubulární sekrecí a z cca 20%
glomerulární filtrací.
Provedení
:
Pod scintilační kamerou, nastavenou v zadní projekci na oblast
ledvin, se aplikuje cca 200MBq radioindikátoru a ihned se
spustí dynamická akvizice v krátkých
časových intervalech: perfúzní fáze cca
1s/snímek - 100snímků, následuje funkční fáze
cca 10-30s/snímek, celková doba akvizice 30 minut. Snímky se
sekvenčně ukládají do paměti počítače. V případě
viditelné retence v dutém systému se v asi 15.minutě aplikuje
diuretikum - látka zvyšující diurézu
(intenzitu vylučování moči) ovlivňováním transportu v
různých částech nefronu; nejčastěji se používá furosemid.
Zpracování
:
Sledováním sekvencí snímků můžeme vizuálně
pozorovat vstup radioindikátoru do ledviny, jeho vychytávání
v parenchymu, transport do kalicho-pánvičkovitého systému a
odtok močovody do měchýře. Můžeme rozpoznat příp.
abnormality. Pro kvantitativní analýzu na
vhodných sumačních obrázcích vyznačíme zájmové
oblasti (ROI): oblast krevního řečiště (oblast
kolem srdce), levé a pravé ledviny a jejich částí
(parenchym, dutý systém), tkáňového pozadí (na které se
provádí korekce - odečtení). Z těchto oblastí pak
počítač vytvoří křivky ("histogramy") časového
průběhu aktivity v těchto místech.
Křivka ze zájmové oblasti krevního řečiště
reprezentuje časové změny (především pokles) koncentrace
radioindikátoru v krvi (plasmě). Rychlost poklesu koncentrace
aktivity v plasmě závisí na eliminační schopnosti - clearanci
- ledvin, při zhoršené funkci ledvin je rychlost clearance
snížená (výpočet clearance je popsán
v pasáži "Zpracování křivky blood-poolu -
clearance" v knize
"OSTNUCLINE").
Z ROI ledvin vznikají nefrografické
křivky, z nichž se stanovují časové a rychlostní
parametry dosažení maxima, rychlosti či poločasu poklesu.
Při zpomaleném vylučování či retenci radioindikátoru v
ledvině je důležitý diuretický test: Pokud
pokles nefrografické křivky nenastal ani po aplikaci diuretika,
svědčí to pro obstrukční hydronefrózu.
Odlišením aktivity parenchymu a pánvičky lze
rozhodnout, zda příp. patologie nefrografické křivky je
způsobena funkční poruchou průchodu indikátoru v parenchymu,
nebo změnami v odtoku - dilatace dutého systému či obstrukce
močové cesty v ledvině. Přesně se to provádí tzv. dekonvoluční
analýzou nefrografických křivek za vzniku tranzitních
funkcí (je podrobně popsáno v
§3.4 "Dynamická scintigrafie ledvin",
pasáž "Dekonvoluce a tranzitní funkce" v knize "OSTNUCLINE"). ........
| Matematická analýza a komplexní vyhodnocení dynamické funkční scintigrafie ledvin - MAG3 | |
 |
|
| Hodnocení
: Po intravenózní aplikaci radioindikátoru se zobrazují ledviny obvyklého tvaru, velikosti i uložení, bez ložiskových změn. Nefrografická křivka levé ledviny má normální průběh, na křivce pravé ledviny pozorujeme zpomalení drenáže a retenci, mizející po diuretiku. Z
á v ě r : |
Zde jsou příklady vyhodnocení téměř normálníá a výrazně patologickéâ dynamické scintigrafie ledvin.
| Matematická analýza a komplexní vyhodnocení dynamické funkční scintigrafie ledvin - MAG3 | |
 |
|
| Hodnocení
: Po intravenózní aplikaci radioindikátoru se zobrazila dobře akumulující levá ledvina obvyklého tvaru i velikosti, bez ložiskových změn. Pravá ledvina se zobrazuje opožděně jako výrazně hypofunkční a nehomogenní - je zachován pouze úzký lem funkčního parenchymu kolem výrazně dilatovaného exkavovaného dutého systému s výraznou retencí. Nefrografická křivka levé ledviny má fyziologický průběh. Nefrogram pravé ledviny má výrazně plochý tvar s nízkým funkčním segmentem, křivka má trvale ascendentní průběh, nereagující na aplikaci diuretika v 17.min. Z
á v ě r : |
Matematický postup analýzy dynamické
scintigrafie ledvin je podrobně popsán v §3.4 "Dynamická
scintigrafie ledvin" knihy "OSTNUCLINE - Matematická analýza a
počítačové vyhodnocování funkční scintigrafie".
Renovaskulární
hypertenze -
captoprilový test
Zvýšený krevní tlak je porucha která může vážně
ohrožovat zdraví, zvláště cevními komplikacemi. Většinou
se jedná o primární hypertenzní onemocnění, avšak
zvýšený krevní tlak může být způsoben i sekundárně,
onemocněním některých jiných orgánů. Často to bývá
sekundární nefrogenní hypertenze při onemocnění
ledvin jako je pyelonefritida či glomerulonefritida. Zde se v
diferenciální diagnostice může uplatnit i nukleární
nefrologie.
Specifickým případem je renovaskulární
hypertenze - zvýšený krevní tlak způsobený
nedostatečnou perfúzí ledvin (jejich ischemií) z důvodu
stenózy renální tepny. Tím dochází k zadržování vody a
sodíku v těle, neboť i jinak zdravé ledviny nemohou
dostatečně plnit svou funkci. Je aktivovaný RAAS
renin-angiotenzin- regulační systém: renin,
produkovaný ve zvýšené míře v ischemické ledvině, se
působením konverzního enzymu mění na angiotenzin
II, který zvyšováním tlaku v glomerulu udržuje průtok
krve glomeruly na potřebné hodnotě. Tato fyziologická
kompenzace však systémovým působením na arterioly a
zvýšením hladiny aldosteronu vede k nežádoucímu zvýšení
krevního tlaku. Inhibicí angiotenzin konvertujícího enzymu
(ACE) pomocí vhodného farmaka lze zablokovat tento regulační
mechanismus Takovým krátkodobě působícím ACE inhibitorem je
captopril, který zde můžeme použít k diagnostickým
účelům.
Před začátkem dynamické scintigrafie tedy aplikujeme
captopril, který inhibicí ACE snižuje tonus ve vas
eferens a snižuje glomerulární filtraci. Zpomaluje se
vylučování DTPA glomerulárními a MAG3 tubulárními
buňkami, takže původně normální nefrografické křivky se
mění na patologické - pokles glomerulární filtrace a tím i
zpomalení transportu radiofarmaka parenchymem ledviny.
Srovnáním křivek ledvin z nativní dynamické scintigrafie bez
captoprilu se scintigrafií po zátěži captoprilem můžeme
odhalit renovaskulární původ hypertenze.
Dynamická scintigrafie
transplantované ledviny
Princip a metodický postup je v zásadě analogický jako u
shora vedené dynamické scintigrafie ledvin. Kromě posouzení clearanční
funkce transplantované ledviny je důležité posoudit
zvláště její perfúzi, akutní
tubulární nekrózu *) a riziko rejekce,
drenáž transplantátu a ureteru, odhalení
příp. komplikací a anomálií při transplantaci (jako je urinom).
*) Poněkud zavádějící název "akutní
tubulární nekróza - ATN" znamená opožděný
nástup perfuze a renální funkce štěpu po transplantaci, v
závislosti na době trvání studené ischemie ledviny v
časovém intervalu mezi odejmutím štěpu dárci a jeho
transplantaci příjemci. Těžká ATN může vyústit v rejekci.
Oproti výše uvedené
dynamické scintigrafii ledvin se liší projekce - kamera
snímá v projekci AP oblast zahrnující ilické tepny, vlastní
transplantovanou ledvinu a močový měchýř. Vyznačují ze
zájmové oblasti: blood pool, arteria illiaca, transpl. ledvina,
močový měchýř, pozadí. Vedle parametrů obvyklých u
dynamické scintigrafie ledvin se stanovuje Hilsonův
perfúzní index a míra odtoku do močového měchýře.
Analýza dynamické scintigrafie transplantované ledviny je
popsána v §3.5 "Dynamická scintigrafie transplantované ledviny" knihy OSTNUCLINE.
| Matematická analýza a komplexní vyhodnocení dynamické funkční scintigrafie transplantované ledviny | |
 |
|
| Hodnocení
: Po intravenózní aplikaci radioindikátoru se zobrazuje obvyklým způsobem břišní aorta a ilické tepny, vzápětí pak dobře perfundovaná transplantovaná ledvina. V dalším průběhu se radioindikátor dobře koncentruje v ledvině, potom se dostatečně rychle vylučuje do močového měchýře. Z á v ě r : |
Statická
scintigrafie ledvin
Účel: Pomocí této jednodušší metody le
získat funkčně-morfologickou informaci o rozložení
funkčního parenchymu v ledvině, odvozeně o tvaru,
velikosti a uložení ledvin, někdy i strukturních změnách.
Lze stanovit separovanou funkci ledvin - %
podíl levé a pravé ledviny na celkové funkci (test renální
funkční symetrie).
Radiofarmaka: Jako radiofarmak se využívá
značených látek, které jsou vychytávány ledvinovým
parenchymem, ale nepřestupují do moči. Nejpoužívanější je
99mTc-DMSA
(kys. dimerkaptojantarová), která se vychytává v buňkách
proximálních tubulů.
Provedení: Po i.v. aplikaci cca 100MBq 99mTc-DMSA se asi za 2
hodiny provádí vlastní statická scintigrafie, většinou ve 4
projekcích, z nichž nejdůležitejší je projekce PA a AP.
Hodnocení je většinou vizuální,
hodnotí se velikost, tvar a uložení ledvin, distribuce
funkční tkáně. Počítačové zpracování se provádí za
účelem stanovení separované funkce (s korekcí na absorbci záření g z různě hluboko
uložených ledvin) je popsáno v §3.7
"Statická
scintigrafie ledvin" knihy
OSTNUCLINE.
Radionuklidová urowlowmetrie a cystografie
Účel: Slouží k vyšetření dynamiky mikce, stanovení
objemu měchýře, měchýřového rezidua, evakuační
rychlosti, zjištění vezikoureterálního refluxu.
Provedení: Pacient, jehož močový měchýř je naplněn
radioaktivním roztokem, se vymočí před detektorem kamery,
přičemž se snímá dynamická scintigrafie oblasti ureterů a
močového měchýře, frekvencí cca 1snímek/sec. Jsou dvě
metody naplnění měchýře, přímá a nepřímá cystografie. Nepřímá
metoda spočívá v aplikaci nefrotropního radiofarmaka
(většinou 99mTc-MAG3, cca 200MBq), po níž se provede běžná
dynamická scintigrafie ledvin, během níž se renální funkcí
naplní močový měchýř. Při přímé
cystografii se radioindikátorem (cca 50MBq) naplní měchýř
přes katetr.
Vyhodnocení: Vedle vizuálního posouzení série obrazů mikčního
aktu vyznačujeme zájmové oblasti močového měchýře,
ureterů a tkáňového pozadí, z nichž vytvoříme křivky
časového průběhu radioaktivity, především urodynamickou
křivku. Jejich počítačovou analýzou můžeme
kvantifikovat průběh mikce - stanovit dobu trvání a rychlost
mikce, měchýřové reziduum. Můžeme
vizuálně posoudit i kvantifikovat regurgitaci moče z
měchýře do ureterů nebo příp. až do pánvičky ledvin - vezikoureterální
či vezikorenální reflux.
................................................
Počítačová analýza dynamické uroflowmetrie je popsána v
§3.6 "Radionuklidová
uroflowmetrie" knihy OSTNUCLINE.
| Matematická analýza a komplexní vyhodnocení dynamické uroflowmetrie | |
 |
|
| Hodnocení
: Po spuštění dynamické scintigrafie začíná záhy mikce, při níž dochází k dostatečně rychlému vyprazdňování močového měchýře s nízkým reziduem. Na scintigrafických obrazech vyprázdněného měchýře a močových cest je dobře pozorovatelný veziko-ureterální reflux, výraznější vpravo. Z á v ě r : |
4.9.3 Diagnostika gastro-intestinálního
traktu - jater a žlučových cest, pankreatu, sleziny,
jícnu a žaludku
Scintigrafie jater
Játra jsou důležitým orgánem, v němž probíhají
významné metabolické, detoxikační a eliminační pochody;
jsou začleňovány do trávicího ústrojí a též do retikuloendotelového
systému (RES). Jsou jedním z největších orgánů, u
člověka váží asi 1,5 kg, jsou uložena v pravém
bráničním oblouku břišní dutiny. Jaterní parenchym tvoří
především polygonální jaterní buňky - hepatocyty
(60%) a retikuloendoteliální Kupferovy buňky (15%).
Dále jsou to jaterní hvězdicovité Itovy buňky, Pit
buňky a stěny velkého množství cév krevních a
intrahepatálních žlučových cest.
Hepatocyty vychytávají z plasmy
různé látky, přeměňují je a pak vylučují do žluče,
která odchází intrahepatálními cestami (přes žlučník)
přes ductus choledochus do intestinálního traktu. Jaterní
buňky se významně podílejí na řadě metabolických a
syntetických procesech:
- Metabolismus
sacharidů - jaterní buňky vychytávají z portální krve
glukózu a přeměňují ji na lipidy nebo na glykogen, přeměna
laktátu a alaninu na glukózu
- Metabolismus
lipidů - syntéza a oxidace mastných kyselin, vznik
glycerolů, fosfolipidů, cholesterolu, lipoproteinů...
- Metabolismus
aminokyselin -
- Syntéza
plasmatických proteinů -
- Detoxikační
funkce - Je to především detoxikace amoniaku
(vznikajícího při rozkladu aminokyselin). Amoniak se
přeměňuje na močovinu a glutamin, které se pak vylučují v
ledvinách. Dále, některé cizorodé molekuly (zvláště
hydrofobní, které nemohou být vyloučené ledvinami) se
oxidují cytochromem a vylučují do žluče nebo do plasmy
(odkud jsou pak odstraňovány v ledvinách).
Červené krvinky mají omezenou životnost (asi 120 dní),
načež jsou vychytávány ve slezině a játrech a
sekvestrovány. Z hemoglobinu se odlučuje železo, které se
použije k syntéze nového hemoglobinu, zatímco zbylá složka
(hem) navázaný na protein hemopexin, je fagocytovám
Kupferovými buňkami a přeměňován na bilirubin.. Navazuje se
na krevní bílkovinu albumin a v játrech je vychytáván
hepatocyty, kde se váže na kys.glukoronovou. Tím vzniká konjugovaný
bilirubin, který jaterní buňky vylučují do žluči,
která pak odtéká do tenkého střeva.
V játrech probíhá i řada dalších funkcí - tvorba hormonů
a jejich degradace či deaktivace, degradace cholesterolu, část
krvetvorby, zásobní funkce lipidů a glykogenu.
Hepatocyty vylučují vodu, ionty solí, kyseliny,
cholesterol, fosfolipidy a bilirubin - jaterní žluč -
do žlučových kapilár, které se postupně spojují ve
žlučovody. Žluč se shromažďuje ve žlučníku -
vakovité "nádržce" na žluč, odkud se řízeně
uvolňuje a odtéká žlučovými cestami - ductus cysticus -
ductus choledochus - do duodena (dvanáctníku) a odtud do
intestinálního traktu (do tenkého střeva), kde se podílí na
trávení tuků.
Kupferovy buňky jsou fixní
makrofágy, které fagocytují bakterie, cizorodé
bílkoviny, přestálé erytrocyty a některé další buňky. Pit
buňky jsou velké granulární lymfocyty s výraznou
cytotoxickou aktivitou, které svou fagocytární schopností
spolupracují s Kupferovými buňkami. Itovy buňky
(lipocyty) obsahují velké množství lipidů
Krevní oběh jater představuje
asi 1,5 litru/minutu a má dvě složky:
1. Jaterní tepna přivádí krev bohatou na
kyslík (20% krevního oběhu jater), vyživuje jaterní
parenchym.
2. Funkční oběh z vrátnicové žíly
- vena portae (cca 80% jaterního oběhu) přivádí
krev obsahující vstřebané živiny z trávicího traktu,
jakož i různé zplodiny metabilismu buněk. Vena portae se
větví na žíly protékající portobiliárním prostorem mezi
hepatocyty, krev pak přes jaterní žíly odtéká do dolní
duté žíly.
Patologie jater a
žlučových cest
Játra mají velkou funkční rezervu a schopnost regenerace.
Přesto však mohou být játra poškozena v důsledku nadměrné
zátěže toxickými látkami, hepatotoxiny (jako je
alkohol), zánětlivými a infekčními onemocněními
(hepatitida A,B,C). Tato poškození mohou vyústit v nodulární
přestavbu, fibrózu a postupný zánik jaterního parenchymu - v
cirhózu jater spojenou se selháním funkce
jater a cévními komplikacemi - portální hypertenzí a
portosystémovými zkraty (viz níže "slezina").
Poměrně časté jsou patologie
žlučových cest, především cholelithiáza
- kaménky ve žlučníku, které vznikají vlivem zvýšené
koncentrace a snížení rozpustnosti žluči. Žlučové kameny
mohou způsobovat záněty a ucpat žlučové cesty, zabránit
odtoku žluči z jater - vzniká obstrukční ikterus,
projevující se jako žloutenka způsobená nahromaděním
bilirubinu v plasmě.
Nádorová onemocnění jater -
primárním jaterním nádorem je hepatocelulární
karcinom (hepatom). Mnohem častější jsou
sekundární postižení jater metastázami z
jiných nádorů (nejčastěji ca prsu nebo kolorektálního ca).
Benigním nádorem jater je hemangiom.
Radionuklidová diagnostika
jater primárně využívá funkce hepatocytů a Kupferových
buněk. Po aplikaci radiofarmaka, které je z krevního
řečiště vychytáváno hepatopcyty, můžeme dynamickou
scintigrafií jater - cholescintigrafií
vyšetřit funkci jater a žlučových cest. Aplikací
radiofarmaka, které je vychytáváno (fagocytováno) v
Kupferových buňkách, můžeme statickou scintigrafií
jater zobrazit rozložení parenchymu a tím (nepřímo)
získat informace o morfologii jater.
Dynamická
scintigrafie jater - cholescintigrafie
Účel:
Slouží ke komplexnímu posouzení a kvantitativní analýze
vylučovací funkce jater (a jejich částí),
clearance a drenáže - dynamiky tvorby žluče a jejího odtoku
intrahepatálními cestami do žlučníku, evakuační
schopnost žlučníku, průchod do duodena a intestinálního
traktu. Může odhalit i duodeno-gastrický reflux. Kromě toho
může poskytovat i určité informace o morfologii jater, které
jsou však odvozeny od zobrazení distribuce radioindikátoru ve
funkční tkáni jater (parenchymu) a od odtoku či hromadění
radioindikátoru ve žlučových cestách.
Radiofarmaka:
Deriváty kyseliny iminodioctové (IDA) značené 99mTc - HIDA, EHIDA
Provedení
:
Po i.v. aplikaci cca 100-200 MBq hepatotropního radiofarmaka se
vleže v přední projekci okamžitě spustí dynamická
scintigrafie snímkovou frekvencí cca 20-30 sec./snímek. Pro
stimulaci vyprazdňování žlučníku se během vyšetření v
asi 30.minutě podá cholekinetický podnět - cholecystokinin
nebo tučná strava (čokoláda). Dynamická scintigrafie se
snímá po dobu 60 minut. Pokud se po této době neobjeví
radioindikátor ve střevech, nahrávají se další statické
obrazy za 2 a 4 hodiny.
Hodnocení
:
Vizuálním hodnocením obrazů různých fází distribuce
radioindikátoru v játrech a pasáže žlučovým systémem
posuzujeme distribuci hepatocytů v jaterním parenchymu,
morfologii žlučových cest, uložení a velikost žlučníku,
jeho vyprazdňování a odtok žluči do intestinálního traktu,
event. duodeno-gastrický reflux.
Na příslušných dynamických snímcích vyznačíme zájmové
oblasti: krevní řečiště, celá játra, jaterní parenchym,
ductus choledochus, intestinální trakt, žlučník (pokud se
zobrazil) a žaludek (při podezření na duodeno-gastrický
reflux). Z křivek časového průběhu
koncentrace radioindikátoru v těchto zájmových oblastech
hodnotíme a kvantifikujeme hepetocelulární funkci
jater - clearanci a rychlost extrakce
radiofarmaka hepatocyty z krevního oběhu, dynamiku odtoku
žlučovými cestami včetně stanovení ejekční frakce
žlučníku, míru duodeno-gastrického refluxu.
Dekonvolucí jaterních křivek s křivkou
blood-poolu můžeme konstruovat tranzitní funkce
a stanovovat tranzitní časy průchodu radioindikátoru
celými játry, jaterním parenchymem nebo jeho vybranými
částmi. Exponenciální analýzou tranzitních křivek můžeme
dále stanovovat hepatální extrakční frakci
(HEF) jaterního parenchymu, jeho jednotlivých laloků či
vybraných částí (ROI). HEF udává, jaká část
radioindikátoru se vychytává při jednom průchodu cévním
řečištěm jaterního parenchymu - kvantifikuje tedy vlastní vychytávací funkční
schopnost jaterního parenchymu, kterou umožňuje
odlišit od patologie žlučových cest.
Metoda stanovení HEF je
popsána v pasáži "Hepatální extrakční frakce" §3.10 "Dynamická scintigrafie jater" knihy "OSTNUCLINE".
Stanovení funkční schopnosti jater a jejich
jednotlivých segmentů a vybraných oblastí je důležité
nejen ve vlastní klinické hepatologii, gastroenterologii,
interní medicíně, ale i u pacientů podstupujících
rozsáhlejší resekční výkony s odstraněním části
funkčního jaterního parenchymu. Zde je riziko nedostatečnosti
funkce zbylého funkčního rezidua a vývoje jaterního
selhání, s velmi nepříznivými (až
letálními) zdravotními důsledky.
Zmapování funkční zdatnosti jaterního parenchymu může
přispět k optimalizaci plánované chirurgické strategie.
| Matematická analýza a komplexní vyhodnocení dynamické funkční scintigrafie jater a žlučových cest - cholescintigrafie | |
 |
|
| Hodnocení
: Po intravenózní aplikaci radioindikátoru se včasně zobrazují játra obvyklého tvaru a velikosti. Jaterní parenchym nevykazuje ložiskové změny. Žlučové cesty je možné diferencovat od 10.min., od 13.min. se začíná plnit žlučník. V 30.min. byl podán cholekinetický podnět. V dalším průběhu pozorujeme rychlou pasáž radioindikátoru biliárním systémem s plynulým odtokem přes ductus choledochus do intest. traktu. Z á v ě r : |
Matematická analýza a počítačové vyhodnocení dynamické cholescintigrafie je podrobně popsáno v §3.10 "Dynamická scintigrafie jater" knihy "OSTNUCLINE".
Diagnostika malabsorpce žlučových kyselin
Žlučové kyseliny jsou syntetizovány v
játrech z cholesterolu. Primární žlučové kyseliny cholová
a chenodyoxycholová jsou konjugovány s glycinem a taurinem a
jsou exprimovány do žlučových cest. Po příjmu tuku v
potravě jsou pod vlivem cholecystokyninu vylučovány do
duodena. Žlučové kyseliny mají rozhodující funkci při
trávení a vstřebávání tuků přijímaných v potravě -
mastných kyselin a momoglyceridů uvolněných při lipolýze ve
střevě. Žlučové kyseliny se přitom v tenkém střevě
postupně vstřebávají, do tlustého střeva se
nedostávají.
Při malabsorpci
žlučové kyseliny nejsou dostatečně vstřebány v ileu,
pronikají až do tlustého střeva a jsou příčinou chronického
průjmu. Způsobují zvýšenou
sekreci elektrolytů a vody, zvýšenou permeabilitu sliznice
tlustého střeva, zvýšenou motilitou tlustého střeva a
zvýšenou produkci hlenu. K této poruše
snížení absorpční funkce terminálního ilea dochází
např. u Crohnovy choroby, zánětlivého, toxického či
radiačního poškození; často se vyskytuje po radioterapii
malignit lokalizovaných v dolní části břicha a v pánvi.
Metoda
SeHCAT (Selenium HomoCholic Acid
Taurine Test) k diagnostice malabsorpce
žlučových kyselin používá jako radioindikátor 75Se-
kyselinu tauroselcholovou. Je to syntetická žlučová
kyselina konjugovaná s taurinem (23-seleno-25-homo-taurocholová
kyselina), označená radioaktivním selenem 75Se. Kyselina
tauroselchová je obdoba kyseliny žlučové, má shodné
fyziologické chování jako konjugáty žlučových kyselin.
Fyzikální
vlastnosti selenu-75 jsou uvedeny v §1.4
"Radionuklidy", pasáž "Se-75".
Měření kinetiky retence radiofarmaka se dříve
experimentálně provádělo pomocí celotělových radiometrů
nebo kolimovaných scintilačních sond. Na pracovištích
nukleární medicíny se nejlépe osvědčuje použití
scintilační gamakamery bez kolimátoru - vzhledem k
nízké aplikované aktivitě potřebujeme maximální detekční
citlivost, avšak nepotřebujeme scintigrafické zobrazení
distribuce radioindikátoru, stačí nám změřit celkový
počet impůlsů z gama-záření za daný čas -> relativní
aktivitu radiofarmaka.
Pacientovi
se perorálně (v kapsli) podá cca 400 kBq 75Se-kyseliny tauroselcholové. Pod kamerou bez
kolimátoru, umístěnou na oblast břicha, se měří
počet impulsů registrovaný za akviziční čas cca 10 minut,
okénko analyzátoru šířky 20% je nastaveno na fotopík 289
keV 75Se.
První měření se provede za 3 hod. po aplikaci (0.den), druhé
měření se udělá za 1 týden, v identické poloze pacienta
(na zádech, stejná oblast břicha). U obou měření se odečte
radiační pozadí, které bývá poměrně vysoké; měření je
potřeba dělat za podmínek, kdy se v okolí nenacházejí
žádné radioaktivní zdroje (např.
další pacienti s aplikovanou radioaktivitou). Provede se korekce na rozpad Se-75 - za 7 dní je to
koeficient 1,04. Z takto naměřených hodnot stanovíme retenci
radiofarmaka v % (hodnotu 7.dne vyjádříme jako
procento hodnoty 0.dne). Normální hodnota úbytku je >20% za
týden. Retence 10-15% se považuje za mírnou malabsorpci, 5-10%
za srřední, za těžkou malabsorpci se klasifikuje <5%.
Tato
metoda je v nukleární medicíně poměrně okrajová, provádí
se jen vzácně na některých pracovištích. Gastroenterologům
většinou stačí terapeutický test klinické odezvy na
sekvestranty po podání cholestyraminu a
biochemické testy. Přesto však v některých složitějších
případech může být toto speciální vyšetření
užitečné...
Statická scintigrafie jater
Účel: Získat nepřímou informaci o morfologii jater -
zjištění difuzního postižení a detekce ložiskových
jaterních lézí.
Radiofarmaka: Sn-koloid (nebo sirný koloid)
značený 99mTc, který je po aplikaci rychle vychytáván z
krevního řečiště Kupferovými buňkami.
Provedení: Po i.v. aplikaci cca 150 MBq 99mTc-Sn koloidu se za
15 min. provede scintigrafie v přední, zadní a pří. pravé
boční projekci. Pro lepší zobrazení lézí uložených
hlouběji v parenchymu je vhodné provést zobrazení SPECT.
Hodnocení: Na planárních nebo tomografických obrazech
vizuálně posuzujeme kromě uložení, tvaru a velikosti jater
především distribuci radiofarmaka v parenchymu. Jaterní léze
jsou většinou doprovázeny sníženou hustotou Kupferových
buněk, což se projeví sníženou akumulací radiofarmaka.
Nález je nespecifický: lokální snížení
(studená ložiska) mohou být způsobena cystami, abscesem či
nádory (metastázami), difuzní postižení
(hepatomegalie, nerovnoměrná distribuce v parenchymu,
zvýšená akumulace v extrahepatálním RES - slezině a kostní
dřeni) mohou být způsobena hepatitidou, cirhźou,
metabolickými poruchami, malignitami.
Scintigrafie
jaterních hemangiomů
Hemangiom je benigní mezenchymový nádor
krevních cév. V oblasti jater se často vyskytuje kavernózní
typ hemangiomu. Je to vysoce vaskularizovaná struktura, která
má vyšší zastoupení krve - a tím vyšší
koncentraci erytrocytů - než okolní tkáň. Po
aplikaci radionuklidově značených erytrocytů se hemangiomy
zobrazují jako "horká" ložiska zvýšené depozice
radioaktivity než v okolní tkáni.
Účel: Vyšetření slouží k detekci kavernózních
hemangiomů v játrech a k jejich odlišení od jiných útvarů
(jako jsou primární či metastatické tumory).
Radiofarmaka: Autologní erytrocyty značené 99mTc
- značené buď in vitro, častěji však in vivo
pomocí Sn-pyrofosfátu (aplikovaného 20 min. před aplikací 99mTcO4).
Provedení: Současně s i.v. aplikací radiofarmaka se spouští
dynamická scintigrafie perfúzní fáze *) v projekci ve které
se předpokládá nejlepší zobrazení podezřelých ložisek.
Celková doba dynam. snímání asi 2 min., snímková frekvence
2-3 s./snímek. Po 40-60 minutách se provádí statická
scintigrafie oblasti jater, nejlépe v tomografickém provedení SPECT.
*) Pozn.: Dříve
prováděná dynamická scintigrafie perfúzní fáze
u hemangiomů je založena na skutečnosti, že v hemangiomu je
zvýšený krevní pool při relativně pomalejším průtoku
krve ve srovnání s cévami okolní tkáně. Ukázalo se však,
že sledování perfúzní fáze má jen malý klinický přínos
a proto se většinou neprovádí.
Hodnocení: Na statických planárních scintigramech a na
rekonstruovaných tomografických SPECT řezech hledáme ložiska
zvýšené depozice značených erytrocytů, které
svědčí pro přítomnost hemangiomu. U SPECT scintigrafie je
hranice detekovatelnosti hemangiomů kolem 1 cm.
Odlišení hemangiomů od
jiných útvarů podezřelých u malignity je důležité pro
primární nádorovou diagnostiku. U hemangiomů, jakožto vysoce
prokrvených útvarů, by se neměla provádět biopsie,
neboť je zde riziko vzniku krvácení.
Scintigrafie pankreatu
Pankreas (slinivka) je malý ale metabolicky a
endokrinně důležitý orgán, uložený v břišní dutině v
oblasti duodena, těsně pod játry. Exokrinní složka,
ústící do duodena, produkuje trávicí enzymy
- pankreatickou lipázu pro štěpení tuků, alfa amylázu pro
štěpení škrobu, proteázy pro štěpení bílkovin. Za
normálních okolností jsou trávicí enzymy po svém vzniku
uvnitř pankreatu v inaktivní formě (jinak by poškodily - "natrávily" -
pankreatickou tkáň, došlo by k pankreatitidě), teprve až se dostanou do duodena se aktivují
a mohou začít plnit svou trávicí funkci. Endokrinní
část (jejíž buňky jsou uspořádány
do Langerhansových ostrůvků) produkuje hormony
pankreatu - inzulin (reguluje hladinu
cukru v krvi), glukagon, somatostatin,
pankreatický polipeptid.
Patologie pankreatu
Nejčastějším onemocněním souvisejícím s pankreatem je cukrovka
- diabetes melitus, způsobená poškozením tkání
Langerhansových ostrůvků, ve kterých je tvořen inzulin. Zánět
slinivky, pankreatitida, vzniká retencí
trávicích enzymů v pankreasu, které zůstávají uvnitř,
předčasně se aktivují a "samonatrávením"
poškozují tkáň pankreasu, což vyvolá otok a zánětlivou
reakci. Akutní pankreatitida je vyvolána
náhlou obstrukcí vývodu pankreasu do duodena,
většinou žlučovým konkrementem. Chronická
pankreatitida, způsobená zpomaleným odtokem pankreatických
enzymů do duodena, má mírnější a dlouhodobější průběh.
V těžších případech nekrotizující hemoragické
pankreatitidy se proteolytické pankreatické enzymy mohou
dostat i do krevního oběhu a způsobovat toxické účinky v
různých tkáních a orgánech. Velmi závažným onemocněním
je (adeno)karcinom pankreatu, který
lymfatickými cestami často metastázuje do celého těla.
Dynamická
scintigrafie pankreatu
Pankreas je obtížně přístupný k funkční diagnostice. Pro scintigrafické
vyšetření pankreatu bylo vyvinuto radiofarmakum 75Se-selenomethionin
H2C-S-(CH2)2CH(NH2)COOH označené radionuklidem selen 75Se
(fyzikální vlastnosti v §1.4
Radionuklidy", pasáž "Se-75"). Příjem aminokyselin v pankreatu je odrazem
rychlosti syntézy trávicích enzymů. Podobnost selenu a síry
je tak blízká, že substituce selenu místo síry
v molekule methioninu vede k analogu, který má všechny
metabolické vlastnosti aminokyseliny, včetně zabudování do
proteinů. Proto se účinně vychytává v pankreatu
při produkci trávicích enzymů.
První pokusy radioisotopového vyšetření
pankreatu v 60.letech s detekcí kolimovanou sondou (měření "naslepo"- a priori k ničemu...) a pak statickou scintigrafií pohybovým gamagrafem a
kamerou bez počítačové akvizice, byly schopné posoudit jen
hrubé abnormality pankreatu. Validní výsledky přinesla až
dynamická scintigrafie pankreatu :
Dynamické
scintigrafické vyšetření pankreatu může být
užitečné pro včasnou detekci pankreatické exokrinní
dysfunkce, retence či obstrukce vývodných cest - u
diabetických pacientů, pankreatidy, nádorových postižení.
Gamakameru opatřenou
kolimátorem ME nebo HE, okénko analyzátoru nastavené na
fotopík 264keV, umístíme mírně šikmo nad oblast jater a
pankreatu. Po i.v. aplikaci cca 100kBq/kg 75Se-selenomethioninu
se na gamakameře pořizují dynamické sekvenční
snímky oblasti jater a pankreatu v intervalech 5-10
min. po dobu 60-120 minut. Selenomethionin se nespecificky
vychytává i v játrech (kde rovněž probíhá
proteosyntéza), takže obraz pankreatu bývá často
zobrazen v rušivé interferenci na pozadí radioaktivity jater.
Pro eliminaci tohoto rušivého pozadí se ke konci vyšetření
někdy aplikuje 99mTc-koloid (za nezměněné polohy pacienta), který se
specificky vychytává v játrech. Takto vzniklé scintigrafické
obrazy jater se pak odečítají od obrazů s 75Se-selenomethioninem.
Touto postupnou subtrakcí obrazů se vhodně potlačí
obraz jater a dosáhne se lepší separace a zviditelnění
pankreatu.
Na scintigrafických
obrazech se pak vyznačí zájmové oblasti
(ROI) vhodných částí pankreatu, ze kterých se vytvoří dynamické
křivky časové závislosti akumulace selenomethioninu.
Křivky se hodnotí většinou vizuálně (na
našem pracovišti jsme však vypracovali i program pro jejich
kvantitativní zpracování). Ve fyziologických
případech křivka po počátečním rychlém nárustu dosahuje vrchol
po 20-30 min. od aplikace, pak následuje pomalejší pokles. Snížená
funkce pankreatu se na křivce projevuje plochým
tvarem, s pozdějším nástupem a zpomalením rychlosti
nárustu. Na scintigrafických obrazech se v tomto případě
pankreas zobrazuje méně zřetelně. Retence trávicích
enzymů uvnitř pankreatu se projevuje pozdějším a zpomaleným
poklesem; při závažnější patologii se vrchol a pokles
neobjevují vůbec, křivka má stále pomalu rostoucí trend.
 |
Dynamická scintigrafie pankreatu. Vlevo: Na sumárním scintigrafickém obrazu se vyznačí zájmová oblaast (ROI) vhodné části pankreatu. Uprostřed: Typické normální a patologické křivky časového průběhu vychytávání selenomuthioninu v pankreatu. Vpravo: Různé odezvy křivek na aplikaci cholecystokininu. |
V takových patologických případech se v cca
60.-90. minutě i.v. aplikuje pancreozymin, častěji
nazývaný cholecystokinin (stimuluje
též kontrakci žlučníku), 1u/kg, který stimuluje
sekreci pankreatických enzymů (a příp. se
současně aplikuje i secretin, který m.j. potencuje
účinek cholecystokinu a má také trofické účinky na
pankreas). Je to analogické výše uvedenému
cholekinetickému podnětu u dynamické cholescintigrafie, nebo
aplikaci diuretika (furosemid) u dynamické
scintigrafie ledvin. Podle odezvy průběhu křivky na tento pankreatický
stimulátor je možno odlišit snížení funkce,
parenchymální pankreatické poškození či obstrukci.....
Scintigrafie pankreatu byla
poměrně málo častým vyšetřením, diagnostická
výtěžnost poměrně nízká se značným procenten
neurčitých nálezů. Prováděla se především v
70.-80.letech. Nádorové postižení pankreatu se nyní
zobrazuje pomocí CT zobrazení a statické PET/CT scintigrafie.
Zkouší se i statická
scintigrafie pankreatu s 99mTc-interleukinem-2
pro zobrazování chronických zánětlivých změn u
autoimunitního diabetu 1.typu, k identifikaci pacientů s
pankreatickým zánětem. Umožňuje detekovat zvýšený výskyt
aktivovaných T buněk - stupeň lymfocytární infiltrace i u
menších zánětlivých procesů insulitidy, v raném období
pro léčbu imunoterapií.
Scintigrafie sleziny a dynamická
splenoportografie
Slezina (lat. lien,
řec. splén) je poněkud
"záhadný" orgán uložený v břišní dutině,
poblíž žaludku. Fylogeneticky se slezina patrně vyvinula jako
orgán krvetvorby. Tuto funkci si však zachovává
pouze v prenatálním období (do asi 6.měsíce fetálního
vývoje), pak ji přebírá kostní dřeň. Po narození slezina
funguje již jen jako "filtrační" orgán s velkým
množstvím makrofágů, zadržující mikroorganismy z krve a
přestárlé či poškozené ("opotřebované") krevní
buňky - sekvestrace erytrocytů. Dále má význam imunitní,
vytváří protilátky a imunokompetentní buňky, má
fagocytární schopnost (systém RES).
Hmotnost sleziny činí cca 100-200g, s věkem
postupně klesá. Při některých onemocněních ale dochází
ke zvětšení sleziny - spenomegalii. K mírné
splenomegalii (hmotnost do 500g) může docházet i při
infekcích. Splenoagalie středního stupně (500-1000g) může
doprovázet akutní leukemii, maligní lymfomy, polycytemii a
další. Vzácně dochází k těžké splenomegalii (hmotnost
>1000g), např. při chronické myeloidní leukemii, ...
Anatomicky se slezina řadí k retikuloendotelovému
(RES) a hematopoetickému systému. Krevní zásobení
sleziny se uskutečňuje přes portální cirkulaci (vena
portae *), čímž je výrazně spojena s játry. Proto jsme
scintigrafické metody týkající se sleziny zařadili do
kontextu jaterní scintigrafie.
*) Vena portae odvádí
krev z orgánů břišní dutiny - ze střev, dolní části
jícnu, žaludku, sleziny, pankreatu - do jater.
Patologie sleziny a
portálních cest
Jednou z patologií sleziny je shora zmíněná splenomegalie.
Portální hypertenze je zvýšený tlak krve v
povodí vrátnicové žíly (vena portae). Blokáda
vrátnicové žíly je nejčastěji intrahepatální v důsledku
jaterní cirhózy. Krev pak namísto vrátnicovou žilou odtéká
vytvořenými "spojkami" - portosystémovými
zkraty - do systémového oběhu (do povodí dolní
duté žíly). Dochází k rozvoji kolaterálního
řečiště, přetěžováním žil vznikají varixy.
Krev z trávicí soustavy obchází játra, takže není
detoxikována, což může vést k poškozování některých
tkání (mozku).
Zvýšená destrukce a sekvestrace erytrocytů ve
slezině se projevuje u hemolytické anemie (viz "Poločas přežívání erytrocytů a lokalizace
jejich destrukce"). Vede to často ke splenomegalii. Pro normalizaci
krevního obrazu se v takovém případě doporučuje splenektomie.
Statická
scintigrafie sleziny
Účel: Zobrazení funkční tkáně sleziny pro stanovení
jejího tvaru, velikosti a uložení, včetně příp.
nehomogenit. Může sloužit též pro zviditelnění a
označení sleziny k aplikaci před dynamickou
splenoportografií.
Radiofarmaka: Pro selektivní zobrazení sleziny se
používají 99mTc-značené autologní tepelně poškozené erytrocyty,
které se reaplikují vyšetřovanému pacientovi. Pro zobrazení
retikuloendotelového systému sleziny (+ jater) se používají
radiokoloidy, především 99mTc-sulfur-koloid, jehož větší koloidní částice se
vychytávají v retikuloedotel. systému sleziny a jater.
Provedení: Po aplikaci cca 100-200MBq uvedeného radioindikátoru
se za cca 20-30 minut nasnímají planární scintigrafické
obrazy v přední, zadní, a levé boční projekci. Pro
detailnější rozlišení patologických struktur můžeme
doplnit zobrazením SPECT.
Hodnocení: Na obrazech posuzujeme tvar, velikost a uložení
sleziny; velikost sleziny lze pomocí empirických metod
odhadnout z rozměrů scintigrafického obrazu. Pozorováním
homogenity distribuce radiofarmaka či přítomnosti
ložiskových změn můžeme usuzovat na abscesy, cysty,
splenomegalii, hematomy či nádorová postižení sleziny.
Dynamická
splenoportografie
Účel: Vyšetření krevního
průtoku portálním řečištěm a zjišťování příp. portosystémových
zkratů. Splenoporografie patří mezi méně častá
scintigrafická vyšetření, nyní je již téměř
opuštěná...
Radiofarmaka: 99mTc pertechnetát.
Provedení: Aplikaci radioindikátoru provádíme intrasplenicky
tenkou jehlou v malém objemu (do 10 ml.) a dostatečně rychle
(bolusově), aby byla dobře vyjádřená fáze prvního
průtoku. Současně spustíme akvizici dynamické scintigrafie v
přední projekci - 60 snímků po 2 sec., která zachycuje
průtok radioindikátoru portálním a systémovým řečištěm.
Hodnocení: Vizuálně hodnotíme snímky zachycující jednotlivé
fáze průchodu: slezina ® v.lienalis ® v.portae ® játra ® systémový oběh. Za normálních okolností po itrasplenické aplikaci
radioindikátor rychle prochází přes v.lienalis a v.portae do
jater, tam se průtok patřičně zpomalí v kapilárním řečišti,
načež jaterními žilami a dolní dutou žílou odtéká do
srdce a plic, následně pak do systémového oběhu. Za
přítomnosti zkratů (spojek) portálního a
systémového řečiště prochází část radioindikátoru mimo játra a dostává se do srdce předčasně. Kromě těchto portosystémových zkratů můžeme na
sérii snímků posuzovat i event. neprůchodnost v.lienalis nebo
v.portae.
Pro kvantifikaci dynamiky průtoku radioindikátoru portálním a
systémovým řečištěm vyznačíme příslušné zájmové
oblasti: vena lienalis, játra, srdce+plíce, z nichž
vytvoříme křivky časového průběhu pasáže
radioindikátoru. Z těchto křivek můžem provádět kvantifikaci
dynamiky průtoku. Pro křivky z oblastí v.lienalis, jater
a srdce se stanovuje čas příchodu radioindikátoru, čas
maxima, strmost (gradient) nárustu (vzestupným úsekem se
prokládá lineární funkce) a poločas úniku
radioindikátoru (sestupným úsekem se prokládá
exponenciální funkce).
Postup počítačového vyhodnocení dynamické splenoportografie
je popsán v §3.16 "Dynamická splenoportografie" knihy "OSTNUCLINE".
| Vyhodnocení dynamické splenoportografie | |
 |
|
| Hodnocení
: Po intrasplenické aplikaci 99m-Tc pozorujeme na scintigramech rychlý průtok radioindikátoru přes v.lienalis a v.portae do jater, bez patrných portosystémových zkratů. Po obvyklém zpomalení v kapilárním řečišti jater pak radioindikátor odtéká dolní dutou žílou do srdce a plic. Z
á v ě r : |
Zde jsou příklady vyhodnocení normálníá a výrazně patologickéâ radionuklidové splenoportografie.
| Vyhodnocení dynamické splenoportografie | |
 |
|
| Hodnocení
: Po intrasplenické aplikaci 99m-Tc pozorujeme na scintigramech rychlý průtok radioindikátoru přes v.lienalis do kaudálních zkratů. Játra se prakticky nezobrazují. Dlouhodobá retence radioindikátoru ve slezině. Přes kaudální protokavální zkraty odtéká radioindikátor do srdce a plic. Z á v ě r : |
Scintigrafie jícnu
a žaludku
Jícen slouží k polykání potravy (v pevné a
tekuté fázi) z úst do žaludku, kde dochází
k první fázi trávení potravy. Za fyziologického stavu je
spolknuté sousto aktivně transportováno peristaltikou
jícnu do žaludku, kam doputuje za asi 7 vteřin. K poruchám
motility jícnu může docházet vlivem zůžení
průsvitu jícnem, poruch inervace, ........... Průchod sousta
je pak zpomalen a je nepravidelný. Porucha dolního svěrače
jícnu způsobuje, že část potravy se vrací ze žaludku zpět
do jícnu - vzniká gastroezofageální reflux.
..........
Dynamická scintigrafie
jícnu - polykací akt
Účel: Posouzení motility
jícnu, jeho průchodnosti, průběhu polykání a odhalení
přítomnosti a závažnosti gastro-ezofageálního refluxu.
Radiofarmaka: 99mTc Sn- koloid nebo 99mTc-DTPA
Provedení: Perorálně podáme cca 50 MBq radioindikátoru
smíchaného s asi 10 ml. vody (či ovocné šťávy) a ihned
(lépe s předstihem) spustíme rychlou dynamickou scintigrafii
vsedě v přední projekci - 120 snímků po 0,5 sec. (zachycuje
pasáž jícnem) a následně cca 60 snímků po 30 sec.
(zachycuje evakuaci žaludku, příp. pozdní reflux). Bějem
vyšeetření můžeme příp. provést kompresi na epigastrium
nebo Valsavův manévr k vyprovokování gastroezofageálního
refluxu.
Hodnocení: Nejprve vizuálně sledujeme snímky průchodu
radioindikátoru jícnem, jeho distribuci v žaludku a posléze
jeho postupnou evakuaci do intestinálního traktu. Za normálních okolností je
polknuté sousto za pomoci peristaltiky jícnu rychle
transportováno do žaludku, takže průchod radioindikátoru
jícnem musí být dostatečně rychlý
a plynulý,
bez dočasných nebo trvalejších retencí. Při různých
patologických stavech jako je achalázie, poruchy průchodnosti
(zúžením průsvitu jícnu - nádorem, zevním útlakem jícnu
apod.), či porucha inervace jícnu, poruchy po operačních
výkonech na jícnu, dochází ke zpomalení pasáže jícnem. Na scintigrafických obrazech pak vidíme zpomalený
nebo nerovnoměrný
průchod jícnem, který může být doprovázen retencemi radioindikátoru v některých částech
jícnu. Na scintigrafických obrazech jsou však patrné jen
výraznější abnormality; podrobnější a citlivější
analýza a kvantifikace pasáže jícnem je v dalším průběhu
programu prováděna na křivkách z jednotlivých částí jícnu
a na speciálních matematických konstrukcích – transportní funkci a kondenzovaném
obraze.
Častou patologií je gastroezofageální
reflux, kdy vlivem insuficience dolního svěrače jícnu
dochází k návratu části žaludečního obsahu do
jícnu, tj. k nenormálně orientovanému pohybu proti
fyziologickému směru pasáže potravy. Na příslušných
scintigrafických snímcích se takto vzniklá regurgitace
projevuje jako přítomnost radioaktivního depositu především
v oblasti dolní třetiny jícnu (reflux může zasahovat i do
vyšších etáží jícnu – podrobnější a citlivější
analýza přítomnosti a lokalizace refluxu je v dalším
průběhu programu prováděna na křivkách z jednotlivých
částí jícnu). Reflux může nastávat buď pasivně (samovolně,
za nativních podmínek), nebo může být vyvolán zvýšeným
tlakem v žaludku (vhodnou kompresí oblasti
žaludku) - pak se jedná o aktivní reflux.
Analýza a počítačové vyhodnocení dynamické scintigrafie
polykací funkce jícnu a evakuace žaludku je podrobně popsáno
v §3.20 "Dynamická scintigrafie jícnu a žaludku" knihy "OSTNUCLINE".
| Matematická analýza a komplexní vyhodnocení dynamické scintigrafie jícnu - polykací akt | |
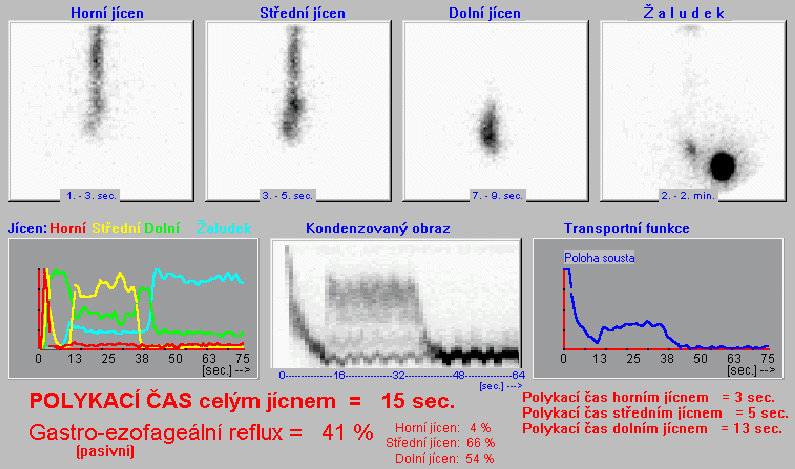 |
|
| Hodnocení
: Po perorální aplikaci radioindikátoru pozorujeme na scintigrafických obrazech nejprve rychlou pasáž horní a střední části jícnu, dále poněkud zpomalenou pasáž distální částí jícnu. Jakmile je dosaženo žaludku, nastává návrat větší části radioindikátoru až do střední etáže jícnu, kde retinuje asi 20 sekund a teprve potom postupuje do žaludku. Tento abnormální pohyb polykaného radioindikátoru je zvláště názorně vidět na kondenzovaném obraze a transportní funkci. Z á v ě r : |
Dynamická scintigrafie
evakuace žaludku a tenkého střeva
Účel: Sledování rychlosti
evakuace stravy ze žaludku do střeva, příp. rychlosti
transportu tenkým střevem.
Radiofarmaka: 99mTc Sn- koloid nebo 99mTc-DTPA, kterými označíme tuhou nebo tekutou stravu.
Provedení: Pacientovi, sedícímu před kamerou, podáme
perorálně malé sousto tuhé stravy,
označené cca 50 MBq 99mTc. Spustíme dynamickou scintigrafii, při níž
snímáme oblast žaludku po dobu asi 1,5 hodiny s frekvencí 1
snímek za minutu. Pokud chceme vyšetřovat evakuaci tekuté
stravy, může dynamická scintigrafie žaludku
navazovat na dynamickou scintigrafii polykacího aktu jícnem
(popsanou výše). Pro posouzení evakuace žaludku je však
reprezentativnější tuhá strava. Dále může navazovat
scintigrafické vyšetření transportu tenkým střevem,
formou pomalé dynamické studie nebo sekvenčních statických
snímků; podle potřeby se snímá i několik hodin. Je vhodné
pořídit kontrolní snímek břišní dutiny následující den
(po 24 hodinách).
Hodnocení: Na obrazech žaludku vyznačíme ROI, z níž
generujeme křivku časového průběhu aktivity. Tato křivka
začíná plochým ramenem odpovídajícím fázi ve které
polknutá strava neopouští žaludek (nebo jej opouští jen
velmi pomalu). Pak následuje různě rychlý pokles aktivity,
zachycující evakuaci ze žaludku do střeva. Vyhodnocujeme poločas
evakuace žaludku T1/2 - dobu nutnou k poklesu aktivity v žaludku na polovinu (klesající částí křivky proložíme
exponenciální funkci, z jejíhož rychlostního koeficientu
stanovíme T1/2). Normální hodnoty poločasu evakuace žaludku se u
tuhé stravy pohybují v rozmezí 60-90 min., u tekuté stravy
cca 30-40 min. Pokud navazovala scintigrafie tenkého střeva, na
sekvenčních snímcích stanovíme dobu od polknutí, za kterou
se aktivita poprvé objeví v počáteční široké části
tlustého střeva (caecum). Je to tzv. oro-cekální
čas, jehož normální hodnoty jsou cca 2-5 hodin. Jelikož
poločas evakuace žaludku má také vliv na rychlost transportu
tenkým střevem, je nutno jej též zohlednit.
Scintigrafická
lokalizace krvácení do GIT
Provádí se pomocí značených erytrocytů.
Odebereme se cca 2-5 ml. krve, v níž in vitro 99mTc označíme
erytrocyty a reinjektujeme zpět. Po i.v. aplikaci cca 500 MBq
těchto in vitro značených autologních erytrocytů se provede
scintigrafie dutiny břišní. Nejprve dynamická scintigrafie
cca 60 snímků po 1 min. Pokud se do té doby neobjeví na
obrazech extravasální aktivita, pokračujeme snímáním
statických obrazů v cca hodinových časových odstupech.
Případné ložisko krvácení se na scintigramech projeví
zvýšením koncentrace radioaktivity v oblasti kde dochází ke
krvácení.
Scintigrafie Meckelova
divertiklu - zobrazení ektopické žaludeční sliznice
Divertikl v lékařské terminologii obecně
označuje lokální vychlípení stěny dutého orgánu.
Meckelův divertikl (v užším smyslu) je
vychlípení stěny tenkého střeva tvořené ektopickou
žaludeční sliznicí. Může být scintigraficky zobrazen 99mTc-technecistanem, který se
fyziologicky vychytává v buňkách žaludeční sliznice. Po
i.v. aplikaci tohoto radiofarmaka povádíme dynamické
snímkování oblasti břicha, cca 1min./snímek po dobu 1
hodiny. Současně se zobrazením fyziologické akumulace ve
sliznici žaludku se zobrazí i případný okrsek ektopické
sliznice Meckelova divertiklu.
4.9.4 Nukleární kardiologie
Srdce (lat. cor,
řec. kardia) je dutý svalnatý
orgán, který svými pravidelnými stahy funguje jako čerpadlo
pohánějící krevní oběh v celém organismu.
Zajišťuje tím přenos dýchacích plynů, živin a odpadních
látek metabolismu. Stavbou, funkcí a onemocněními srdce se
zabývá kardiologie. Srdce vyšších
organismů, zvláště savců a člověka, se skládá z
několika anatomických a funkčních částí :
- Srdeční dutiny a přívodní
cévy
Neokysličená krev (prošlá organismem) je do srdce
přiváděna dutými žilami - horní a dolní, které
se před srdcem spojují do žilního splavu. Krev při
průtoku srdcem prochází 4 dutinami, které
jsou navzájem odděleny chlopněmi,
zabraňujícímu zpětnému toku krve. Z žilního splavu krev
přitéká do pravé síně. Odtud přes
trojcípou (trikuspidální) chlopeň vstupuje do pravé
komory. Pravá komora svými stahy vypuzuje krev přes
"poloměsíčkovou" chlopeň do plícnice
- hlavní tepny plicního oběhu. Průchodem přes plíce
se krev okysličuje. Z plic přitéká okysličená krev
plicními žilami do levé síně a odtud přes dvojcípou
chlopeň (zvanou též mitrální pro podobnost s
tvarem biskupské mitry) do levé komory. Stahy
levé komory je krev přes aortálních chlopeň
vypuzována do aorty, čímž se okysličená
krev dostává do hlavního tepenného oběhu - prochází
jednotlivými tkáněmi a orgány, odevzdává kyslík,
přenáší živiny, přijímá zplodiny metabolismu a žilním
systémem se přes duté žíly vrací do srdce.
"Pumpování" krve se odehrává střídáním fází
systoly a diastoly srdeční komory. Při systole
dochází ke kontrakci srdeční komory a krev tryská ze
srdečních komor do tepen. Při relaxační fázi - diastole
- svaly komor ochabnou a srdce se pasívním tlakem plní krví.
Každou systolou je ze srdce vypuzeno cca 70ml. krve (tzv.
tepový objem, stroke volume). Množství kve, které komora
přečerpá za minutu se nazývá minutový volum
srdeční (cardiac output).
- Srdeční chlopně
fungují jako jednocestné ventily, které umožňují
tok krve pouze jedním směrem, zatímco v opačném směru se
uzavřou a tok zablokují. V srdci se nacházejí 4 chlopně: - Dvojcípá
(mitrální) chlopeň mezi levou síní a levou komorou; - Trojcípá
(trikuspidální) chlopeň mezi pravou síní a pravou komorou; -
Aortální chlopeň na rozhraní levé komory a aorty; -
Poloměsíčková plicní (pulmonální) chlopeň ve
vyśtění pravé komory do plícnice. Aby chlopeň správně
fungovala, je třeba aby při otevření vznikal dostatečně
velký otvor pro průtok krve a při uzavření naopak musí
těsně doléhat, aby nedocházelo ke zpětnému toku krve.
Častou poruchou je nedomykavost chlopní, kdy se část
vypuzené krve vrací zpět - tzv. regurgitace, při
níž je srdce pak musí přečerpat znovu. Snižuje se tím
čerpací účinnost a srdce je přetěžováno.
- Srdeční svaly
Hnacím prvkem čerpání je srdeční svalovina - myokard,
který svými pravidelnými stahy pohání čerpací činnost
srdce. Je to příčně pruhovaný značně výkonný sval. Jsou
tvořen srdečními buňkami kardiomyocyty.
Nejsilnější srdeční sval je v levé komoře, která musí
pod značným tlakem vypuzovat krev do velkého oběhu.
- Cévní zásobení srdce
Aby mohl srdeční sval pracovat, potřebuje kyslík a živiny.
Cévní zásobení srdečního svalu okysličenou krví
zajišťují dvě věnčité koronární tepny
vycházející z aorty. Rozvětvují se do sítě cév, která
obkružuje myokard a svým tvarem připomíná věnec.
Při zúžení některých úseků věnčitých tepen
(především vlivem aterosklerotických plaků, či embolizací)
dochází ke snížení cévního zásobení srdečního svalu - ischemická
chroba srdeční. Úplným uzávěrem tepny dojde po
20-40 minutách k ischemické nekróze - infarktu
myokardu, při němž nastává nevratné odumření
srdeční svaloviny v povodí uzavřené cévy.
- Řízení srdeční činnosti
Kontrakce srdeční svaloviny je stimulována elektrickými
impulsy. Řízení činnosti srdce je do značné míry autonomní
- elektrické podněty ke kontrakci myokardu se generují a jsou
vedeny v srdeční stěně, v převodním systému srdečním.
Hlavním zdrojem vzruchů je sinoartriální uzel -
shluk buněk ve stěně pravé síně poblíž žilního splavu.
Tento uzel je ovlivňován autonomním (vegetativním) nervovým
systémem z kardioregulačního centra v mozkovém kmeni, v
prodloužené míše (hypotalamu). Signál se v mezikomorové
přepážce rozděluje na dvě Tawarova raménka, pravé
a levé, která míří k myokardu a šíří vzruch podél stěn
komor. Tyto elektrické signály vzruchů můžeme snímat
pomocí EKG.
Patologie srdce a cév
Ischemická choroba srdeční
spočívá ve zúženém průsvitu věnčitých tepen myokardu v
důsledku aterosklerózy, což má za následek zhoršení
perfúze srdečního svalu. Závažné snížení perfuze se
projevuje anginou pectoris, úplný uzávěr vede k infarktu
myokardu.
Srdeční amyloidóza je
způsobena depozicí nerozpustných proteinů, tzv. amyloidlů
(vžil se tento zavádějící název...) ve fomě amiloidových fibril v
mezibuněčných prostorách srdečního myokardu. Vede to ke
ztlušťování srdeční stěny a zhoršení její
kontraktility.
Vady srdečních chlopní
spočívají buď ve zúžení (stenóza) nebo v jejich nedomykavosti,
především mitrální nebo aortální chlopně. Dochází tím
ke zpětnému toku - regurgitaci, čímž se snižuje
účinnost čerpací funkce srdce. Chlopně mohou být postiženy
v rámci vrozených vad, ale i jako získané postižení při
infekční endokarditidě.
Poruchy srdečního rytmu,
zvané též arytmie, mohou být způsobeny
poruchou tvorby elektrického vzruchu, nebo poruchou šíření
vzruchu. Závažnější arytmie se upravují pomocí
kardiostimulátoru (pacemakeru).
Poruchy kontraktility myokardu -
hypokinéza, akinéza, asynchronie, dyskinéza (či aneurysma)
.................
Intrakardiální zkraty jsou
otvory - defekty - v srdeční stěně (septu) mezi komorami nebo
síněmi. Nejčastěji se jedná o levo-pravé zkraty
mezi levou a pravou komorou nebo levou a pravou síní. Méně
časté jsou pravo-levé zkraty.
V
souvislosti s výše nastíněnou funkcí srdeční činnosti a
jejími poruchami se kardiologická diagnostika
provádí ve čtyřech základních směrech :
1. Akustická diagnostika
srdečních ozvů systolicko-diastolické funkce pomocí
fonendoskopu a diagnostika elektrické činnosti
srdce pomocí elektrokardiografie EKG. Jsou to nejstarší
kardiologické metody. Nyní k nim přistupuje velmi důležitá ultrazvuková
sonografie - dopplerovská echokardiografie.
2. Diagnostika centrální hemodynamiky
- měření průtoku krve srdečními dutinami a velkými
cévami, odhalování intrakardiálních zkratů a nedomykavosti
srdečních chlopní, včetně posouzení jejich závažnosti.
3. Diagnostika perfuze myokardu
- ischemické choroby srdeční, viability ischemického
myokardu.
4. Diagnostika srdeční
amyloidózy.
Nukleární medicína může
nabídnout kardiologii 5 diagnostických okruhů :
- Metody vyšetřující systolicko-diastolickou
funkci srdce jako "pumpy" mohou prokázat
celkové i regionální narušení pohyblivosti srdečních stěn
či synchronizace s elektrickou aktivitou srdce, stanovit
celkovou "výkonnost srdeční pumpy". Jedná se o rovnovážnou
EKG-hradlovanou ventrikulografii a SPECT myokardu.
- Vyšetření centrální
hemodynamiky - průtoku krve srdečními dutinami a
velkými cévami. Po aplikaci bolusu
radioindikátoru lze sledovat dynamiku průtoku krve velkými
cévami, plnění srdečních síní a komor včetně odhalení inkrakardiálních
zkratů, stanovit minutový volum srdeční,
kardiopulmonální volum, časy průtoku a
další důležité hemodynamické parametry.
- Vyšetření
regionálního prokrvení myokardu, za klidu i
zátěže, umožňuje diagnostikovat ischemickou chorobu
srdeční, její lokalizaci a závažnost.
- Ověřování viability
myokardu, poškozeného ischemií. Je důležité pro
plánování revaskularizačních zákroků (by-pass,
angioplastika) - revaskularizace má smysl jen v případě
viabilního myokardu (který je třebas jen dočasně hybernovaný
ischemií), nikoli u již neviabilního (nekrotického) myokardu.
- Vyšetření amyloidózy
myokardu pomocí posouzení rozdílu akumulace
osteotropního radiofarmaka v hrudním skeletu a v myolkardu.
Tyto metody budou níže podrobněji popsány a
ilustrovány na scintigrafických obrazech fyziologických a
patologických.
Rovnovážná
hradlovaná ventrikulografie
Účel :
Je to dynamická scintigrafická metoda, která poskytuje
komplexní informace o činnosti srdce jako čerpadla
krevního oběhu. Zobrazují se změny aktivity v jednotlivých
srdečních oddílech - komorách a síních během jejich
pulzace v průběhu srdečního cyklu. Jelikož radioindikátor
je rovnoměrně a stabilně "rozmíchán" v krevním
řečišti, jsou změny aktivity - a tím i vycházejícího
záření g - přímo úměrné změnám objemu
komor a síní při pulzaci. Můžeme stanovit hemodynamické
funkční parametry srdečních komor, zobrazit regionální
kinetiku srdečních stěn, stanovit regurgitační frakci levé
komory (spolu s radiokardiografií). Metoda je užitečná pro posuzování dopadu
ischemické choroby srdeční či infarktu myokardu, popř.
kardiomyopatie, na funkci srdeční komory. Uplatňuje se i při
zjišťování kardiotoxicity cytostatik při chemoterapii
nádorových onemocnění.
Při průběžném dynamickém snímkování by byl počet
impulsů nastřádaných v průběhu jednoho cyklu příliš
nízký na to, aby bylo možno zobrazit tvary a velikosti
srdečních komor a stanovit jejich objemové změny. Využívá
se proto technika EKG hradlování (gating):
vedle scintigrafických impulsů z kamery se snímá i
elektrický signál EKG, který vhodně řídí
(spouští, hradluje, "gejtuje") průběh akvizice. Od
R-vlny z EKG se odvozují hradlovací impulsy, které synchronizují
periodické ukládání scintigrafických snímků do vymezených
oblastí paměti počítače. Postupným sčítáním sobě
odpovídajících snímků z jednotlivých srdečních cyklů
vzniká výsledný soubor obrazů, který představuje fázovou
dynamickou scintigrafii jednoho "reprezentativního"
srdečního cyklu, vzniklou synchronním
sečtením několika stovek průběžných cyklů (podrobně bylo popsáno v §4.4 "Hradlovaná fázová
scintigrafie"). Počítačovým vyhodnocováním této fázové
scintigrafie pak můžeme posuzovat pulzování stěn
srdečních komor a síní a vytvářet volumové křivky
během srdečního cyklu, z nichž můžeme stanovit řadu
kvantitativních parametrů systolicko-diastolické činnosti
srdce.
Radiofarmaka:
Je třeba použít radioindikátor, který se dostatečně dlouho
udržuje v rovnovážné koncentraci a neuniká z krevního
řečiště. Používají se 99mTc-značené erytrocyty, které je
možno připravit dvěma způsoby: 1. Laboratorně in
vitro z odebraného vzorku krve, v němž se erytrocyty
označí 99mTc a reinjektijí se zpět pacientovi. 2. In
vivo, kdy se pacientovi nejprve aplikuje rozpuštěná
sůl cínu a po asi 15 minutách se aplikuje potřebná aktivita 99mTc-pertechnetátu.
Cínové ionty Sn2+ umožní vazbu technecia na červené krvinky v oběhu.
Provedení:
Po aplikaci cca 400 MBq radiofarmaka se snímá detektorem
kamery, zacíleným na oblast srdce v projekci LAO v úhlu asi
35-50°, aby komorové septum bylo přibližně kolmé k rovině
detektoru. Pacient má přiložené elektrody EKG
(kardiomonitoru), jehož výstup R-vlny je napojen do
synchronizačního obvodu kamery. Počkáme na ustabilizování
srdeční frekvence. Střádáme v režimu EKG-gated
tak, aby srdeční cyklus byl rozdělen do cca 16-32 obrazů,
vyhrazených v paměti akvizičního počítače. Nasnímáme cca
500-800 srdečních cyklů, přičečmž jsou eliminovány cykly
s předčasnou nebo opožděnou R-vlnou. Vyšetření můžeme
provádět v klidu i v ergometrické či farmakologické
zátěži.
Hodnocení:
Regionální pohyblivost stěny levé srdeční
komory lze v nejjednodušším případě posuzovat vizuálně
pomocí kinematografického promítání jednotlivých
obrazů reprezentativního srdečního cyklu v rychlém sledu za
sebou (což zviditelní pohyb srdečních oddílů -
"tepání srdce"). Semikvantitativně ji můžeme
posuzovat pomocí obrysové metody, kdy vyhodnocovací
program do jednoho obrazu vynese konturu komory
v end-diastole ED a end-systole ES. Na vzájemném vztahu těchto
kontur můžeme rozpoznat poruchy - hypokinézu, akinézu,
dyskinézu (obr.3.1.2 v "Radionuklidová ventrikulografie"). Dále můžeme
konstruovat parametrické obrazy rozložení
určitého parametru v orgánu. Nejjednodušší je tepový
obraz (obraz tepového objemu - rozdíl obrazů ED-ES) a
paradoxní obraz vzniklý odečtením obrazů
ES-ED, na kterém se fyziologicky zobrazují předsíně a
patologicky dyskinetické oblasti komory (které se v systole
nevyprazdňují, ale naopak se zvětšují). Dále je možno
sestavit obraz ejekční frakce, vzniklý z obrazu
tepového objemu vydělením obrazem komory v end-diastole
(ED-ES)/ED. Nejpřesnější analýzu dynamiky srdečního cyklu
poskytuje regionální Fourierovská analýza
pomocí sinusových a kosinusových funkcí s určitými
amplitudami s fázemi v každém obrazovém prvku. Získáme dva
parametrické obrazy: obraz amplitudy, jehož
každé místo je úměrné intenzitě pulzace (lokálnímu
tepovému objemu) a obraz fáze, vyjadřující
časové-fázové posunutí (zpoždění) začátku kontrakce
myokardu v daném místě oproti příchodu R-vlny EKG - obr.3.1.3, 3.1.4 v
"Radionuklidová
ventrikulografie".
Na obrazech ED a ES reprezentativního cyklu vyznačíme
(manuálně nebo s pomocí matematických algoritmů, včetně
zohlednění parametrických obrazů) zájmové oblasti
(ROI) levé komory, příp. pravé komory a oblast tkáňového
pozadí. Počítačový program vytvoří objemovou
křivku komory, z níž se vypočítávají důležité hemodynamické
parametry: ejekční frakce, tepový objem, minutový
objem srdeční, end-diastolický a reziduální volum komory,
ejekční a plnicí rychlosti komory - viz obrázky níže. Tyto
parametry jsou důležité zvláště pro levou komoru, u pravé
komory, která má méně pravidelný tvar, je přesné
stanovení obtížnější.
Matematická analýza a počítačové vyhodnocení
radionuklidové ventrikulografie je podrobně popsáno v §3.1
"Radionuklidová
ventrikulografie" knihy
"OSTNUCLINE".
| Matematická analýza a komplexní vyhodnocení radionuklidové ventrikulografie | |
 |
|
| Hodnocení
: Na fázových scintigrafických obrazech srdečního cyklu, ani na Fourierových obrazech fáze a amplitudy, nepozorujeme regionální poruchy motility srdeční stěny. Z á v ě r : |
Zde jsou příklady vyhodnocení normálníá a těžce patologickéâ radionuklidové ventrikulografie.
| Matematická analýza a komplexní vyhodnocení radionuklidové ventrikulografie | |
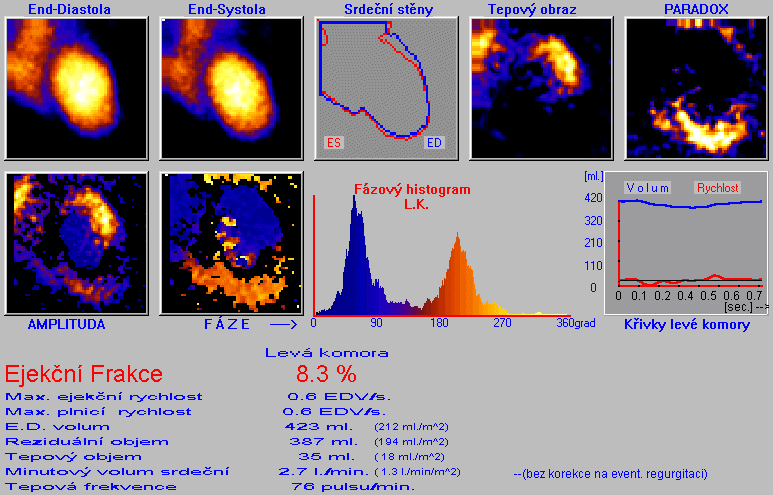 |
|
| Hodnocení
: Na fázových scintigrafických obrazech srdečního cyklu a na Fourierových obrazech fáze a amplitudy pozorujeme následující regionální poruchy motility stěny levé srdeční komory: hypokinéza segmentu: Prakticky všech, kromě posterolat. Z á v ě r : |
Dynamická
bolusová angiokardiografie
Účel:
Rychlá dynamická scintigrafie průchodu a ředění
radioaktivního bolusu pravým srdcem, plícemi a levým srdcem,
která poskytuje informace o dynamice krevního průtoku
v oddílech srdce a velkých cévách. Analýzou této dynamiky
můžeme získat kvantitativní parametry funkce komor, jejich
objemové parametry, odhalení a kvantifikaci nitrosrdečních
zkratů. Spolu s radionuklidovou ventrikulografií lze
stanovit regurgitační frakci levé komory.
Radiofarmaka:
Pro samotnou dynamickou angiokardiografii lze použít obyčejný
99mTc-pertechnetát,
nebo lépe 99mTc-DTPA. Pokud se bude následně provádět hradlovaná
ventrikulografie (např. pro kvantifikaci regurgitace), je nutno
použít 99mTc-značené erytrocyty, jak bylo popsáno výše u
ventrikulografie.
Provedení:
Aplikace radioindikátoru (cca 400-800 MBq) se provádí pod
kamerou nasměrovanou na oblast srdce a plic v pravé šikmé
projekci se sklonem detektoru kamery cca 30-45° (v této projekci se optimálně oddělí a rozliší
obrazy komor, síní, plícnice a aorty).
Aplikuje se do co nejkratší cévní vzdálenosti k srdci - do
antekubitální žíly pravé ruky, do v.subklavia nebo
v.jugularis interna. Jelikož se jedná o dynamickou scintigrafii
rychlého děje, je nutno provést tzv. bolusovou
aplikaci (lat. bolus=sousto): rychlou jednorázovou aplikaci radioindikátoru o
vysoké objemové aktivitě v malém objemu cca 0,5 ml., během
krátké doby cca 1s. (s propláchnutím
několika ml. fyziologického roztoku pomocí trojcestného
ventilu), s okamžitým spuštěním
dynamické scintigrafie s dostatečně vysokou snímkovou
frekvencí (cca 4 snímky/sec.). Rychlou fázi snímáme cca 60-100sec., pak může
následovat pomalejší snímání fáze ekvilibria (10sec./snímek po dobu cca 5min.).
Hodnocení:
Vizuálním prohlížením sekvenčních snímků průchodu
bolusu srdečním oběhem můžeme kvalitativně posoudit příp.
abnormity, zvláště předčasnou cirkulaci a recirkulaci,
která by mohla být způsobena srdečními zkraty. Pak
vyznačíme zájmové oblasti (ROI) a vytvoříme křivky
distribuce radioindikátoru z pravé a levé komory, pravé
síně, plic a příp. aorty.
K odhalení a kvantifikaci L-P zkratu
používáme křivku časového průběhu radioaktivity v oblasti
plic - pulmogram. Za normálních okolností se
na tomto pulmogramu kromě ostrého vrcholu prvního průtoku po
asi 30-50 sec. objeví jen nízký široký vrchol systémové
recirkulace, způsobený návratem radioindikátoru přes
systémový oběh zpět do srdce. Je-li však přítomen L-P
zkrat, objeví se záhy po vrcholu prvního průtoku další předčasný
recirkulační vrchol (nebo u malého zkratu jen
rozšíření sestupného ramena křivky), způsobený
recirkulací zkratem prošlé krve z levé komory do komory
pravé a pak do plic. Matematickým rozkladem pulmogramu na
křivku prvního průchodu, systémové recirkulace a zkratové
recirkulace můžeme kvantifikovat velikost zkratu
pomocí poměru zkratového průtoku a plicního průtoku Qz/Qp (bez zkratu je blízký 0) nebo poměru plicního
průtoku a systémového průtoku Qp/Qs (bez
zkratu se blíží 1) - podrobnosti viz
"Bolusová
radiokardiografie", obrázky 3.2.3 a 3.2.4. Z křivek pravé a levé komory můžeme stanovit
průměrný tranzitní čas centrální cirkulace a
kardiopulmonální objem krve. Je-li na křivce aorty přítomen
vrchol předčasné cirkulace, lze rozkladem křivek odhalit a
kvantifikovat pravo-levý zkrat.
Pokud byla snímána rovnovážná fáze, analýzou křivky z
levé komory lze (kombinací dilučního a
Steward-Hasmiltonova principu - viz "Bolusová
radiokardiografie", obr. 3.2.1 a 3.2.2) stanovit minutový volum
srdeční. Analýzou křivky z pravé komory lze v
principu stanovit ejekční frakci pravé komory.
Kombinace bolusové angiokardiografie a hradlované
ventrikulografie umožňuje kvantifikovat regurgitaci u
srdečních chlopní - stanovit regurgitační frakci.
Matematická analýza a počítačové vyhodnocení
radionuklidové angiokardiografie je podrobně popsáno v §3.2
"Bolusová
radiokardiografie" knihy
"OSTNUCLINE".
| Matematická analýza a komplexní vyhodnocení radionuklidové angiokardiografie | |
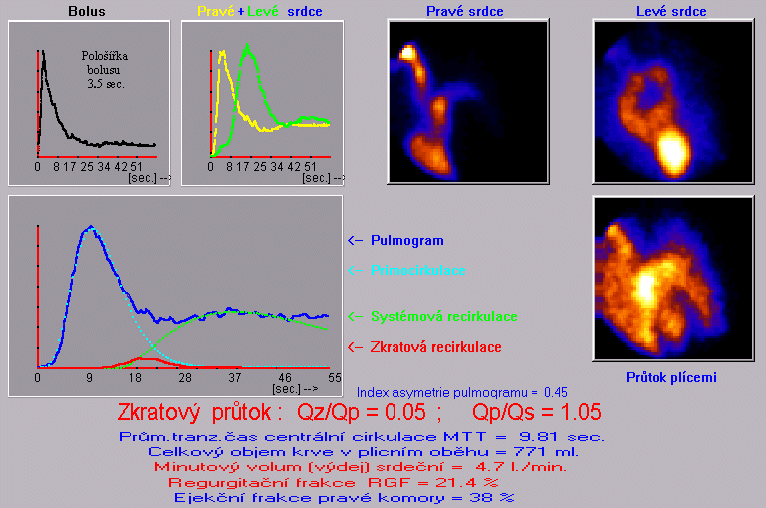 |
|
| Vizuální
hodnocení : Po intrajugulární injekci bolusu radioindikátoru se zobrazují nezvětšené dutiny pravého srdce, následuje plnění nerozšířené plícnice a plicního řečiště, které se přiměřeně rychle vyprazdňují do normálně konfigurovaných dutin levého srdce a aorty. Během průchodu bolusu levým srdcem nepozorujeme předčasný výskyt radioindikátoru v pravém srdci a plících. Z á v ě r : |
Zde je výsledný protokol vyhodnocení angiokardiografie bez zkratuá (ale s regurgitací) a mezivýsledky při vyhodnocení pacienta s výrazným levo-pravým zkratemâ.
| Matematická analýza L-P zkratu při vyhodnocení radionuklidové angiokardiografie | |
 |
|
| Rozkladem křivky pulmogramu na primocirkulaci, systémovou recirkulaci a předčasnou recirkulaci pozorujeme hemodynamicky významný levo-pravý zkrat. Porovnání křivek průchodu bolusu pravou síní a komorou svědčí pro zkrat na úrovni komorového septa. |
Scintigrafie
perfuze myokardu
Účel:
Je to neinvazivní metoda pro posouzení regionální perfúze
myokardu a vlivu příp. koronární stenózy na dodávku krve do
srdečního svalu v příslušném povodí - v klidu a při
fyzické nebo farmakologické zátěži. Může sloužit k
odhalení ischemické choroby srdeční, její lokalizaci,
rozsahu a stupně poškození myokardu, posouzení viability
buněk myokardu.
Radiofarmaka:
Základním požadavkem je, aby se radioindikátor již při
prvním průtoku účinně vychytával buňkami myokardu a byl v
nich fixován (bez redistribuce) po dobu snímání scintigrafie.
V tomto případě je zobrazované rozložení radiofarmaka v
srdečním svalu úměrné "nabídce" - regionálnímu
průtoku v koronárním řečišti. Tato distribuce ovšem
závisí i na funkčním stavu kardiomyocytů: k hromadění
radioindikátoru nedochází v oblastech, kde jsou srdeční
buňky nekrotické (nebo jsou po infarktu nahrazeny pojivovou
tkání). Distribuce radioindikátoru v myokardu je tedy
proporcionální regionálnímu krevnímu průtoku myokardem a
viabilitě myokardiálních buněk.
Dříve bylo používáno především thalium, 201Tl-chlorid,
jakožto analog draslíku. Vstupuje do myocytů přes buněčnou
membránu většinou aktivním procesem Na/K ATP (adenosin-trifosfát) systémem,
částečně i pasivní difuzí. ....Nevýhodou thalia je nízká
energie X a gama záření, což způsobuje horší rozlišení a
výraznou absorbci v tkáni; rovněž značnou radiační
zátěž (k níž přispívají i hojně
zastoupené Augerovy elektrony). Aplikuje
se cca 100 MBq 201Tl.
Pozn.: V blízké budoucnosti však lze
možná očekávat částečnou "renezanci" thalia v
souvislosti se zaváděním speciálních polovodičových
CZK kamer v nukleární kardiologii. Tyto gamakamery
mají vyšší detekční účinnost pro nízkoenergetické
fotonové záření cca 73keV 201Tl.
Nyní se pro scintigrafii
perfuze myokardu a posouzení jeho viability převážně
používají radioindikátory značené 99mTc , které při nižší
radiační zátěži poskytují podstatně kvalitnější obrazy.
Jsou to především 99mTc-isonitrily - nepolární lipofilní
komplexy, které vstupují do buněk myokardu pasivním
transportem a vážou se v jejich cytoplasmě či v
mitochondriích. Radiofarmakum se akumuluje, v závislosti na
prokrvení, ve zdravých viabilních buňkách, zatímco v
buňkách poškozených (např. v důsledku ischemie), či
dokonce odumřelých a nahrazených jizevnatou fibrózní
tkání, k akumulaci nedochází. Distribuce radioindikátoru v
jednotlivých místech myokardu je pak proporcionální
regionálnímu krevnímu průtoku myokardem a viabilitě
myokardiálních buněk.
Koncentrace
těchto 99mTc-isonitrilových
radiofarmak v myocytech zůstává stabilní po několik hodin po
i.v. aplikaci a zobrazuje tak okamžitou perfúzní
situaci myokardu v době aplikace, např. při
zátěži. Nejčastějším perfúzním radiofarmakem je 99mTc-MIBI
(2-methoxyisobutyl-isonitril) a 99mTc-Tetrofosmin (difosfinový
komplex) . Aplikuje se cca 500-800 MBq 99mTc MIBI nebo
tetrofosminu.
PET
radiofarmaka pro perfúzní scintigrafii myokardu
Scintigrafie myokardu pomocí techniky pozitronové
emisní tomografie (PET) se provádí poměrně
zřídka. Jednak pro méně rozšířenou a nákladnou
přístrojovou techniku PET, hlavně však pro obtížnou
dostupnost vhodných pozitronových radionuklidů a
radiofarmak (bylo diskutováno výše v
§4.8., pasáž "Radionuklidy a
radiofarmaka pro PET").
Nejjednodušším PET radioindikátorem perfúze
je "značená voda", v níž
je obyčejný kyslík 16O nahrazen pozitronovým radionuklidem 15O - tedy voda H215O. Po aplikaci prochází volnou
difuzí přes kapiláry a buněčné membrány, takže distribuce
radioaktivity, měřená pomocí PET, je úměrná průtoku krve.
Vzhledem k vysoké koncentraci radioindikátoru v krevním oběhu
však zobrazení myokardu není příliš kontrastní. Dalším
perfúzním radioindikátorem je amoniak 13NH3
značený dusíkem-13 . Díky vysoké první extrakci (80%) a
lineárnímu vychytávání podle průtoku krve v myokardu
poskytuje kvalitní snímky. PET scintigrafie s těmito
krátkodobými radionuklidy 15O (T1/2 =2min.) a 13N (T1/2 =10min.) je vázána na centra
disponující cyklotronem a používá se především pro
výzkumné účely.
Poněkud častěji se pro scintigrafii perfuze
myokardu metodou PET používá krátkodobý
pozitronový radionuklid rubidium 82Rb díky
tomu, že jej na pracovištích lze získávat z 82Sr/82Rb generátoru.
Aplikuje se ve formě chloridu 82RbCl, chová se jako analog draslíku (podobně jako thalium 201Tl zmíněné
výše; ve srovnání s thaliem však rubidium-82 poskytuje
kvalitnější scintigrafické obrazy při nižší radiační
zátěži).
Nejčastější PET
radiofarmakum fluor-deoxyglukóza 18FDG
se sice používá především pro nádorové zobrazování,
avšak jelikož se jedná o analog glukózy, vychytává se v
myokardu v závislosti na perfuzi, ischemii a viabilitě (viz níže "Metabolické scintigrafie,
zobrazení viability myokardu").
Provedení:
Vyšetření může být provedeno v klidu nebo v zátěži. Za klidových
podmínek je distribuce krevního průtoku v myokardu většinou
homogenní, menší nebo střední porucha perfuze se neprojeví.
Pokud totiž není koronární stenóza větší než cca 90%, je
klidový průtok myokardem dostatečný k zajištění
normálního metabolismu myokardu; dostaneme normální
perfúzní scintigram myokardu, navzdory příp. přítomnosti
ischemické choroby srdeční. Poruchu perfuze myokardu i bez
zátěže lze pozorovat pouze u závažného postižení
koronárních arterií nebo po infarktu myokardu.
Diagnostická citlivost na poruchy perfúze se projeví teprve
při vyšetření v zátěži, kdy se zvýší
požadavky na dodávku kyslíku srdeční tkáni - na koronární
prokrvení. Normární koronární arterie na to reagují
vizodilatací a příslušným zvýšením koronárního
průtoku, což se projeví zvýšenou koncentrací
radioindikátoru při perfúzní scintigrafii. Patologicky
zúžené koronární cévy však tohoto nejsou schopny (podle možnosti jsou i v klidu již dilatovány
kompenzačními mechanismy), na jejich
průtok má zátěž jen malý vliv. V povodí koronární tepny,
postižené hemodynamicky významnou stenózou, se při zátěži
projeví relativně nižší perfuze než v okolních částech
myokardu - na scintigramu se toto místo zobrazí jako perfúzní
defekt v myokardu, nebo alespoň jako snížení
distribuce radiofarmaka.
Proto se i.v. aplikace radiofarmaka provádí při zátěži buď
fyzické (většinou bicyklový ergometr), nebo farmakologické -
aplikaci vasodilatačních preparátů (dipyridamol, adenosin,
dobutamin)......
Vlastní scintigrafii provádíme asi za 10min. po aplikaci.
Scintigrafické snímání se dříve, před zavedením
tomografické scintigrafie SPECT, provádělo planárně (v projekci LAO 30°, 60°),
avšak tomografická scintigrafie SPECT poskytuje lepší
odlišení jednotlivých částí myokardu (výhody
tomografické scintigrafie oproti planární byly diskutovány
výše v §4.3 "Tomografická
scintigrafie"). Nejčastěji se používá dvoudetektorová SPECT
kamera *), jejíž detektory se nastaví do úhlu 90°. Snímá
se cca 32-64 projekcí v celkovém úhlu 180° kolem pacienta -
od pravé přední šikmé projekce RAO 45° do levé zadní
šikmé projekce LPO 45°. Provádí se EKG-hradlovaný
SPECT myokardu se synchronizací R-vlnou
elektrokardiogramu, analogicky jak bylo popsáno výše u
hradlované ventrikulografie, snímáme cca 500 cyklů.
*) Byly vyvinuty i jednoúčelové speciální typy kardiologických
kamer optimalizovaných pro scintigrafii myokardu. Na
některých pracovištích se pro SPECT myokardu začínají
používat perspektivní polovodičové CZK kamery
(§4.2., část "Nové a alternativní fyzikální a technické
principy scintilačních kamer",
pasáž "Polovodičové
multidetektorové kamery",
obr.4.2.10 vpravo). Při jejich použití
stačí aplikovat méně než polovinu obvyklé aktivity, při
současném snížení doby vyšetření.
Pokud je zátěžová perfúzní
scintigrafie normální, klidovou scintigrafii již není třeba
provádět.
Hodnocení:
Na tomografických obrazech koronárních, sagitálních a
transverzálních řezů se myokard zobrazuje *) v podobě více
či méně uzavřených "prstenců" nebo
"rohlíčků" či "podkov", na nichž
můžeme vizuálně hodnotit distribuci
radioaktivity - posuzovat velikost, počet a lokalizaci příp. perfúzních
defektů a hypoperfúzí.
*) Na obrazech vidíme zřetelně jen
tlustší stěnu levé srdeční komory, nikoli tenší stěnu
pravé komory.
Pro semikvantitativní hodnocení se často používá konstrukce
tzv. polárních map (slangově
"bull's eye"):
koronární řezy kolmé na krátkou osu levé komory se
transformují a sumují na sebe tak, že vytvářejí
soustředné kruhové profily s hrotem uprostřed. Jas (či
barva) vzniklé kruhové plochy se moduluje různou koncentrací
radioindikátoru zobrazeného v sumaci jednotlivých vrstev. Tyto
profily jsou uloženy jako soustředné prstence do nového
kruhového obrazu. Získá se tím přehledná normalizovaná
polární mapa rozložení aktivity ve stěně myokardu - mapa
regionální perfuze myokardu (v
polárních souřadnicích se středem v apexu), která se rozděluje na segmenty
odpovídající povodím jednotlivých koronárních tepen (podle mezinárodních doporučení se používá 17
segmentů). Relativní hodnoty perfuze v
jednotlivých segmentech se porovnávají s příslušnými
hodnotmi u normálních pacientů, uloženými v normálové
databázi. Získávají se tím relativní indexy - tzv.
skóre, které pomáhají stanovit závažnost
poruchy perfúze myokardu (a příp.
odpovídající riziko).
Vizuální obrazy a polární mapy se hodnotí u scintigrafie v zátěži
a v klidu. U EKG-hradlovaného SPECT myokardu
můžeme vedle perfúze stanovit i ejekční frakci
levé komory.
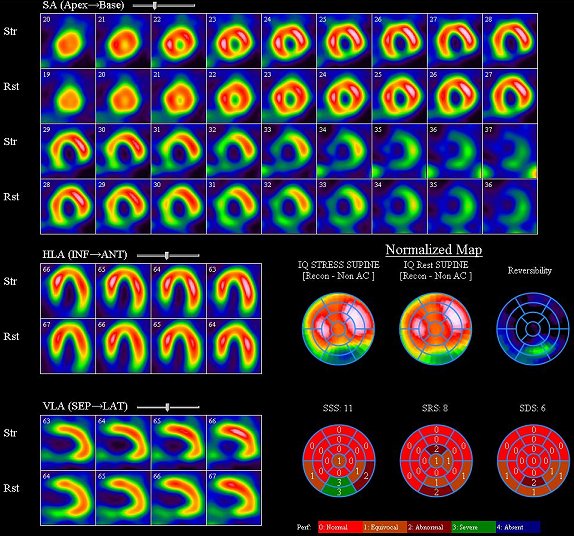 |
Vyhodnocení
zátěžové+klidové scintigrafie perfuze myokardu programem 4DM SPECT. Pozorujeme výrazné snížení perfúze v bazálním segmentu spodní stěny, částečně reverzibilní (plyne ze srovnání polárních map v klidu a zátěži). (scintigrafické
obrázky pořídil |
Metabolické
scintigrafie, zobrazení viability myokardu
Samotná perfúzní scintigrafie (ukazující příp. místa
hypoperfuze), ani analýza celkové a regionální kontraktilní
systolické funkce (či dysfunkce), nemusí být schopna posoudit
zachování životaschopnosti tkáně myokardu, který může
být dočasně hybernován v důsledku hypoperfuze. Pro
posouzení funkce a stavu vlastní tkáně myokardu,
myokardiálních buněk, může být užitečné zobrazit metabolismus
glukózy, mastných kyselin či aminokyselin. Využívá se k
tomu příslušných biochemicky aktivních sloučenin
značených radionuklidy, především pozitronovými izotopy
biogenních prvků. Tyto zobrazovací metody mají schopnost
samostatně (odděleně či simultánně) hodnotit průtok krve a
metabolusmus. Mohou být tak rozpoznány oblasti myokardu se
sníženým průtokem, ale zachovaným metabolismem - zde může
být užitečné provést revaskularizaci.
V klinické praxi se používá PET vyšetření metabolismu
glukózy v myokardu pomocí 18F-FDG (fluorodexyglukóza). Za
normálních okolností dobře perfundovaného viabilního
myokardu získávají myocyty potřebnou energii převážně
beta-oxidací mastných kyselin. Při ischemii se však
jako zdroj energie pro práci srdečních buněk začne
významněji uplatňovat anerobní glykolýza. Po i.v. aplikaci
se 18F-FDG
zvýšeně akumuluje v ischemických, avšak viabilních,
oblastech myokardu, zatímco v normálně perfundovaných
oblastech se neakumuluje (neboť tam se glukóza k získávaní
energie nepoužívá). V neviabilním či nekrotickém myokardu
se FDG rovněž neakumuluje, protože tam metabolismus
neprobíhá vůbec. Srovnáním mezi regionální prokrvením a
metabolismem tak dostáváme informaci o normálním,
hybernovaném a nekrotickém myokardu. V případě ischemických
defektů se zachovanou viabilitou je užitečné
provést revaskularizační oparaci, po které
dochází k "oživení" těchto míst a často i ke
zlepšení kontraktility myokardu a zvýšení celkové srdeční
výkonnosti.
Především pro výzkumné a experimentální
studie se pro posouzení metabolizmu používá zobrazení
distribuce volných značených mastných kyselin
jako jsou deriváty penta- a hexadekanové kyseliny BMIPP
značené 123I pro SPECT. Pro PET je to 11C-palmitát pro metabolismus mastných kyselin a 11C-acetát (který se začleňuje do Krebsova cyklu) pro oxidační metabolismus. ........
Receptorová scintigrafie
myokardu
Šíření vzruchů v myokardu a regulace koronárního průtoku
jsou dány funkcí sympatického nervového systému v srdci.
Tato funkce zavisí m.j. na distribuci receptorů,
především noradrenalinových receptorů. Distribuci těchto
receptorů lze zobrazit pomocí 123I značeného MIBG, který se na ně
váže. ...........
Scintigrafie amyloidózy
myokardu
Amyloidóza *) je systémové onemocnění,
způsobené konformační změnou geometrické struktury
některých původně rozpustných proteinů na nerozpustnou
formu amyolidových fibril, které se mohou deponovat
v intersticiálních oblastech různých tkání a orgánů -
mozek, srdce, ledviny .... To může nepříznivě ovlivňovat
jejich strukturu a fyziologické funkce. ..... ....
*) Tento zavádějící
název (řec. amylon = škrob) vznikl z toho,
že při barvení Lugolovým roztokem se choval podobně jako škrob.
Později však biochemikové ukázali, že amyoloid má chemické
složení proteinů.
Srdeční
amyloidóza je způsobena depozicí nerozpustných
proteinů ve fomě amiloidových fibril v
mezibuněčných prostorách srdečního myokardu. Vede to ke
ztlušťování srdeční stěny a zhoršení její
kontraktility. Nejčastějšími typy srdeční amyloidózy je
amyoloidóza transthyretinového řetězce (TTR) a lehkého
řetězce (AL) proteinů. ......
Účel
:
Je to neinvazivní metoda pro odhalení přítomnosti a
závažnosti depozice nerozpustných amyolidních proteinů
v myokardu, které by mohly být příčinou zhoršení srdeční
funkce (kardiomyopatie). Umožňnuje odlišit TTR amyolidózu od
jiných příčin ztluštění stěn srdeční komory (které je pozorované na echokardiografii).
Radiofarmaka
:
Při planární a SPECT scintigrafii se zde používají osteotropní
radiofarmaka, jako je 99mTc-DPD (99mTc-3,3-diphosphono-1,2-propanodikarboxylová
kyselina), 99mTc-pyrofosfát, nebo 99mTc-HMDP (hydroxy-metylen-difosfonát)
- viz §4.9.7 "Scintigrafie skeletu". Tato radiofarmaka se vychytávají nejen ve
skeletu, ale i v extracelulárním prostoru v myokardu,
zaplněném fibrilami amyolidních proteinů.
Při
PET se používají radioindikátory 18F-florbetapir, 18F-florbetaben a 18F-flutemetamol.
Provedení
:
Po i.v. aplikaci cca 200 MBq radioindikátoru se za zhruba 2 hod.
provádí statická scintigrafie oblasti
hrudníku v projekci AP. Může to být též součástí celotělové
scintigrafie skeletu (srdeční
amyolidóza se někdy může objevit i jako vedlejší nález
při klasické celotělové scintigrafii skeletu). Pro detailnější posouzení anatomické korelace je
vhodné pořídit i scintigrafii SPECT/CT hrudníku.
PET
....
Hodnocení
:
Na scintigrafických obrazech hrudníku posuzujeme, jak
rozdílně se radioofarmakum akumulovalo ve skeletu - v
žeberních kostech - a v myokardu. Přítomnost a
závažnost srdeční amyloidózy se zde často posuzuje pomocí
empirického tzv. Peruginiho skóre :
Perugini score 0:
Osteotropní radiofarmakum se vychytalo pouze ve skeletu,
srdeční myokard se nezobrazuje. Scintigrafie zde nesvědčí
pro srdeční amyloidózu.
Perugini score 1:
Je přítomno vychytávání radiofarmaka v myokardu, ale menší
než v kostech. Je to suspektní nález AL nebo TTR amyloidózy (pro potvrzení nebo vyvrácení je třeba použít
použít endomyokardiální biopsii).
Perugini score 2:
V myokardu se pozoruje stejné nebo větší vychytávání
radiofarmaka než ve skeletu. Je to indicie pro
TTR-amyolidózu.
Perugini score 3:
Je přítomno výrazné vychytávání osteotropního
radiofarmaka ve ztluštěném myokardu, s hodně oslabeným nebo
chybějícím vychytáváním ve skeletu. Vysoce specificky to svědčí
pro TTR-amyolidózu.
Zde jsou ukázky scintigrafických obrazů
hrudníku pro různá skóre amyloidózy (jsou
to starší planární obrázky s nižší kvalitou...) :
 |
PET scintigrafie zatím neukázala výrazný pokrok vůči planární/SPECT scintigrafii. Avšak některé výsledky ukazují u PET s 18F-florbetaben, že snímky získané několik minut po aplikaci by mohly pomoci odlišit AL od TTR amyolidózy..?..
4.9.5. Plicní scintigrafie (nukleární
pneumologie)
Plíce (lat. pulmo,
řec. pneumo) jsou klíčovým
dýchacím orgánem vyšších živočichů a člověka.
Zajišťují výměnu plynů - zvláště
kyslíku a oxidu uhličitého *), mezi krví a vzduchem. Pomocí
řetězce [ventilace plicních alveol ® difuze plynů přes
alveolokapilární membrány ®
perfuze plic ® krevní oběh] se
uskutečňuje transport kyslíku ze vzduchu k
buňkám tkání a orgánů a odvod oxidu uhličitého
z tkání do atmosféry.
*) Hlavním zdrojem energie pro buňky při
metabolismu je oxidace (především glukózy),
při níž vznikají "energetické" molekuly jako je
ATP (adenosintrifosfát), "odpadními" produkty jsou
především voda a oxid uhličitý. Pro fungování metabolismu
je tedy zapotřebí výměny plynů - přísun kyslíku a odvod
oxidu uhličitého. U vyšších organismů tato výměna plynů
nestačí pasívní difuzí, ale uskutečňuje se aktivním
dýcháním (respirací, ventilací) vzduchu z
atmosféry plícemi (u ryb výměnou kyslíku z vody v
žábrách).
Plíce mají houbovitou konzistenci, skládají se
z více než 300 milionů plicních sklípků - alveol,
což jsou drobné duté tenkostěnné váčky (o průměru kolem
150mm).
Jejich stěna - alveolokapilární membrána -
je tvořena jednou vrstvou tenkých buněk, pneumocytů
I.typu (tloušťka stěny je asi 1mm). Celková plocha
alveolokapilární membrány činí asi 60m2. Ve stěně alveol jsou i tlustší pneumocyty
II.typu, které produkují látky snižující povrchové
napětí (surfaltant) a makrofágy, které fagocytují
prach a cizorodé částice.
Dýchací plyny difundují přes membránu alveol
ve směru gradientů tlakových a koncentračních; závisí na
parciálním tlaku těchto plynů ve vdechovaném vzduchu a v
neokysličené krvi proudící v kapilárách kolem alveol.
Kyslík má v odkysličené krvi nižší parciální tlak a
proto přechází přes membránu z alveol do krve. Oxid
uhličitý má ve venózní krvi naopak vyšší parciální tlak
a proto přechází z kapilár přes membránu do vzduchu v
dutinách alveol, odkud je vydýchán.
Anatomicky jsou plíce párovým orgánem
- levá a pravá plíce. Jsou rozčleněné na laloky (3
laloky má pravá plíce, 2 laloky má levá). Laloky jsou dále
rozděleny na bronchopulmonální segmenty, z nichž
každý má vlastní přívod vzduchu i krve.
Vzduch je do plic
přiváděn (a odváděn) průduškami (bronchy),
což jsou trubice s chrupavkovými stěnami, které se uvnitř
plic mnohonásobně větví do čím dál jemnějších trubic,
až k alveolám. Proudění vzduchu v plících - plicní
ventilace - se uskutečňuje střídavým nádechem (inspirium)
a výdechem (expirium). Při nádechu se stahem mezižeberních
svalů a bránice zvětší objem hrudní dutiny a vlivem
podtlaku se do plic nasaje dýchacími cestami nový vzduch. Při
výdechu se pasivním tlakem při smrštění hrudníku použitý
vzduch vyfukuje dýchacími cestami ven do atmosféry.
Krevní oběh plic - plicní perfúze
- začíná plícnicí (arteria pulmonalis),
tepnou vycházející z pravé srdeční komory a
přivádějící neokysličenou krev. V plicích se
mnohonásobně větví až na kapiláry, které
obklopují alveoly. Zde dochází k difuzi kyslíku do krve a
oxidu uhličitého do alveol. Cévy nesoucí okysličenou krev se
spojují v plicní žíly, které ústí do levé srdeční
předsíně. Odtud pak levá komora tlačí okysličenou krev
přes aortu do krevního oběhu, čímž je rozváděna po celém
těle. Odkysličená krev, která je zároveň obohacená oxidem
uhličitým, se pak žilním systémem vede do pravé srdeční
síně, odkud ji pravá komora vrací do plic k dalšímu
okysličení a zbavení CO2 - malý srdeční oběh (plicní,
kardiopulmonální), pokračující do levé síně.
Okysličená krev je pak levou komorou čerpána do velkého
krevního oběhu - systémového. Plicním oběhem protéká
za normálních okolností téměř stejné množství krve jako
systémovým oběhem, avšak pod nižším tlakem.
Patologie plic a
respiračního systému :
Plicní edém
("rozedma") jako důsledek plicní hypertzenze,
zvýšeného tlaku v malém oběhu, selhávání levé komory,
.........
Plicní embolizace představuje
ucpání cév plicního řečiště v důsledku trombózy z
žilního systému nebo pravého srdce. Vede k hypoperfuzi
nebo aperfuzi určitých částí plic. Náhlé ucpání
středních plicních větví se označuje jako plicní infarkt.
Bronchiální astma - spasmus a
konstrikce bronchů spojená s dušností ........
Pneumokonióza je porucha
ventilace způsobená fibrózou v důsledku dlouhodobého
vdechování prachu, např. křemičitého (silikóza),
lidově se jí říká "zaprášení plic".
..............
Zánětlivá a infekční onemocnění,
tuberrkulóza ...........
Nádorová onemocnění -
primární karcinom plic, metastázy jiných nádorů do plic
..............
Pro správné fungování dýchacího systému musejí
být splněny tři základní podmínky: 1.
Dobrá plicní perfuze; 2. Dobrá ventilace
plicních alveol; 3. Správná funkce
alveolární membrány. Na diagnostiku těchto složek
dýchacího systému se zaměřují i metody nukleární
medicíny.
Scintigrafie plicní
perfúze
Účel:
Zobrazení distribuce kapilární perfuze v plicním parenchymu,
odhalení regionálních perfúzních defektů v
důsledku embolizace nebo jiných postižení plicního
arteriálního řečiště (útlaku zánětlivým či nádorovým
ložiskem, pleurálním výpotkem, .....).
Radiofarmaka:
99mTc-MAA (značený makroagregát
albuminu, nebo albuminové mikrosféry).
Provedení:
Po i.v. aplikaci cca 200 MBq radioindikátoru se provádí statická
scintigrafie oblasti plic ve 4-6 projekcích, z nichž
nejdůležitější je PA a AP projekce.
Hodnocení:
Na obrazech vizuálně hodnotíme homogenitu distribuce
radioindikátoru v plicních křídlech a příp. lokální či
segmentární defekty, které by svědčily o hypoperfuzi
v důsledku především embolizace. Lze
provádět i regionální kvantifikaci
relativní perfúze jednotlivých částí a segmentů plic.
Scintigrafie plicní
ventilace
Účel:
Zobrazení distribuce alveolární ventilace plicního
parenchymu, odhalení regionálních defektů ventilace
pro poruchu průchodnosti periferních dýchacích cest - v
důsledku koniózy nebo jiných postižení. Může též
sloužit pro posouzení podílu funkce jednotlivých částí
plic na celkové dýchací funkci (při rozhodování o
operačním výkonu).
Radiofarmaka:
- Inertní radioaktivní plyny: krypton 81mKr,
xenon 133Xe;
- Radioaktivní aerosoly značené 99mTc.
Provedení:
Scintigrafické vyšetření plicní ventilace se může
provádět dvojím způsobem:
- Vdechování radioaktivního aerosolu
Před scintigrafickým vyšetřením plicní ventilace pacient
dýchá cca 10 min. vzduch s aerosolem 99mTc-DTPA
(aktivita v nebulizátoru cca 1000 MBq), jehož částečky se zachycují v alveolách. Pak
střádáme pod kamerou statické obrazy plic v jednotlivých
projekcích.
- Vdechování radioaktivního plynu
Ventilační scintigrafie plic se výhodněji provádí při
vdechování radioaktivního inertního plynu - kryptonu 81mKr (aktivita v generátoru cca 5 GBq), nebo xenonu 133Xe (pokud je k dispozici
příslušná dýchací aparatura, viz níže), při současném
scintigrafickém snímání.
81mKr se
získává z generátoru 81Rb/81mKr. Princip tohoto generátoru je v
levé části obr.... Mateřské rubidium 81Rb je fixováno v pevné fázi v malé kolonce, přes
kterou se pomocí ventilátoru (vzduchového
čerpadla s regulovatelným výkonem) vede proud elučního
vzduchu. Radioaktivním rozpadem rubidia-81 průběžně
uvolňovaný dceřinný plynný krypton 81mKr je unášený procházejícím vzduchem a vedený do dýchací
masky, z níž pacient vdechuje směs vzduchu a
radioaktivního 81mKr. Do obvodu dýchací masky jsou zařazeny jednocestné
ventily, dále je předřazen směšovací ventil
vnějšího vzduchu pro zajištění volného dýchání.
Vydechovaný vzduch se vede do vymírací nádoby (objemu cca 30 litrů), z níž
vzhledem k velmi krátkému poločasu rozpadu 81mKr vychází již
prakticky neradioaktivní vzduch.
Při
tomto vyšetření plicní ventilace se
vdechovaný vzduch se stopovým obsahem radioaktivního 81mKr dostává do plicních
alveol, přičemž emitované záření gama 191keV je
snímáno gamakamerou. Na scintigrafickém
obraze místa se sníženou aktivitou ukazují oblasti plic se zhoršenou
ventilací, kam se krypton-81m, a tím pádem ani
vzduch, nedostává (buď vůbec, nebo sníženě).

Obr.... Generátor 81Rb/81mKr pro
scintigrafii plicní ventilace.
Vlevo: Princip činnosti generátoru. Uprostřed:
Jedno z konstrukčních uspořádání Rb-Kr generátoru. Vpravo:
Rozpadové schéma 81Rb a 81mKr; v černém
poli je scintilační spektrum záření gama 81mKr..
Hodnocení:
Na obrazech vizuálně hodnotíme homogenitu distribuce
radioindikátoru v plicních křídlech a příp. defekty,
které by svědčily o poruchách ventilace v
důsledku např. koniózy. Lze provádět i regionální
kvantifikaci relativní ventilace jednotlivých částí
a segmentů plic.
Dynamická
ventilační scintigrafie plic
je poměrně komplexní metodou pro analýzu dýchací
funkce plic. Dýchání pacienta je napojeno na
uzavřený okruh spirometru, do něhož se
aplikuje cca 300 MBq 133Xe a současně se snímá dynamická scintigrafie plic
v projekci PA.
Podrobnější popis provedení a vyhodnocení dynamické
ventilační scintigrafie je v §3.11b "Dynamická
scintigrafie plic (ventilace 133-Xenon)" knihy OSTNUCLINE. Pro značnou složitost a
intrumentální náročnost metody, jakož i obtížnou
dostupnost 133Xe, se dynamická ventilační scintigrafie již
prakticky neprovádí.
Kombinovaná
perfúzní+ventilační plicní scintigrafie
Pro komplexnější posouzení a diferenciální diagnostiku
plicních patologií je užitečné porovnávat perfúzní i
ventilační statickou scintigrafii a korelovat sobě
odpovídající obrazy v jednotlivých projekcích. Vedle
samostatné plicní perfuze (s 99mTc MAA) a samostatné plicní ventilace (s 99mTc-aerosolem, či s
plynným 81mKr) se tedy často provádí i simultánní
kombinovaná perfuzní+ventilační scintigrafie -
aplikace 99mTc-MAA a pak střídavé vdechování 81mKr, při současné
scintigrafii (s okénkem analyzátoru
nastaveným střídavě na 140keV 99mTc a 190keV 81mKr). Všechny tyto scintigrafie se
provádějí v řadě různých projekcí - základní jsou AP a
PA, dále šikmé LPO, RPO, někdy i bočné LL, RR. Vzniklé
scintigrafické studie pak mají 4, 6, 8, či 12 obrazů.
| Počítačové vyhodnocení multistatické scintigrafie kombinované plicní perfuze a ventilace | |
 |
|
| Vizuální
hodnocení : Při hodnocení scintigrafických obrazů ventilace plic ve všech projekcích pozorujeme homogenní distribuci radioindikátoru v obou plicních křídlech - bez defektu. Na scintigrafických obrazech perfuze plic pozorujeme nehomogenní distribuci radioindikátoru v obou plicních křídlech s několika okrsky hypoperfuze, bez segmentárních defektů Z á v ě r : |
Postup počítačového vyhodnocení perfúzní a ventilační scintigrafie plic je popsán v §3.11a "Statická scintigrafie plic (perfuzní, ventilační)" knihy "OSTNUCLINE".
4.9.6 Scintigrafická diagnostika v
onkologii. Scintigrafie zánětů.
Zobrazení nádorové tkáně
je jedním z nejdůležitějších úkolů scintigrafické
diagnostiky. Slouží jednak pro primární
nádorovou diagnostiku (v kombinaci s ostatními zobrazovacími
metodami), pomáhá v plánování radioterapie,
umožňuje posuzovat odezvu na léčbu a
úspěšnost terapie, při dlouhodobějším sledování pomáhá
včas zjistit příp. recidivu nádorového
onemocnění. Tyto jednotlivé aspekty jsou diskutovány v §3.6
"Radioterapie", část "Diagnostika
nádorových onemocnění".
Ve scintigrafické nádorové diagnostice můžeme použít
následující možnosti :
- Zobrazení nádoru jako defektu ve
funkční tkáni
po aplikaci radiofarmak, která se fyziologicky akumulují ve
zdravé funkční tkáni, avšak v nádorové tkáni se
zachycují málo nebo vůbec. Na scintigramu se pak zobrazí jako
"studená léze" (fotopenická ložiska). Je to metoda nespecifická
(nedá se rozhodnout zda příslušný defekt je způsoben
maligní nebo benigní strukturou) a je poměrně málo
citlivá (studedné léze jsou zobrazovány s menším
kontrastem a hůře se na obrazech rozpoznávají než
"horká" ložiska). Může se sekundárně uplatnit
při scintigrafie jater či ledvin. U scintigrafie plic můžeme
pozorovat lokální snížení nebo výpadky porfuze či
ventilace v důsledku utlačování cév a bronchů plicními
nádory a metastázami. U scintigrafie štítné žlázy
funkční parenchym dobře vychytává radioisotopy jódu a 99mTechnecistan,
zatímco maligní nádory a benigní afunkční adenomy se
zobrazují jako "studené" ložiskové defekty na
pozadí parenchymu (viz scintigrafické
obrázky v §4.9.1 "Thyreologická diagnostika").
- Scintigrafie metabolické aktivity
nádorů
zobrazující změněný (většinou zvýšený) metabolismus
nádorových buněk, nebo nádorovým procesem indukovaný
metabolismus tkání v těsném okolí nádorů. Klasické je
zobrazování štítné žlázy a jejích nádorů na
základě metabolického vychytávání radiojódu 131/123I (§4.9.1
"Thyreologická radionuklidová diagnostika"). Pro gamagrafické zobrazení metabolické
aktivity jiných nádorů se v současné době nejčastěji
používá PET zobrazení distribuce 18F-
fluor-deoxyglukózy (FDG), nebo 18F- 3-fluoro-3-deoxy-thymidinu (FLT), či 18F- fluorocholinu. FDG
se vychytává ve viabilních nádorových buňkách a na rozdíl
od glukózy z buněk nevystupuje, takže poskytuje kontrastní
obrazy viabilních a proliferujících nádorových
lézí. PET zobrazení pomocí 18F-FDG je velmi
přínosné v hematoonkologii při diagnostice lymfomů
a mnohočetných myelomů. Semikvantitastivní
posouzení metabolické aktivity zobrazených ložisek se často
provádí pomocí hodnoty SUV (definované a diskutované výše v §4.1, části
"Kvalita
scintigrafického obrazu - detekovatelnost lézí", pasáž "Kvantifikace
pozitivních lézí na gamagrafických obrazech - SUV"). PET scintigrafii je
vhodné provést v hybridní kombinaci s rentgenovým CT
zobrazením pro získání anatomických obrazů v
korelaci se scintigraficky zobrazenými tumory. Zvýšená
kumulace FDG však není specifická jen pro nádory, může být
i v zánětlivých ložiscích (viz níže
"Scintigrafie zánětů").
 |
Příklad
scintigrafie PET/CT s 18FDG u pacienta s lymfomem. ( PET/CT obrazy
pořídil |
.- Zobrazení nespecifické vazby
radioindikátoru na nádory
Některá radiofarmaka vykazují zvýšené vychytávání v
nádorech a metastázách, přičemž mechanismy těchto
vychytávání nejsou dostatečně známé a nejsou specifické
pro daný druh nádoru. Na vyšší akumulaci se může podílet
zvýšená proliferační a metabolická aktivita nádorových
buněk, nebo zvýšená permeabilita kapilár nádorové
neoangiogeneze. Takovým radiofarmakem je 67Ga-citrát, který jeví zvýšené vychytávání ve
viabilních nádorových tkáních lymfomů, melanomů, karcinomu
plic a při odhalování jejich metastáz. Akumuluje se však i v
zánětlivých lézích (viz níže "Scintigrafie
zánětlivých ložisek").
Velmi důležitou metodou nádorové diagnostiky je scintigrafie
skeletu (viz níže §4.9.7.) pomocí osteotropních
radiofarmak, která umožňuje velmi časné odhalení metastáz
ve skeletu.
- Scintigrafie speciálních
receptorů nádorů
Některé nádory obsahují na buněčných membránách nebo v
cytoplasmě specifické receptory, především pro peptidy.
Pomocí těchto radioaktivně značených peptidů lze
scintigraficky zobrazit koncentraci jejich receptorů a tím
příslušné nádorové ložisko. Využívá se zde např.
zobrazení somatostatinových receptorů u
neuroendrokrinních nádorů, dále karcinomů plic, medulární
karcinom štítné žlázy, karcinoid, ... Používají se
nejčastěji radifarmaka 111In-pentetreoid a 99mTc-depreotid, nebo DOTA preparáty značené 68Ga (PET gamagrafie).
Pro diagnostiku nádorů prostaty se používají značené
ligandy prostatického specifického membránového
antigenu PSMA - 68Ga-PSMA-11, nejnověji 18F-PSMA-1007, v teranostické kombinací s
radionuklidovou terapií (kap.3.6, část "Biologicky
cílená radionuklidová terapie", pasáž
"Karcinom prostaty"). Pro diagnostiku hormonálně závislé ca prsu se
ojediněle používají estrogeny (jako je estradiol) značené 18F nebo 123I.
- Imunoscintigrafie
je založená na vysoce specifickém charakteru imunologických
reakcí antigen-protilátka. Monoklonální protilátka (§3.6, pasáž "Monoklonální protilátky"), označená vhodným
radionuklidem, se po aplikaci selektivně naváže na
příslušný nádorový marker (antigen),
načež scintigrafií můžeme zobrazit příslušný nádor.
........scintigraf. obrázky........
................
Podrobněji "Diagnostika nádorových
onemocnění".....
Scintimamografie
Nejčastěji používanou (screeningovou) metodou nádorové
diagnostiky prsu je rentgenová mamografie (popsaná v
§3.2, pasáž "RTG mamografie"). Pokud je pomocí mamografie nebo jiné
klinické metody nalezen v prsu neurčitý patologický útvar,
může být užitečné provést scintigrafické vyšetření k
upřesnění jeho benigní či maligní povahy. V benigním
případě se tím mohou ušetřit zbytečné biopsie či
chirurgické excize.
Statická scintigrafie prsů - scintimamografie či mamoscintigrafie - slouží k diagnostice
nádorových procesů v oblasti prsů a axilárních uzlin, s možností odlišit maligní a benigní léze prsu.
Používají se radiofarmaka 99mTc-tetrofosmin nebo 99mTc-MIBI, které se vážou do mitochondrií. Po i.v.
aplikaci se provádí planární snímání v levé, pravé a AP
projekci, příp. se provede i zobrazení SPECT.
Tato jednoduchá statická scintigrafie se
hodnotí vizuálním posouzením distribuce radioindikátoru za účelem
odhalení příp. nehomogenit a ložisek zvýšené koncentrace
radioindikátoru, které by svědčily pro malignitu.
...................
obrázek ................
V dignostice karcinomu prsu
se využívá i pozitronová emisní tomografie PET s použitím
vhodných nádorově akumulujících radiofarmak (většinou 18FDG, příp. FLT). Speciálně pro
mamoscintigrafii byly vyvinty jednoúčelové přístroje
PEM-pozitronová emisní mamografie, popsané výše v pasáži
"Pozitronová emisní mamografie (PEM)", které se používají v některých velkých
onkologických centrech.
Sledování
nežádoucích účinků radioterapie a chemoterapie
Scintigrafická diagnostika může být užitečná i při monitorování
funkce zdravých tkání a orgánů v souvislosti s
onkologickou léčbou. Radioterapie působí nejen na cílovou
nádorovou tkáň, ale může nepříznivě ovlivňovat orgány
nacházející se v ozařované oblasti - radiotoxicita.
Systémová chemoterapie má nežádoucí účinky na řadu
tkání a orgánů - chemotoxicita. Pro nekomplikovaný
průběh onkologické léčby je užitečné monitorovat funkci
kritických tkání a orgánů během terapie a po terapii. K
tomu může přispívat i scintigrafická diagnostika jako je
radionuklidová ventrikulografie, perfuze myokardu, dynamická
scintigrafie ledvin.
Scintigrafie
zánětlivých ložisek
Vedle nádorových lézí se scintigrafie uplatňuje i v
diagnostice zánětlivých ložisek. Aktivní
zánět je doprovázen hyperémií, zvýšeným metabolickým
obratem, zmnožením extracelulární tekutiny a migrací
leukocytů do místa zánětu. Při scintigrafii zánětlivých
ložisek se využívá několik postupů :
- Scintigrafie
pomocí 67Ga-citrátu, který se po i.v. aplikaci
nejdříve naváže na cirkulující transferin v plasmě. Vlivem
hyperemie a zvýšené permeability kapilár proniká v
zánětlivém ložisku galium navázané na transportní
bílkovinu do extravaskulárního prostoru a pak je vázáno na
laktoferin a nitrobuněčně vychytáváno v lysosomech
neutrofilních leukocytů. Galium-citrát se však vychytává i
v některých nádorech (jak bylo výše zmíněno).
- Scintigrafie
po aplikaci autologních leukocytů in vitro
značených 99mTc-exametazimem, HMPAO, nebo 111In-oxinem, které pak migrují a zvýšeně se
koncentrují v ložiscích zánětu.
- Scintigrafie
pomocí in vivo značených antigranulocytárních
monoklonálních protilátek, jako jsou 99mTc-sulesomab a 99mTc-besilesomab,
které se vážou na leukocyty. Leukocyty, včetně takto
značených, se ve zvýšené míře koncentrují v místě
probíhajícího zánětu. U těchto monoklonálních protilátek
myšího původu může při opakované aplikaci vzniknout riziko
nežádoucí imunogenicity, která by vedla k falešně
negativním výsledkům (imunitní
anafylaktické reakce jsou u diagnostického použití málo
pravděpodobné vzhledem k nepatrným stopovým množstvím
aplikované látky, na rozdíl od terapeutických aplikací) - je diskutováno v §3.6, pasáž "Monoklonální protilátky").
 |
Scintigram pacientky se zánětem po
TEP levého kolene s použitím radioindikátoru 99mTc-besilesomab. ( scintgrafické obrázky
pořídil |
- Scintigrafie pomocí značených anologů somatostatinu
jako je 111In-pentetreoid
a 99mTc-depreotid.
Vážou se na struktury obsahující somatostatinové receptory -
u zánětů jsou to lymfocyty a makrofágy. Jinak se samozřejmě
kumulují i v některých nádorech (především
neuroendokrinních).
- PET
scintigrafie po aplikaci 18F-fluorodeoxyglukózy (FDG), která se
kumuluje v zánětech v důsledku zvýšeného metabolického
obratu glukózy, který zánět doprovází. FDG se však
vychytává i ve viabilních nádorech - což je hlavní
použití FDG.
- 3-fázová
scintigrafie skeletu u muskuloskeletálních zánětů,
zobrazující m.j. regionální hyperemii
doprovázející osteomyelitidu - infekční
hnisavý zánět kosti a kostní dřeně (viz
níže pasáž "Dynamická (3-fázová) scintigrafie
skeletu" v §4.9.7).
4.9.7. Scintigrafie skeletu
Kosterní systém - skelet - slouží
především jako mechanická opora a vyztužení organismu. Ve
spojení se svaly, které jsou pomocí šlach ke kostem
připojeny, též zprostředkovává pohybovou aktivitu
organismu. Vedle toho některé kosti ve svých dutinách - kostní
dřeni - poskytují prostor pro tkáně krvetvorby.
Kost se skládá z buněk osteoblastů,
osteocytů, osteoklastů, vláknité a amorfní
mezibuněčné hmoty.
Osteoblasty jsou buňky zhruba
krychlového tvaru s četnými výběžky, kterými jsou
vzájemně v kontaktu. V organelách osteoblastů se realizuje látková
výměna kosti. Osteoblasty produkují kolagenní
vlákna a amorfní (proteoglykanovou) mezibuněčnou hmotu.
Produkují též enzymy alkalické fosfatázy, které způsobují
mineralizaci kostní tkáně. Osteoblasty jsou v kosti
přítomny především tam, kde dochází k tvorbě či
přestavbě kostní tkáně. Během vývoje osteoblasty postupně
ztrácejí svoje organely a výběžky a mění se na protáhlé osteocyty.
Osteoklasty jsou
"bourací" buňky větší velikosti, které svou
produkcí kyselé fosfatázy a kolagenázy uvolňují kostní
minerály a rozrušují strukturu kostní hmoty. Tím uvolňují
prostor pro novou tvorbu kosti - napomáhají růstovým
pochodům a remodelaci kosti.
Mezibuněčná kostní hmota je
tvořena svazky kolagenových vláken stmelených amorfní
proteoglykanovou hmotou, která je v hotové kostní tkáni mineralizována.
Minerální složka je tvořena mikroskopickými krystalky fosforečnanu
vápenatého - hydroxyapatitu, jehož
jehličky jsou vázány na kolagenní vlákna. Právě tato mineralizace
přispívá k pevnosti a tvrdosti kosti.
Celkově se kost skládá průměrně z 60%
minerálů, 28% organických látek (z toho asi 4% tuku) a 12%
vody. Snížený obsah minerální složky vede k porézní a
méně pevné kosti - k tzv. osteoporóze.
Patologie skeletu
Nejčastějšími poruchami jsou zde zlomeniny
-fraktury, vznikající mechanickou silou převyšující
mechanickou pevnost kosti (v případě předchozího poškození
kosti, např. osteoporózou, může být patologická
zlomenina vyvolána i malou silou).
Zánětlivá onemocnění kosti - osteomyelitida ....
Degenerativní postižení kostí ....
Nádorové změny kostí mohou být primární,
vycházející z kostní tkáně - osteosarkom, chondrosarkom,
velkobuněčný osteoblastom. Častější jsou však
sekundární nádory - metastázy jiných
nádorů do skeletu; nejčastěji ca prsu nebo prostaty.
Scintigrafická diagnostika
skeletu se zaměřuje především na odhalování patologických
stavů souvisejících se změnami kostního metabolismu.
Má to význam obzvláště v nádorové diagnostice při
včasném zjišťování příp. metastatické infiltrace do
skeletu a při zánětlivých a degenerativních onemocněních
kostí.
Statická scintigrafie
skeletu
Účel:
Jedná se o funkční vyšetření, které zobrazuje distribuci a
změny v metabolismu kostní tkáně a rozložení kostní
přestavby za účelem odhalení patologických procesů
nádorových, zánětlivých či degenerativních.
Radiofarmaka:
Jako osteotropní radiofarmaka se pro
jednofotonovou scintigrafii (planární, SPECT) používají
značené fosfátové komplexy, které se vážou
především na povrch krystalků hydroxiapatitu, částečně
též na kalciumfosfát. Nejčastěji používaným je 99mTc-MDP
(metylendifosfonát), příp. 99mTc-HDP (hydroxymetylendifosfonát - oxidronát). Pro
zobrazení metodou PET se používá 18F-fluorid sodný (NaF), který reaguje
s hydroxiapatitem a ve formě vzniklého fluoroapatitu se
zabudovává do minerální kostní složky.
Provedení:
Po i.v. aplikaci cca 500-800 MBq 99mTc-MDP se radiofarmakum pozvolna akumuluje v metabolicky
funkčních kostech, v závislosti na regionálním prokrvení a
osteoblastické aktivitě kostní tkáně. Scintigrafické
zobrazení se provádí za asi 2-4 hodiny po aplikaci (kdy v krevním řečišti již přetrvává jen cca
5-3% podané aktivity, takže můžeme zístat dostatečně
kontrastní obraz skeletu s nízkým tělovým pozadím). Při použití 18F-fluoridu se aplikuje cca 100-300 MBq a PET zobrazení
se provádí již za 1 hodinu po injekci (fluorid
má rychlejší absorbci v kostech a rychlejší odbourávání
nenavázaného radioindikátoru z krve).
Před vyšetřením se pacient vymočí, aby nahromaděná
aktivita v močovém měchýři nepřezařovala obraz pánevních
kostí. Snímají se planární obrazy buď jednotlivých
částí skeletu ve vhodných projekcích - cílená
scintigrafie, nebo lépe je pořídit nejprve celotělovou
planární scintigrafii v projekci PA a AP s klouzavým
posunem lehátka s pacientem pod kamerou. Planární scintigrafie
může být doplněna o emisní tomografii SPECT
"pozřelých" míst. Při použití 18F-fluoridu se
samozřejmě provádí snímání PET. Pro přesnější
přiřazení zobrazených patologických lézí k anatomickým
strukturám je vhodné provést i rtg zobrazení CT s fúzí
obrazů SPECT/CT nebo PET/CT na hybridních přístrojích; umožňuje to pak upřesnění prostorové lokalizace
aktivních ložisek, zda se léze opravdu nachází ve skeletu a
jak příp. zasahuje mimo kost.
Hodnocení:
Zobrazené rozložení radiofarmaka ve skeletu není
rovnoměrné, ale je dáno regionální vaskularizací a
intenzitou osteogeneze kostní tkáně. V místech s
intenzívnějším metabolismem je vyšší akumulace
radiofarmaka. Fyziologicky jsou to místa s rostoucí kostí u
dětí, obnova kostní tkáně po fraktuře, .......
Patologické změny ve skeletu se obvykle projevují lokálně
zvýšenou akumulací radiofarmaka - "horká
ložiska" osteoblastická, méně často
sníženou akumulací ("studené léze" -
osteolytické procesy bez okolní osteoblastické reakce).
Příznakem patologie též může být celkové difuzní
zvýšení vychytávání radiofarmaka u metabolických
kostních onemocnění, postižení kostní dřeně, či při
generalizované masivní nádorové infiltraci - tzv. "superscan",
nadměrně intenzívní a kontrastní zobrazení skeletu.
Patologický nález na skeletu nedává přímou informaci o
etiologii zvýšené osteoblastické aktivity. Může to být
zánět, poúrazové změny, tumory.
Hlavní význam scintigrafie skeletu je však časné odhalení
nádorových postižení skeletu - primárních, ale především
kostních metastáz. Tato místa, chovající se
jako osteoblastické léze, se zobrazují jako
výrazná ložiska (solitární i vícečetná) zvýšené
akumulace osteotropních radiofarmak. ...........

Normální celotělový scintigram skeletu
Mnohočetné
metastázy (ca prsu) do skeletu
Hodnocení scintigrafie skeletu je v zásadě vizuální, ale lze provádět i kvantitativní analýzu vychytávání radioindikátoru ve vybraných osteoblastických ložiscích (vyjadřuje se např. jako SUV -Standardized Uptake Value) a na základě toho hodnotit vývoj onemocnění a odezvu na léčbu. Postup počítačového vyhodnocení statické scintigrafie skeletu je popsán v §3.12 "Statická scintigrafie skeletu" knihy "OSTNUCLINE".
Dynamická (3-fázová)
scintigrafie skeletu
Účel:
Je to kombinace dynamické a statické scintigrafie vybrané
oblasti skeletu. Slouží k posouzení perfúze kostí a
okolních tkání, k posouzení regionální hyperemie v
důsledku osteomyelitidy, kostních traumat, artritidy, kostních
nádorů, zánětlivých postižení okolních tkání. ....
Provedení:
Po rychlé i.v. aplikaci osteotropního radiofarmaka 99mTc-MDP se okamžitě
spustí dynamická scintigrafie vyšetřované
oblasti. Scintigrafie se provádí ve 3 fázích:
1. Perfúzní (angiografická)
fáze ("flow") snímá regionální prokrvení
sledované části skeletu a okolních tkání, 2sec./snímek po
dobu cca 5 minut.
2. Tkáňová fáze "blood pool"
zachycující přechod radiofarmaka s krevních cest ("blood
poolu") do extracelulárního prostoru měkkých tkání a
kostí. Snímáme asi 10 snímků po 30 sec.
3. Skeletální pozdní fáze
je běžný statický scintigram po 2-3 hodinách, stejný jako u
shora popsané statické scintigrafie skeletu.
Hodnocení:
........................
Postup počítačového vyhodnocení dynamické 3-fázové
scintigrafie skeletu je popsán v §3.13 "Dynamická
(3-fázová) scintigrafie skeletu"
knihy "OSTNUCLINE".
| Počítačové vyhodnocení dynamické 3-fázové scintigrafie skeletu | |
 |
|
| Vizuální
hodnocení : Po intravenózní aplikaci 99m-Tc-difosfonátu pozorujeme v dynamické fázi nejprve dobrou a symetrickou perfuzi stehenních oblastí, levé koleno a tibie vykazuje vykazuje zvýšenou perfuzi s ložisky (patrně peristatické) hyperemie. V dalším průběhu ve skeletní fázi pak pozorujeme ložiska zvýšené akumulace radioindikátoru v hlavičce levé fibuly, v med. kondylu levé tibie a v later. části kolenního kloubu. Z á v ě r : |
4.9.8 Scintigrafická diagnostika v
neurologii - CNS
Centrální nervová soustava (CNS) obratlovců
se skládá z mozku a páteřní míchy. Mozek
(encephalon) je ústřední řídící orgán nervové
soustavy všech vyšších živočichů a člověka. Řídí a
kontroluje většinu tělesných funkcí, jakož i vnímání,
myšlení, paměť, emocionální a kognitivní funkce. U
člověka má mozek objem asi 1500cm3 a váží v průměru 1350gramů. Velmi složité
procesy v mozku, jakožto ústředním orgánu centrální
nervové soustavy, probíhají na několika úrovních. V mozku
se vyskytují především dvě základní skupiny buněk - neurony
a glie.
Neurony, nervové buňky, jsou
základními funkčními jednotkami nervové tkáně. Jsou to
vysoce specializované, plně diferencované efektorové buňky,
které přijímají, přenášejí a zpracovávají speciální
chemicko-elektrické signály (informace), což umožňuje
organismu reagovat na vnější podněty. Ze základní buňky - těla
neuronu (obsahuje jádro) - vycházejí četné
výběžky, tzv. dendrity (kratší výběžky
které jsou dostředivé, přenášejí vzruchy do neuronu) a axony
(dlouhé výběžky které jsou odstředivé, slouží k přenosu
vzruchů ven z neuronu). V membráně neuronů je velké
množství iontových kanálků řízených chemicky a
signálních kanálků řízených elektro-chemicky. Jednotlivé
neutrony jsou pomocí synapsí vzájemně funkčně
pospojovány do složitých neuronových sítí.
Synaptická spojení neuronů, sloužící
k předávání vzruchů, se uskutečňují mezi nervovými
zakončeními jednoho neuronu a vstupní membránou dalšího
neuronu. Synapse mají část presynaptickou, synaptickou
štěrbinu a část postsynaptickou. Vzruch, který
vznikne podrážděním neuronu, se nejprve šíří po axonu ve
formě elektrického náboje. Ze synaptických váčků
v nervovém zakončení - terminálu - se vlivem elektrického
signálu z příslušných prekurzorů vyloučí speciální
chemická látka - neurotransmiter (nervový
mediátor), která způsobí vznik synaptického potenciálu
na dalším neuronu *). Neorotransmitery jsou nízkomolekulární
látky, zajišťující jednosměrný přenos vzruchu z jedné
řídící nervové buňky (presynaptické) do druhé nervové
buňky (řízené, postsynaptické), kterou může být opět
buňka nervová, nebo svalová, popř. žlázová. Tyto látky po
vyloučení z presynaptické buňky difundují synaptickou
štěrbinou k membráně postsynaptické buňky, kde se
vážou na neuroreceptory (systém
"zámek-klíč") a vyvolávají příslušnou
buněčnou odpověď.
*) Přenos vzruchu je elektro-chemický
proces. Elektrický signál - akční potenciál
- putuje zevnitř 1.neuronu přes axon do míst kontaktu
s dendrity 2.neuronu přes synaptickou štěrbinu. Když
zde doputuje akční potenciál, uvolní se chemické látky neurotransmitery,
které po difuzi synaptickou štěrbinou se naváží na
receptory postsynaptické buňky, aktivují se další
postsynaptické receptory, dojde k vytvoření postsynaptického
potenciálu. Součtem většího počtu postsynaptických
potenciálů se vytvoři nový dostatečně vysoký akční
potenciál, který se šíří k dalšímu neuronu.
Je známo asi 10 druhů
neurotransmiterů jako je acetylcholin, dopamin, serotonin, kys.
glutamová, kys. asparágová, glycin, somatostatin, ... Pro
scintigrafickou diagnostiku jsou dostupnné zejména signální
dráhy dopaminu (dopaminergní systém), které jsou
významné pro mozkovou regulaci motorické činnosti.
Po ukončení interakce jsou nenavázané
neurotransmitery aktivně přenášeny ("pumpovány")
zpět do presynaptického terminálu prostřednictvím transportérů
proteinové povahy. V cytosolu neuronu jsou pak buď
katabolizovány, nebo jsou transportovány zpět do synaptických
váčků.
Lidský mozek obsahuje asi 100 miliard (1011) neuronů, mezi
nimiž existuje obrovský počet cca 1015 synaptických spojení. Veškerá vyšší nervová
činnost, i činnost duševní, jsou projevem složitých
biochemických reakcí a elektrických aktivit neuronů v našem
mozku **).
**) Neurony vytvářejí nervové sítě
pomocí protažených "dendritických" výběžků a
axonů, které zajišťují kontakt s ostatními neurony. Tyto
kontakty umožňují elektro-chemickému signálu, putujícímu
přes jednu nervovou buňku, spustit vlnu proudu v dalších
buňkách. Protože se každý neuron může spojit s tisíci
dalšími buňkami - jak blízkými, tak i značně vzdálenými,
mohou takové sítě nabývat obrovského počtu uspořádání a
stupně komplexnosti. Jak ze shluků našich neuronů povstává
vědomí, je zatím zahaleno tajemstvím, ale základní obrysy
těchto mechanismů můžeme chápat již nyní.
Metody "molekulárního zobrazení" v nukleární
medicíně umožňují in vivo zobrazit distribuci a hustotu
receptorů a transmiterů v mozku (viz
níže "Receptorová scintigrafie mozku").
Glie (neuroglie) jsou buňky
mozkové podpůrné tkáně. Největší buňky tohoto druhu jsou
astrocyty (astroglie) které obalují
cévy CNS. Plasmatické astrocyty se nacházejí v šedé hmotě,
fibriální jsou hlavně v bílé hmotě mozku a míchy. Oligodendrocyty
(olygodendroglie) se nacházejí především v bílé hmotě a
produkují myelin - protein který obaluje axony. Epyndimální
buňky tvoří výstelku dutin CNS, v plexus choriedeus
produkují likvor (mozkomíšní mok). Nejmenšími
glyálními buňkami jsou mikroglie s velkým
počtem výběžků, které jako součást
monocyto-makrofágového systému mají obrannou funkci,
schopnost fagocytózy.
Z anatomického hlediska se mozek
skládá z mozkového kmene, který navazuje na
páteřní míchu a pokručuje prodlouženou
míchou, Valorovým mostem (tvořeným příčně
probíhajícími vlákny mozečku), středním
mozkem a nakonec koncovým - velkým mozkem.
Koncový mozek tvoří největší oddíl CNS. Skládá se ze
dvou polokoulí - hemisfér, které jsou
vzájemně spojeny přes corpus callosum. Povrch
hemisfér je tvořen šedou mozkovou kůrou,
tvořenou neurony s četnými dendritickými výběžky, vnitřek
hemisfér obsahuje bílou hmotu ze svazků axonů
neuronů. Hluboko uvnitř hemisfér koncového mozku se nachází
oblast šedé hmoty striatum (corpus striatum),
kde se m.j. formují signélní dráhy ovládání pohybové
aktivity. ...................
Mozkomíšní mok neboli likvor
je čirá bezbarvá tekutina vyplňující dutiny v CNS a mezery
mezi nervovou tkání a obalovými strukturami. Má podobné
složení jako krevní plasma. Vzniká aktivní sekrecí
ependymálními buňkami v plexus choriedeus (ze 70%) a též
filtrací krevní plasmy (30%) chorioidálními kapilárami.
Objem likvoru činí asi 120-200 ml. Cirkuluje přes postranní
komory, hlavní 3. a 4. komoru, obtéká mozkový kmen a míchu.
Mozkomíšní mok zajišťuje optimální homeostatické
prostředí (stálou koncentraci iontů) pro buňky CNS, chrání
mozek před mechanickými otřesy a změnami tlaku a teploty,
metabolicky zajišťuje odsun některých produktů katabolismu a
dodává mozkovým buňkám některé bioaktivní látky.
Cévní zásobení
mozku
Složitá a intenzívní signální činnost mozku je značně
energeticky náročná. Mozek je proto bohatě zásoben
okysličenou krví s živinami (především glukózou), kterou z
levé srdeční komory přivádějí dva páry tepen - arterií.
Většina mozku je zásobována karotidami (arteriae
carotidas internae), mozkový kmen a mozeček je zásobován
přes arteriae vetebralis. ...... Mozkové žíly pak
odvádějí odkysličenou krev do systému splavů (sinusů),
odkud pokračuje do pravého srdce. ............
Vnitřní prostředí mozku je o cévního systému odděleno
tzv. hemato-encefalickoiu bariérou, která
dovoluje jen omezený a selektivní transport látek mezi krví a
mozkovou tkání. ............
Patologie mozku
Nejčastějšími závažnými onemocněními (které mohou vést k nevratnému poškození mozku a
ohrozit i život) jsou zde cévní
poruchy mozku. Mohou být chronické i akutní. Chronické
poruchy vedou k postupnému snižování průtoku cévami
vedoucími krev do jednotlivých částí mozku, což vede k ischemii
a k možnosti snižování funkce příslušných částí. Akutní
cévní poruchy - cévní mozkové příhody
(CMP, iktus, mozkový infarkt, lidově zvané "mozková
mrtvice", angl. stroke) jsou náhlá poškození
mozkové tkáně v důsledku poruchy mozkového krevního oběhu.
Podle mechanismu vzniku se cévní mozkové příhody dělí na
dva druhy:
-> Ischemické
CMP vznikající nedokrevností určité části mozku v
důsledku uzávěru a neprůchodnosti krevních cév,
nejčastěji ucpáním mozkové cévy sraženinou, embolizací do
mozku. Uzávěrem tepny se zastaví přívod krve do
příslušné části mozku, kde buňky bez kyslíku začnou
odumírat - ischemická nekróza (infarkt) mozkové
tkáně. Může to vést k poruše fyzických či psychických
funkcí, které takto postižená část mozku řídí.
Ischemické ikty představují asi 80% všech CMP.
-> Hemoragické
cévní mozkové příhody vznikají v důsledku porušení
stěny mozkové krevní cévy ("prasknutí" některé
cévy uvnitř lebky), což vede k inkrakraniálnímu
krvácení. Může to být intracerebrální
krvácení dovnitř mozkové tkáně - do mozkového parenchymu
(intraparenchymatózní krvácení), nebo krvácení do
komorového systému - subarachnoidální krvácení.
Hemorhagické ikty (představující asi 20% CMP) bývají
zpravidla podstatně závažnější než ischemické. Hematom a
následně edém mozku zvyšují intrakraniální tlak, může
docházet k útisku životně důležitých mozkových center
(dýchání, srdečního rytmu), kompresi cév vedoucí k
celkové hypoperfúzi až k uzávěru průtoku mozkovými cévami
- aperfúzi a smrti mozku.
Klinické následky cévní mozkové příhody
(pokud se přežije akutní fáze) závisejí na druhu, rozsahu a
lokalizaci postižení mozkové tkáně. Bývá to jednostranné
ochrnutí končetin, poruchy řeči, změny psychiky. Mohou být
trvalé, nebo se (příp. za pomoci
rehabilitace) mohou částečně upravit.
Jedním druhem ischemické CMP je tzv. tranzitorní
ischemická ataka (TIA), při které příznaky trvají
několik minut až hodin a pak spontánně vymizí.
Degenerativní onemocnění mozku
jsou způsobeny postupným zánikem většího počtu určitých
mozkových buněk (demence, Alzheimerova choroba), nebo
změnami v distribuci signálních mediátorů
(neurotransmiterů) jako je dopamin
(hyperkineticko-hypomotorická Parkinsonova choroba,
hypotonicko-hypermotorická Hungtingtonova choroba).
Dále je to epilepsie - porucha vzniku vzruchů v mozkové
kůře, vedoucí k záchvatům křečí nebo dočasné ztráty
vědomí. Na subtilnější úrovni vyšší nervové činnosti
se vyskytují psychické poruchy jako je schizofrenie,
deprese, halucinace, ...
Závažnými onemocněními jsou mozkové
nádory. Buď jsou to nádory primární,
vycházející z mozkové tkáně, nebo sekundární mozkové
metastázy, zanesené do mozku z maligního nádoru jinde v
těle. Primární nádory, vycházející z vlastní mozkové
tkáně (intrinsické) jsou nejčastěji gliomy,
vycházejí z buněk glie. Astrocytom je
částečně diferencovaný, avšak může se zvrhnout v
anaplastický glioblastom. Primárně může
vzniknout vysoce maligní multifokální glioblastom.
Vyskytují se i benigní mozkové nádory, např. oligodendrogliom
a ependymom.
Nádory z neuronů jsou vzácné, protože
tyto buňky se prakticky nedělí. V raném dětském věku se vyskytuje neuroblastom,
vznikající maligním zvratem nezralých nervových buněk.
Nukleární medicína
poskytuje několik metod scintigrafické diagnostiky mozku - jeho
regionálního prokrvení, funkčního zobrazení a metabolismu,
distribuci a hustoty receptorů a transportérů synaptických
systémů v CNS, vyhledávání nádorových ložisek, mapování
likvorových prostorů.
Statická scintigrafie
mozku pro zjištění narušení hematoencefalické bariéry
Účel: Prokázat ložiskové narušení hematoencefalické
bariéry v souvislosti s mozkovým nádorem nebo s vaskulární
lézí. Radioindikátor z cévního řečiště částečně
prochází přes narušenou hematoencefalickou bariéru a
hromadí se v patologické tkáni, která se pak na scintigramu
zobrazuje jako oblast zvýšené aktivity na pozadí nízké
aktivity hemisfér (kam za normálních okolností
radioindikátor neproniká).
Radiofarmaka:
Používá se prostý 99mTc-pertechnetát, nebo výhodněji 99mTc-DTPA
(poskytuje kontrastnější zobrazení ...).
Provedení: Za asi 1 hodinu po i.v. aplikaci radiofarmaka se na
gamakameře snímají statické scintigramy oblasti mozku ve 4
základních projekcích (AP, PA, DX, SIN), někdy i v projekci
vertex. Další možností je snímání pomocí metody SPECT,
která poskytuje možnosti lepšího pohledu na mozkové
struktury. Lze příp. kombinovat s níže popsanou dynamickou
perfúzní scintigrafií mozku: radioindikátor ve formě bolusu
aplikujeme přímo pod kamerou, v projekci AP spustíme
dynamickou scintigrafii, následně pak pořídíme statické
obrazy v potřebných projekcích.
Hodnocení: Na scintigrafických obrazech v různých projekcích,
či řezech SPECT, se hledají ložiska zvýšené depozice
radioindikátoru, svědčící o průniku z cév přes porušenou
hematoencefalickou bariéru do mozkové tkáně.
 |
Rozsáhlá ložisková léze
meningeomu falcis cerebris - levá bočná a přední projekce. (pořízeno kamerou PhoGamma na přístroji CLINCOM v r.1974) |
Perfúzní scintigrafie mozku
Dostatečné prokrvení mozkových struktur je jednou ze
základních podmínek správné mozkové funkce. Scintigrafické
metody umožňují neinvazivní diagnostiku perfúze mozku,
zobrazení její symetrie či regionálních defektů v perfúzi.
Dynamická scintigrafie perfuze mozku (angiografie mozku, mozková
cirkulografie)
Účel: Zobrazujeme dynamiku průtoku krve - mozkovou
cirkulaci - karotidami, hemisférami, zadní jámou a
posuzujeme příp. asymetrie které mohou souviset s obstrukcí
a vést k ischemii. Na scintigramech můžeme
též zobrazit meningeom, krvácení, chron. subdurální
hematom. ......
Radiofarmaka:
Používá se prostý 99mTc-pertechnetát, nebo výhodněji 99mTc-DTPA
(poskytuje kontrastnější zobrazení ...).
Provedení: Detektor kamery se nastaví nad kranium v AP-projekci
tak, aby sagitální rovina byla přesně kolmá k rovině
detektoru. Spojnice nasus-meatus ac.ext. probíhá vertikálně.
Po i.v. aplikaci cca 500MBq radioindikátoru se okamžitě
spustí akvizice rychlé dynamické scintigrafie cca 100 snímků
po 0,5sec./snímek. Následně ještě příp. statický snímek
v trvání 2min.
Vyhodnocení:
Při vizuálním sledování sekvenčních
snímků můžeme rozpoznat příp. okluzi velkých mozkových
cév. Na obrazech časné arteriální fáze a pozdní
arteriální fáze lze posuzovat perfuzi mozkových hemisfér,
především větší výpadky v regionální mozkové perfúzi.
Pro detilnější hodnocení se použijí křivky průtoku z ROI
levé a pravé hemisféry (ROI musí být vymezeny přísně
symetricky a standardizovaným způsobem, s příp. použitím
statického snímku). Za normálních okolností musí mít tyto cirkulační
křivky identický průběh se strmým nárustem,
brzkým dosažením vrcholu a pak zpočátku rychlým poklesem, s
následnou recirkulací. Jednostranné posunutí vrcholu (k
delšímu času) a snížení amplitudy křivky ukazují na
relativní snížení perfúze příslušné
hemisféry. Snížení amplitudy křivky ukazuje na narušení
průtoku velkými cévami nebo snížení intenzity průtoku v
kapilární fázi, opoždění nástupu vrcholu perfúzní
křivky nastává při zásobení postižené hemisféry
kolaterálním oběhem. Lze též provést kvantifikaci křivek
za účelem porovnání perfuze obou hemisfér. Z integrálů
křivek od příchodu aktivity do prvního maxima je počítán
index relativního průtoku levou a pravou hemisférou
(normální rozmezí indexu je ca 0,9 - 1,1).
| Počítačové vyhodnocení dynamické scintigrafie perfúze mozku | |
 |
|
| Vizuální
hodnocení : Po intravenózní aplikaci 99m-Tc na scintigrafických obrazech průchodu bolusu mozkovou cirkulací pozorujeme dobrou a symetrickou perfuzi obou mozkových hemisfér, bez okluze velkých mozkových cév. Z á v ě r : |
|
 |
Asymetrické
cirkulační křivky v patologickém případě výrazně
snížené perfúze pravé hemisféry při okluzi pravé
art.carotis int. (bylo vyhodnoceno na přístroji GAMMA-11) |
Postup počítačového vyhodnocení dynamické
scintigrafie perfuze mozku je popsán v §3.8 "Dynamická
scintigrafie perfuze mozku" knihy
"OSTNUCLINE". Nyní je tato metoda nahrazena
dokonalejší statickou SPECT scintigrafií mozku s použitím
lipofilních radiofarmak:
Statická SPECT
scintigrafie perfuze mozku
Účel:
Zobrazení regionální perfúze mozku a funkčních projevů
mozkové tkáně přes perfúzi. Mapuje viabilitu nervových
buněk, intenzitu regionálního metabolismu. Umožňuje posoudit
ischemii, u cévní mozkové příhody pomáhá
rozlišit mezi ischemickou (způsobenou
embolickým, většinou trombotickým, uzávěrem arterie nebo
arterioly) a hemoragickou (způsobenou krvácením intracerebrálním nebo
subarachnoidálním) cévní příhodou,
lze získat informace o cerebrovaskulární rezervě.
Metoda prokázání snížené perfuze je užitečná i pro
diferenciální diagnostiku demencí.
Radiofarmaka:
Lipofilní radiofarmaka - 99mTc-HMPAO
(hexamethylpropylenaminoxin), 99mTc-ECD (ethylcysteinatdimer, zvaný
též bicisát), popř. 123I-isopropyl-p-iodomfetamin.
Provedení:
Před aplikací necháme pacienta zklidnit
v tichu a ztlumeném světle se zavřenýma očima, po asi 20min.
se i.v. aplikuje cca 700MBq radioindikátoru. Pak se provede
snímání SPECT scintigrafie oblasti hlavy. Vyšetření lze
dělat za nativních podmínek, nebo - pro získání informace o
cerebrovaskulární rezervní kapacitě (CVRC) - po
zátěži aplikací acetazolamidu či vdechováním CO2.
Hodnocení:
Lipofilní radiofarmaka prostupují neporušenou (intaktní)
hematoencefalickou bariérou a fixují se do mozkových buněk
přímo úměrně regionálnímu krevnímu průtoku (rCBF - regional Celebral Blood Flow) a
funkci (vitalitě) neuronů. Po vstupu do mozkových buněk
ztrácí radiofarmakum svůj lipofilní chrakter a váže se v
polární sloučenině, což zabraňuje jeho zpětné difuzi z
buněk a redistribuci; fixují se tím perfúzní poměry které
byly v době aplikace.
Při rekonstrukci
SPECT zobrazujeme řezy transverzální, sagitální a
koronární, na nichž vizuálně posuzujeme
distribuci radiofarmaka, která je úměrná regionální
perfúzi. Posuzujeme oblasti snížené akumulace
radiofarmaka, která může být důsledkem snížené
perfúze, nebo neuronální dysfunkce
mozkových buněk. Kromě vizuálního hodnocení lze provést i semikvantitativní
hodnocení pomocí číselných poměrů akumulace
radioindikátoru ve vhodných oblastech zájmu (ROI) oproti sobě
a vzhledem k tkáňovému pozadí, v porovnání s obrazy
vytvořenými v normálové databázi.
Výrazný perfúzní defekt
se pozoruje zvláště při ischemické cévní mozkové
příhodě v té oblasti mozku, která je zásobena z arterie
postižené embolickým uzávěrem . U
hemoragických mozkových příhod se pozoruje ložiskové
snížení akumulace radiofarmaka v postižené oblasti,
způsobené destrukcí okolní mozkové tkáně krvácením.
Oboustranná hypoperfúze zadních částí kůry hemisfér se
projevuje u Alzheimerovy choroby, zatímco u jiných druhů
primární či sekundární demence se nepozoruje. U vaskulární
multiinfarktové demence se zobrazují vícečetná ložiska
snížené perfúze v mozkové kůře jedné nebo obou hemisfér.
Anomálie regionálního průtoku krve se pozorují i u řady
dalších onemocnění CNS a psychických poruch. Celková aperfúze
hemisfér, mozečku a mozkového kmene je spolehlivou metodou průkazu
mozkové smrti.
Pokud byla provedena scintigrafie se zátěží
(např. vdechováním CO2),
porovnáváme perfúní obrazy v sobě odpovídajících řezech
a hledáme rozdíly v depozici radiofarmaka na scintigramech po
zátěži a nativních. Po zátěži se zvýší průtok
nepostiženým cévním řečištěm v mozku, zatímco cévy s
aterosklerotickým zúžením nejsou schopny reagovat dilatací -
nemají potřebnou cerebrovaskulární rezervní kapacitu
CVRC. Při porovnání obrazů pak za těchto patologických
okolností pozorujeme snížení akumulace
radiofarmaka v povodí postižených cév ve srovnání se
zdravou tkání (jak je níže vidět v
pravé polovině obrázku: nativní scintigram je prakticky
normální, avšak na obraze po zátěži CO2 se objevuje relativní hypoperfuze parietálně vpravo
jako důsledek snížení CVRC). Informace
o CVRC je užitečná u stenózy některé z hlavních větví
arteriálního mozkového řečiště, pro posouzení účelnosti
angiochirurgického řešení.
 |
|||||
|
|
|
|||
| (scintigrafické obrázky transverzálních řezů pořídil MUDr. P.Širůček, PhD., KNM FN Ostrava) |
Scintigrafie
amyloidózy mozku
Amyloidóza *) je systémové onemocnění, způsobené
konformační změnou geometrické struktury některých
původně rozpustných proteinů na nerozpustnou formu amyolidových
fibril, které se mohou deponovat v
intersticiálních oblastech různých tkání a orgánů -
mozek, srdce, ledviny .... To může nepříznivě ovlivňovat
jejich strukturu a fyziologické funkce.
U mozku se jedná o lokalizovanou b-amyloidózu u
některých neurodegenerativních onemocnění a obecně u
starších osob. b-amyoloidy mohou vytvářet extracelulární agregáty -
plaky- fibrilárního amyloidu. Hromadí se v šedé
kůře mozkové (především ve II. a III.
vrstvě). Neuritické plaky mohou
deformovat a poškozovat neurony a jejich synaptické
vazby. Může to vést k inhibici vyšší nervové činnosti,
snížení kognitivních funkcí - degenerativnímu onemocnění
CNS.
Účel :
Scintigrafická vizualizace amyloidózy -
zobrazení depozice amyloidních plaků v mozku.
Používá se především u degenerativních onemocnění CNS
jako je Alzheimerova choroba ...
Radiofarmaka :
Používají se 18F-značené polyetylelenglykol stilbenové deriváty
8F-
Florbetaben, 18F- Flutemetamol, 18F- Florbetapir, které mají vysokou specifickou afinitu
pro beta-amyloidní plaky (lze jej použít též u amyloidózy myokardu).
Provedení :
Intravenózní aplikace cca 200 MBq radiofarmaka. PET/CT akvizice
se pořizuje za 90 min. po aplikaci, poloha na zádech s hlavou v
zorném poli kamery. Trvání akvizice cca 20 minut.
Hodnocení :
Vizuální hodnocení PET obrazů. Za fyziologickou se považuje
pouze akumulace v bílé hmotě. Při patologickém nálezu se
zobrazuje zvýšená aktivita v korových oblastech (frontální
laloky a přední cingulum, laterální temporální laloky,
precuneus se zadním cingulem a temporoparietální kůra) nebo ve striatu. Porovnává se aktivita v
kortikální šedé a sousední bílé hmotě. Pro
anatomicko-fyziologickou korelaci je vhodné použít fúze s
obrazy CT, příp. i MR (pokud jsou k
dispozici).
Validita PET
scintigrafie amyolidózy?
V experimentálních studiích ani v klinickém použití nebyly
nalezeny přesvědčivé vazby mezi depozity mozkového amyloidu
a demencí. U mnoho kognitivně
normálních lidí byla nalezena významná depozita amyloidu
v mozku. A též naopak, absence
amyloidu u osob diagnostikovaných s Alzheimerovou demencí.
PET scintigrafie mozkové amyloidózy tedy
nemůže sloužit k diagnostické verifikaci degenerativních
chorob CNS, ale může přispět k diferenciální diagnostice
jejich příčin.
PET scintigrafie mozkové
amyloidózy se indikuje poměrně zřídka. Neumožňuje přímou
diagnózu kognitivních poruch, terapeutický výstup je
neurčitý...
Scintigrafie receptorových systémů mozku
Scintigrafické metody "molekulárního
zobrazení" v nukleární medicíně, jako jediné
ze zobrazovacích metod, umožňují in vivo zobrazit distribuci
a hustotu neuronových receptorů a transportérů v mozku.
Klinicky se využívá především pro vyšetření
dopaminového systému:
Scintigrafie
dopaminergního systému v mozku
Účel:
Jedná se o zobrazení distribuce a intenzity signálních drah
dopaminových neurotransmiterů - dopaminergního
systému. Zobrazení pre- nebo postsympatické části
dopaminergního nigrostriatálního systému slouží k
diferenciální diagnostice onemocnění vedoucích k poruchám
motorických funkcí, především Parkinsonova
onemocnění, třesů a demencí.
Parkinsonův syndrom, projevující se
progredujícím snížením rychlosti pohybů, svalovou rigititou
a třesem, je převážně zapříčiněn poruchou
dopaminergní funkce striata v důsledku zániku
příslušných neuronů, která vede k poruše funkce
zpětnovazebních extrapyrimidových okruhů.
Radiofarmaka:
Pro presynaptické zobrazení se používají
radioligandy s vazbou na dopaminový transportér, především 123I-ioflupane
- analog kokainu, který se váže na presynaptické přenašeče
dopaminu (obchodní název DatScan;
méně časté alternativní přípravky jsou iometopane - Dopascan,
123I-IPT, 99mTc-TRODAT, 99mTc-TECHNEPINE).
Pro postsynaptické zobrazení slouží
radioligandy s vazbou na dopaminový receptor R2, především 123I-IBZM
- iodobenzamid (popř. 123I-epidepride, 123I-IBF, 123I-iodolisurid). Pro PET zobrazení narušení dopaninergní cesty pak 18F-DOPA
(L-dopa).
Provedení:
Před vyšetřením je nutno zablokovat akumulaci volného jódu
ve štítné žláze. Po i.v. aplikaci cca 150-200 MBq
radioindikátoru se za asi 3 hodiny pořídí SPECT scintigrafie
mozku.
Hodnocení:
Při rekonstrukci SPECT zobrazujeme řezy vedené přes oblast striatum,
na kterých posuzujeme akumulaci radioindikátoru,
zachycujících hustotu dopaminových transportérů či
receptorů. Vychytávání radioligandu se hodnotí zpravidla vizuálně,
avšak lze provést i semikvantitativní hodnocení
pomocí poměrů akumulace radioindikátoru v oblastech zájmu
(ROI) putaminu a kaudatu oproti tkáňovému pozadí. Některé
softwary umožňují i porovnávání s databázemi
normálových pacientů a stanovení určitých score
- dohodnutých kvantitativních parametrů (indexů)
usnadňujících rozhodnutí mezi normálním a patologickým
nálezem. Konkrétní interpretace scintigramů závisí na
použitém radioindikátoru:
Při vyšetření presynaptické části
dopaminergního systému se mapuje vazba radioindikátoru (např.
123I-ioflupanu)
na dopaminové transportéry - proteiny na membráně
presynaptických zakončení nitrostritiálních neuronů, které
zpětně resorbují dopamin ze synaptické štěrbiny. S úbytkem
příslušných neuronů souvisí snížení hustoty souvisí
snížení hustoty presynaptických transportérů. Po aplikaci
presynaptického ligandu, který se váže na dopaminové
transportéry, hodnotíme akumulaci radioindikátoru v
presynaptických zakončeních ve striatu. Při normálním
nálezu se zobrazují dvě symetrické měsíčkovité útvary
striata stejné intenzity. U Parkinsonovy choroby je redukována
vazba ligandů na striatové dopaminové transportéry.
Patologické nálezy jsou buď asymetrické, nebo vykazují
sníženou akumulaci radiofarmaka. Pokles striatické aktivity
koreluje se závažností Parkinsonovy choroby (jejím trváním
a psychosomatickýmn postižením). Scintigrafie presynaptického
dopaminergního systému je senzitivní i v časných stádiích
Parkinsonova onemocnění.
Při vyšetření postsynaptické části
dopaminergního systému se mapuje vazba ligandu (např. 123I-IBZM) na
dopaminové receptory D2, umístěné na membráně
postsympatických dopaminergních neuronů ve striatu. U
Parkinsonismu tyto receptory zůstávají nepoškozené, zatímco
u všech ostatních neurodegenerativních onemocnění (včetně
sekundárních Parkinsonovských syndromů) jsou tyto
postsynaptické D2 receptory poškozené nebo zablokované;
dopaminergní léčba je proto u nich neúčinná.
U Parkinsonova syndromu je typicky na presynaptickém obraze (s 123I-ioflupanem)
snížená či nesymetrická akumulace v oblasti striata a
přitom na postsynaptickém obraze (s 123I-IBZM) normální distribuce - viz prostřední a
pravý obrázek:
| 123I-ioflupane | 123I-ioflupane | 123I-IBZM |
 |
||
| fyziologický Parkinson syndrom 2. stupně | ||
| Normální
a patologické obrazy s 123I-ioflupane a s 123I-IBZM (scintigrafické obrázky pořídil MUDr. M.Havel, PhD., KNM FN Ostrava) |
||
Vedle dopaminergního systému se
pro účely neurologie, především výzkumné a
experimentální studie, občas používá radionuklidová
receptorová diagnostika i dalších neurotramisních
signárních drah CNS:
-
GABA systém
působí jako inhibiční mediátor v mozku. Zobrazení míry
vazby příslušných ligandů (123I-iomazenil, 11C-flumazenil) může pomoci nalézt epileptická ložiska, dále
též zobrazit mozkové nádory gliomy.
-
Opioidní systém
má význam pro vnímání a ovlivňování bolesti, interaguje s
dopaminovými a acetylcholinovými receptory. Scintigrafie
pomocí radioindikátorů (123I-iodomorphin, 11C-carfentanil) se zkouší u schzofrenie a některých typů
epilepsie.
-
Serotoninový
systém se podílí na řízení spánku a některých
neurologických a psychických činností. Zobrazení
presynaptických transportérů (pomocí 123I-beta-CIT, 11C-beta-CIT) a serotoninových receptorů (pomocí
123I-8-hydroxy-PAT) lze použít u Alzheimerovy choroby, depresí,
schizofrenie, Parkinsonismu, částečných epilepsií.
-
Cholinergní systém
se účastní paměti, kognitivních funkcí, soustředění;
jeho poruchy mohou naopak vést k demenci. Zobrazení
presynaptických acetylcholinových transportérů (pomocí značených derivátů
2-(4-phenyl-1-piperidyl)cyclohexan-1-ol - vesamicol) a postsynaptických receptorů (pomocí
indikátorů 11C-nikotin nebo muskarinových 11C-metylbenztropin, 123I-IQNB) může prokázat ztrátu
cholinergních receptorů u demencí (Alzheimorovy, Pickovy).
-
Histaminový systém -
změna distribuce a hustoty receptorů se projevuje u některých
psychóz, u depresí. .....
Metabolické
scintigrafie mozku
Účel:
Funkce mozkové tkáně je závislá na
přívodu kyslíku a dodávce glukózy, což je zdrojem energie.
Tato dodávka se děje krevní cestou. Snížení tohoto
zásobení - ischemie - způsobuje pokles energetických
molekul potřebných k biologickým a informačním funkcím
mozkových buněk. S použitím příslušných radioindikátorů
můžeme vyšetřovat regionální utilizaci kyslíku,
regionální metabolismus glukózy, nebo regionální změny
transportu aminokyselin a rychlosti syntézy proteinů. Vedle
výzkumných a experimentálních studií to má význam i pro
klinickou diagnostiku narušení krevního průtoku, snížení
funkce nebo ztráty viability mozkových buněk. ............
Radiofarmaka,
provedení, hodnocení:
Používají se téměř výhradně pozitronová radiofarmaka,
scintigrafie se provádí na PET kameře. Pro vyšetření
regionální utilizace kyslíku se vdechuje
plynný kyslík 15O až do dosažení rovnováhy mezi 15O v hemoglobinu a
kyslíkem tkáňovým. V metabolicky aktivních částech mozku
vzniká z 15O-oxihemoglobinu radioaktivní voda H215O,
jejíž aktivita je za rovnovážného stavu závislá na
regionálním průtoku a regionální kyslíkové sxtrakční
frakci (rOEF). Lze konfrontovat s vyšetřením regionálního
krevního průtoku rCBF.
Pro vyšetření metabolismu glukózy se
používá i.v. aplikace 18F-FDG (fluordeoxyglokóza). Po vstupu do buněk je FDG
fosforylována jako normální glukóza, avšak její další
metabolismus je blokován .....
Pro metabolismus aminokyselin a proteinů se
používá 11C-methionin.
Statická
scintigrafie likvorových cest
Účel: Sledování pohybu a cirkulace likvoru
v intraniálním subarachnoidálním prostoru za účelem
posouzení průchodnosti likvorových cest, odhalení příp.
likvorových píštělí, dif. diagnostiky komunikujícího a
obstrukčního hydrocefalu.
Radiofarmaka:
Nejčastěji se používá 111In-DTPA (popř. 169Yb-DTPA nebo 99mTc-DTPA).
Provedení: Po intratekální aplikaci (lumbální punkcí) cca
30-50 MBq radioindikátoru snímkujeme oblast hlavy za 5 hod. a
za 24 hod. (popř. i za 48 hod.) v projekcích AP, DX, SIN. Při
podezření na likvorové píštěle - komunikace likvorových
prostorů se zevním prostředím, vložíme za cca 6-8 hod. po
alikaci tampony do nosních průduchů či do zevních
zvukovodů; za 24 hod. je vytáhneme a změříme jejich aktivitu
ve studnovém scintilačním detektoru.
Hodnocení: .......je podrobněji popsáno v §3.18 "Radionuklidová
cisternografie" knihy
"OSTNUCLINE". .........................
| Vyhodnocení statické scintigrafie likvorových cest - radionuklidové cisternografie | |
 |
|
| Vizuální
hodnocení : Po intratekální aplikaci 111-In-DTPA na scintigramech za 5 hodin pozorujeme přítomnost radioindikátoru v bazálních cisternách, v subarachnoidálním prostoru nad konvexitami hemisfér dosahuje asi do poloviny výšky symetricky. Pozorujeme lehčí reflux do komor. Na scintigramech za 24 hod. po alikaci dosahuje radioindikátor v subarachnoidálním prostoru v pravo do poloviny výšky hemisféry a vlevo lehce výše. Část radioaktivity se nachází v postranních komorách. Měřením radioaktivity nosních longet nebyla zjištěna její zvýšená úroveň. Z á v ě r : |
4.9.9 Vyšetření žilního a lymfatického
systému - radionuklidová flebografie a lymfoscintigrafie;
Sentinelové uzliny. Scintigrafie značených krevních
elementů.
Žilní systém
Krevní oběhová soustava je tvořena tepnami, žilami a
krevními vlásečnicemi. Žíly (lat. vena , řec. flebos.) jsou
cévy odvádějící částečně odkysličenou krev, prošlou
systémovým oběhem, zpět do srdce - a pak opět do plic k
dalšímu okysličení. ...........
Patologie žilního systému: Častým
onemocněním.žil je zhoršení průtoku krve - žilní
infuficience. V žilách se vytvářejí varixy, krevní
sraženiny - trombózy. Projevuje se otoky, záněty, u dolních
končetin v závažných případech vznikají bércové vředy.
...................
Lymfatický systém
Vedle krve proudí v organismu i lymfa (míza)
- nažloutlá tekutina podobná krevní plasmě, která je
vytvářená v mezibuněčném prostoru z tkáňového moku.
Část této tekutiny je spolu s metabolity produkována
buňkami. Další část pochází z krevních kapilár, jejichž
stěna je částečně permeabilní pro krevní plasmu. Tato
intersticiální tekutina mezi buňkami zprostředkovává
výměnu kyslíku, oxidu uhličitého, přívod živin a odvod
metabolitů. Z intersticiálního prostoru je lymfa odváděna
najprve kapilárami, které se spojují v mízní
cévy. Lymfatické cévy se nakonec spojijí do dvou
mízovodů, které ústí do krevního řečiště.
Lymfatické cesty vedou přes lymfatické
uzliny, které slouží k filtraci a nakupením lymfocytů a
makrofágů se významně podílejí na imunitě
(obranyschopnosti) organismu, zabraňují postupu infekce.
Patologie lymfatického systému: Lymfatické
cesty bývají postiženy záněty, včetně zánětu mízních
uzlin, projevující se zduřením. K narušení lymfatických
cest - insuficienci či zablokování - může docházet v
důsledu poranění, při operacích, radioterapii, zánětech a
infekcích, nádorových procesech. Není-li dostatečně
odváděna lymfa z tkání, vzniká zde otok zvaný lymfedém.
Závažným nádorovým onemocněním lymfatického systému
(mízních uzlin) je maligní lymfom (o jeho terapii v
nukleární medicíně je zmínka v §3.6, pasáž "Radioisotopová terapie").
Pozn.: Radionuklidová
flebografie bývá z klinického hlediska zařazovaná většinou
do skupiny vyšetření srdce a cév. Zde jsme ji zařadili do
samostatmé podkapitoly společně s lymfoscintigrafií - pro
podobnosti systémové, scintigrafické techniky, získávaných
obrázků a lokalizaci většinou na dolní končetiny.
Radionuklidová
flebografie
Účel: Posouzení průchodnosti žil pomocí
zobrazení průtoku radiofarmaka žilním systémen končetin (nebo i žilami trupu),
nejčastěji při otocích které by mohly být způsobeny
zhoršeným žilním odtokem, flebotrombotickým postižením. Po
i.v. aplikaci radioindikátoru do periferní žíly končetiny
zobrazujeme průtok radiofarmaka žilním systémem. Po průtoku
žilním systémen se následně radiofarmakum MAA zachytí v
kapilárním řečišti plic, kde můžeme scintigraficky
zobrazit příp. embolizaci.
Radiofarmakum:
99mTc-
makroagregáty albuminu MAA . ......................
Provedení:
Často se provádějí dvě následná scintigrafická
vyšetření při aplikaci radiofarmaka se zataženými a
uvolněnými škrtidly (tvořenými
gumovými pásky) pro odlišení průtoku a
plnění hlubokého a povrchového venózního systému.
Dolní končetiny: Aplikace 99mTc-MAA do žíly na dorzu nohy při zatažených
škrtidlech nad kotníkem a pod kolenem. Provede se
scintigrafické zobrazení průtoku radioindikátoru žilním
systémem až do úrovně dolní duté žíly. Po uvolnění
škrtidel se opakuje aplikace radiofarmaka a zobrazení průtoku
žilním systémem.
Horní končetiny: Aplikace 99mTc-MAA do žíly na dorzu ruky, scintigrafické
zobrazení průtoku radioindikátoru žilním systémem až do
úrovně horní duté žíly.
Následně se může provést scintigrafie plic - k posouzení
příp. poruchy perfuze v důsledku embolizace.
Pořizují se planární scintigrafické snímky oblasti
vyšetřovaného krevního řečiště. Výhodné je snímání v
"klouzavém" celotělovém režimu s plynulým posuvem
pacienta pod kamerou, až do oblasti plic, kde vzniká obrázek
plicní perfuze :
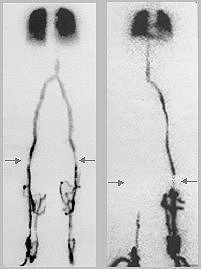 |
Radionuklidová flebografie dolních
končetin. Vlevo: Fyziologický nález dobrého a symetrického průtoku venózním systémem obou končetin. Vravo: Patologický případ flebotrombického postižení se zablokovaným žilním odtokem v pravé dolní končetině. (šipkami je označena poloha škrticích pásků .) Vyšetření byla provedena ve whole body režimu, nahoře jsou obrázky perfúzní scintigrafie plic (bez patrné embolizace). (scintigramy pořídil MUDr. L.Mrhač, KNM FN Ostrava) |
Hodnocení: Zobrazení scintigramů v monochromatické
šedo-černé škále s vhodnou úrovní modulace pro zobrazení
i nízkých úrovní aktivity. Vizuální hodnocení - posuzujeme
zvláště možnost flebotrombotického postižení, příp. i
plicní embolizaci.
Lymfoscintigrafie
Účel:
Zobrazení lymfatického řečiště a odtoku lymfy z
vyšetřované oblasti, posouzení zpomalení či zablokování
lymfodrenáže. Pomáhá v diferenciální diagnostice otoků
dolních a horních končetin, které by mohly být způsobeny
zhoršeným lymfatickým odtokem. Velmi užitečná je též v
nádorové diagnostice pro detekci sentinelových uzlin (je popsáno níže).
Radiofarmaka:
99mTc-
značený koloid albuminu o velikosti částic cca 10-80 nm,
které dobře pronikají lymfatickými cévami i uzlinami (pro zobrazení sentinelových uzlin se v koloidu
používají větší částice cca 100-600 nm, které se
zachycují ve vazivové tkáni uzlin).
Aplikovaná aktivita cca 20-80 MBq na jeden vpich, celková
aktivita cca 100-150 MBq.
Provedení:
Při podkožní aplikaci značeného koloidu se zobrazuje
povrchový lymfatický systém, při hlubší aplikaci do svalů
se zobrazí hluboký lymfatický systém.
Pro vyšetření povrchového lymfatického systému se aplikuje
subkutánně nebo intradermálně vpichem mezi palcem a druhým
prstem na ruce nebo noze. Pro vyšetření hlubokého
lymfatického systému se aplikuje subfasciálně hluboko do
svalů, na ruce do svalů hypothenaru, na noze do prostoru za
Achyllovou šlachou, nebo do svalů v oblasti paty či
retromalleolárně. Koloidní radiofarmakum se po této aplikaci
vstřebává do lymfatických kapilár (nikoli
do žilního systému) a je transportováno
lymfatickým řečistěm do regionálních lymfatických uzlin.
Scintigraficky lze sledovat tento postup radiofarmaka
lymfatickým řečištěm a jeho kumulaci v lymfatických
uzlinách. ...... ............
Po aplikaci radiofarmaka se za půl hodiny
provádí statická planární scintigrafie, nejlépe na
dvouhlavé gamakameře (používané pro celotělová a
tomografická zobrazení). Event. lze provést dynamickou
scintigrafii od aplikace radiofarmaka do 30.minuty. Následuje
další vyšetření po cca 30min. fyzické zátěže (u dolních
končetin chůze, u rukou cvičení paží, pohyb prstů), s
následující statickou scintigrafií.
Pro srovnání se provádí současně vyšetření obou
párových končetin.
Pozn.: Radiofarmakum
může být aplikováno i do jiných míst, kde je podezření na
lymfedém. Po průchodu lymfatickým systémem se část
radiofarmaka dostává do žilního řečistě a je pak
vychytáváno retikuloendotelinálními buňkami jater a sleziny,
které jsou pak v pozdějších časech vidět na
scintigrafických obrazech (při
lymfoscintigrafii se již tyto obrazy nehodnotí).
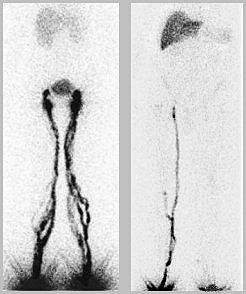 |
Příklad Lymfoscintigrafie dolních
končetin. Vlevo: Fyziologický scintigram dobrého a symetrického průtoku lymfatickým systémem obou končetin Vravo: Patologický případ mírného snížení lymfatického průtoku v pravé končetině a zablokování lymfatického ptůtoku v levé dolní končetině. Vyšetření byla provedena ve whole body režimu, nahoře se zobrazuje vychytávání radiofarmaka v játrech (to se při lymfoscintigrafii nehodnotí). (scintigramy pořídil MUDr. L.Mrhač, KNM FN Ostrava) |
 |
Další příklad lymfoscintigrafie
dolních končetin. Vlevo: Fyziologický scintigram dobrého a symetrického průtoku lymfatickým systémem obou končetin Vravo: Výrazně patologický případ a zablokování lymfatického odtoku v levé dolní končetině s rozsáhlým otokem - lymfedémem lýtka. (scintigramy pořídil MUDr. L.Mrhač, KNM FN Ostrava) |
Hodnocení:
Modulaci obrazů je třeba optimalizovat pro zvýraznění
oblastí nižších aktivit, s potlačením vysokých četností
impulsů v místech aplikace radiofarmaka. Provádí se
většinou vizuální hodnocení, posuzuje se průběh transportu
lymfatickými cestami a zobrazení spádových uzlin - u dolních
končetin v tříslech, u horních končetin v axilách. U
lymfedému se pozoruje difuzní retence radiofarmaka v podkoží
postižené oblasti. Při těžkém postižení (zablokování)
odtoku lymfy se pozoruje stagnace radiofarmaka v místě aplikace
po celou dobu vyšetření.
Lze provést i semikvantitativní
hodnocení stanovením množství radiofarmaka ve spádové
oblasti uzlin (v tříslech či v axilách) v poměru k
množství aplikovaného radiofarmaka (v procentech); provádí
se jen zřídka....
Sentinelové uzliny - scintigrafie,
radiačně navigovaná chirurgie
Mízní kapiláry mají "štěrbiny", kterými se mohou
dovnitř dostávat i živé nádorové buňky. Nádorové buňky
se tak z primárního ložiska šíří především
lymfatickými cestami, takže jako první bývají zasaženy lymfatické
uzliny v okolí nádorového ložiska. První taková
uzlina v lymfatickém "povodí" nádorového ložiska
se nazývá sentinelová uzlina
("strážná"). Hromadění radioindikátoru v
uzlinách se dá zobrazit scintigraficky. Aplikujeme-li do
periferní části nádorového ložiska vhodný radioindikátor
koloidního skupenství (nejčastěji 99mTc nanokoloid, velikost částic cca 100-600 nm,
aktivita cca 40-150 MBq), bude se šířit lymfatickými cestami
a zachycovat a shromažďovat se v těch
uzlinách, které jsou lymfaticky spojeny s nádorovým
ložiskem.
 |
| Scintigrafie a radiačně navigovaná
chirurgie sentinelových uzlin. Vlevo: Příklad zobrazení dvou axilárních sentinelových uzlin u maligního melanomu. Uprostřed: Radiometr s miniaturní kolimovanou gama-sondou pro peroperační detekci sentinelových uzlin. Vpravo: Měření a excize sentinelové uzliny. (scintigraf. obrázky sentinelových uzlin pořídil Doc.MUDr. O.Kraft, PhD., KNM FN Ostrava) |
Důlžité je pak sledování radioindikátoru
během vlastního chirurgického výkonu, kdy pomocí kolimované
detekční sondy chirurg přímo v operačním poli může najít
sentinelovou uzlinu s obsahem radioindikátoru, a též u
vyoperované uzliny se přesvědčit, zda je v ní obsažen
radioindikátor *) .
*) Spolu s radioindikátorem se aplikuje
současně i modré barvivo (izosulfanová modř), které
rovněž proniká do uzlin, takže chirurg může sentinelovou
uzlinu rozpoznat i podle modrého zabarvení.
Po aplikaci radioindikátoru se nejprve provede
scintigrafické zobrazení se zakreslením zobrazených uzlin.
Pak pacient odchází k vlastnímu chirurgickému výkonu,
během něhož se používá detekční gama-sonda
jednak k peroperační detekci sentinelové uzliny, jednak k
detekci radioaktivity v již vyoperované uzlině. Dále
následuje histologické vyšetření sentinelové uzliny pro
klasifikaci typu tumoru, což pomůže optimalizovat další
postup terapie.
Scintigrafie značených krevních elementů
Krev je tvořena krevní plasmou
(objemově cca 60%), v níž jsou ve formě suspenze rozptýleny
buněčné krevní elementy třech druhů :
-
Erytrocyty (červené krvinky) jsou
nejdůležitější krevní elementy, tvoří cca 40-48 % objemu (tento podíl erytrocytů na celkovém krevním objemu
se nazývá hematokrit).
Obsahují červené krevní barvivo hemoglobin.
Hlavní funkcí erytrocytů je absorpce kyslíku
z plic v hemoglobinu a jeho přenos do tkání a přenos oxidu
uhličitého v opačném směru.
- Leukocyty
(bílé krvinky), které jsou důležitou
součástí imunitního systému organismu.
Vyskytuje se několik typů leukocytů :
Lymfocyty - ...B-lymfocyty, T-lymfocyty,
...Monocyty , ....... Makrofágy , ........Granulocyty , .......
Dendritické buňky .....
O úloze těchto leukocytů v nádorové terapii se
zmiňujeme v §3.6, části "Chemoterapie" a "Cílená
biologická léčba - monoklonální
protilátky"
.
-
Trombocyty (krevní destičky) diskovitého
tvaru o velikosti jen 2-4 mikrometry. Tvoří se v kostní dřeni
z megakaryocytů. Jejich hlavní úlohou je krevní koagulace
pro zastavení krvácení z poškozené krevní cévy.
Leukocyty a trombocyty tvoří jen asi 1% z celkového objemu
krve....
Krevní elementy, spolu s krevní plasmou, proudí
kontinuálně cévním systémem a postupně pronikají do všech
tkání a orgánů, kde se mohou podílet na řadě
fyziologických a příp. i patologických dějů. Označíme-li
tedy určitý krevní element vhodným gama radionuklidem,
můžeme po jeho i.v. aplikaci scintigraficky zobrazovat, kam
fyziologicky či patologicky pronikl ve
vyšetřovaných tkáních a orgánech, jak se tam distribuuje,
s jakými případnými anomáliemi.
Značené erytrocyty
Používají se většinou 99mTc-značené
erytrocyty, které je možno připravit dvěma způsoby:
1. Laboratorně in vitro z
odebraného vzorku krve, v němž se erytrocyty označí 99mTc a reinjektijí se
zpět pacientovi. 2. In vivo,
kdy se pacientovi nejprve aplikuje rozpuštěná sůl cínu a po
asi 15 minutách se aplikuje potřebná aktivita 99mTc-pertechnetátu.
Cínové ionty Sn2+ umožní vazbu technecia na červené krvinky v oběhu.
Značené erytrocyty se používají pro :
- Blood-pool rovnovážnou dynamickou hradlovanou scintigrafii
myokardu - je podrobně popsáno v §4.9.4, část
"Rovnovážná hradlovaná ventrikulografie".
- Scintigrafii lokalizace krvácení do GIT. Po
i.v. aplikaci značených autologních erytrocytů se případné
ložisko krvácení na scintigramech projeví zvýšením
koncentrace radioaktivity v oblasti kde dochází ke krvácení
(§4.9.3, pasáž "Scintigrafická lokalizace krvácení do GIT").
Značené leukocyty
Po odběru krve, separaci a promytí se leukocyty
in vitro značí 99mTc
HMPAO (300 – 500 MBq) nebo 111In-oxin
(20-40 MBq). Další
(novější) možností je značení in vivo pomocí antigranulocytárních
monoklonálních protilátek MAb, jako jsou 99mTc-sulesomab a 99mTc-besilesomab,
které se vážou na leukocyty.
Značené leukocyty se používají pro
zobrazení zánětlivých ložisek v tkáních a
orgánech. Po aplikaci autologních značených leukocytů nebo
MAb se provádí scintigrafie za 30 min., 4 hod., příp. i za 24
hod. - celotělová scintigrafie, cílené snímky, příp.
SPECT. Je popsáno v §4.9.6, pasáž "Scintigrafie
zánětlivých ložisek".
Značené trombocyty
Pro scintigrafii se trombocyty značí in vitro pomocí 111In-oxinu
(podobně jako leukocyty). Vyžaduje to izolaci krevních
destiček z plné krve, diferenciální centrifugaci,
promývání pufrem a další procedury. Laboratorně je to
poměrně náročné.
Ve scintigrafické diagnostice v
nukleární medicíně se značené trombocyty používají
zatím poměrně zřídka, především ve třech oblastech:
hluboká žilní trombóza, srdeční tromby a rejekce
transplantovaných orgánů (hlavně ledvin).
...................... ..................
4.9.10 Méně významná a řidčeji
používaná radioisotopová vyšetření
Na závěr zde pro úplnost stručně zmíníme některé metody,
které mají okrajový význam v nukleární medicíně, nebo
jsou již opuštěné - ať již proto, že vyšetřují vzácně
se vyskytující poruchy a onemocnění, nebo byly vytlačeny
jinými novějšími metodami či modalitami. Především sem
patří prakticky všechny metody nescintigrafické *),
používající měření vzorků nebo detekci záření
pomocí scintilačních sond. I když se na některých
pracovištích ještě "ze setrvačnosti" používají
(popř. je požadují kliničtí partneři), z hlediska oboru
nukleární medicíny se jedná o metody již v zásadě
opuštěné. Některé z těchto metod patřily ve své době ke
klinicky užitečným a sehrály důležitou úlohu ve vývoji
oboru nukleární medicíny (byla to např.
radionuklidová renografie nebo akumulace štítné žlázy), jiné byly sporné a málo validní již od
samého začátku (např. radionuklidová
srdeční cirkulografie či stetoskopie s použitím
scintilační sondy). Teprve zkušenosti z
podstatně dokonalejší scintigrafické diagnostiky ukázaly,
jak hrubých chyb se sondové metody svým
pohledem "naslepo" dopouštěly.
*) Jedinou výjimkou důležitosti
nescintigrafické diagnostiky je peroperační detekce
sentinelových uzlin na operačním sále pomocí
miniaturizované gama-sondy (viz "Radiačně
navigovaná chirurgie - sentinelové uzliny").
Ostatně, i některé scintigrafické postupy,
podrobněji popisované v hlavním textu této kapitoly, se v
průběhu vývoje posunuly - ať již právem či neprávem -
mezi méně používané a částečně opouštěné metody (je to např. dynamická scintigrafie perfuze mozku,
statická scintigrafie jater a sleziny, dynam. splenoportografie,
....); dokonce i tak elegantní a dobře
propracované metody dynamické scintigrafie jako je
radionuklidová hradlovaná ventrikulografie a bolusová
angiokardiografie se používají čím dál řidčeji... Dále
se jedná o metody experimentální, používané dočasně na
některých pracovištích pro výzkumné účely; po dokončení
výzkumu se již jen použijí jejich výsledky pro publikace a
příslušné metody do klinické praxe neproniknou (příkladem mohou být metabolické studie mozku nebo
scintigrafie migrace 111In- značených dendritických buněk do lymfatických
uzlin při imunitní protinádorové vakcinaci - §...
"...").
Nukleární
hematologie
Do kategorie okrajových téměř opuštěných metod patří
prakticky celá klasická nukleární hematologie, která byla
"v kurzu" zejména v počátečních obdobích
nukleární medicíny, v 60.-70.letech. Využívaly se
především tři metody :
- Stanovení
volumu cirkulující krve
je založeno na zřeďovacím neboli dilučním principu. Do
oběhu aplikujeme přesně známé množství radioindikátoru a
po dokaném promíchání v krevním oběhu odebereme vzorek krve
o známém objemu (cca 1ml), který měříme v kalibrovaném
studnovém scintilačním detektoru. Pomocí dilučního zákona
pak vypočítáme objem, v němž se radioindikátor v oběhu
rozmíchal a rozředil. Jako radioindikátor se používají
autologní erytrocyty značené chromem 51Cr (chromanem sodným), které během měřící doby
neunikají z krevního řečiště. Pro stanovení
cirkulujícího objemu erytrocytární masy měříme aktivitu
vzorku plné krve. Celkový objem krve je tvořen objemem plasmy
a objemem krevních elementů, především erytrocytů.
Měření cirkulujícího objemu plasmy se někdy
provádělo pomocí 131I značeného sérového albuminu, většinou se však
využívá výsledku z 51Cr-erytrocytů celkového objemu krve, z něhož se
pomocí hematokritu vypočte objem plasmy.
- Přežívání erytrocytů a lokalizace
místa jejich destrukce
se stanovuje zejména při diagnostice příčin anemií. Za
fyziologických okolností erytrocyty žijí asi 120 dní. Staré
a "opotřebované" erytrocyty jsou za normálních
okolností zachycovány především ve slezině, kde zanikají
(destrukce, sekvestrace). V některých patologických
případech (hemolytické anemie) jsou červené krvinky
předčasně a ve zvýšené míře destruovány hlavně ve
slezině, v menší míře v játrech. Je proto užitečné
zjistit délku života erytrocytů v organismu.
Pro tento účel by bylo nejvhodnější označit
jednu generaci "nových" erytrocytů a přímo měřit
skutečnou délku jejich života. Tato metoda (s označením prekurzorových dřeňových buněk
radioaktivními isotopy železa ve formě sulfátu nebo chloridu) se, vzhledem ke své náročnosti a zdlouhavosti,
používala jen ojediněle pro experimentální účely. Pro
klinické použití se používá metoda značení směsi
všech populací červených krvinek, jež jsou přítomny v
krevním oběhu. V odebraném vzorku krve se pomocí inkubace s 51Cr-chromanem sodným
označí erytrocyty; tyto označené autologní erytrocyty se pak
reinjektují zpět pacientovi. Pak postupně odebíráme krevní
vzorky za 24 hod., 2 dny, ..(2 krát týdně)... po dobu 2-3
týdny, až jejich aktivita (měřená ve studnovém
scintilačním detektoru, s korekcí na rozpad 51Cr a příp. na
hematokrit) klesne zhruba na polovinu počáteční hodnoty.
Naměřenými hodnotami časové závislosti aktivity 51Cr v těchto
krevních vzorcích proložíme exponenciální funkci,
z níž stanovíme poločas přežívání chromem
značených erytrocytů - tzv. "chrómový
poločas"; ten vychází zhruba poloviční než je
skutečný poločas přežívání erytrocytů. Normální
hodnota tohoto poločasu je cca 20-30 dní, u těžké hemofilie
může klesnout i na 5 dmů.
Souběžně s měřením přežívání může
probíhat i analýza místa zvýšené destrukce erytrocytů.
Kolimovanou scintilační sondou měříme orgánovou aktivitu
oblasti srdce (prekordia) - slouží jako indeferentní
referenční tkáň, oblasti jater a sleziny (za reprodukovatelných podmínek - značky na kůži,
nakreslené těsně po aplikaci pomocí navigace sondou). První měření se provádí asi za hodinu po
aplikaci, další měření pak ve dnech kdy se odebírají
vzorky pro stanovení přežívání; i zde se provádí korekce
na rozpad 51Cr. Naměřené hodnoty aktivity (počtu impulsů) nad
játry a slezinou vztahujeme k aktivitě nad srdcem - normujeme
četnosti impulsů nad játry a slezinou k četnosti impulsů nad
srdcem. Stanovujeme nadměrnou aktivitu v játrech a
slezině - normalizované "impulsy navíc" (u sleziny pak případně tzv. hepatolienální
index, což je poměr četnosti měřený nad játry a
slezinou). Přehledné vykreslení v grafu
nám pomáhá analyzovat časový průběh orgánové aktivity a
srovnat jej s normálovou mezí. Na obrázku níže je
patologický případ pacientky s těžkou hemolytickou anemií
(po provedené splenektomii došlo k dlouhodobé normalizaci
krevního obrazu i poločasu přežívání erytrocytů).
| Vyhodnocení přežívání erytrocytů a lokalizace jejich destrukce programem ERYT | |
 |
|
| Poločas
přežívání erytrocytů: Z exponenciální analýzy aktivity krevních vzorků, odebíraných po dobu 12 dní po aplikaci 51Cr-značených autologních erytrocytů, vychází výrazně zkrácený poločas přežívání erytrocytů 6,9 dní (normální hodnota je 25-35 dní) - svědčí pro závažnou hyperhemolýzu. Destrukce erytrocytů: Měření orgánové aktivity kolimovanou scintilační sondou nad srdcem, játry a slezinou ukazuje normální sekvestraci v játrech, avšak výrazně zvýšenou sekvestraci erytrocytů ve slezině. Z á v ě r : |
- Vyšetření kinetiky železa pomocí 59Fe
Železo je důležitý biogenní prvek - je součástí
především hemoglobinu, dále myoglobinu, feritinu,
transferinu. Vyšetření kinetiky železa se používá
především k diagnostice poruch erytropoézy. Po i.v. aplikaci 59Fe-citronanu se
nejprve stanovuje plasmatická clearance železa:
odebírají se krevní vzorky v 5., 10., 20., ...., 180., 240.
minutě po aplikaci a v centrifugované plasmě se ve studnovém
detektoru měří aktivita. Vyhodnocuje se čas, ve kterém dojde
k poklesu aktivity plasmy na polovinu - poločas T1/2 úniku železa z
plasmy. Dále se stanovuje denní obrat plasmatického
železa, což je celkové množství železa, které uniká
za časovou jednotku (1den) z plasmy [mmol/litr krve/den].
Dalšími odběry vzorků plasmy (3 krát týdně po dobu 14-21
dnů) se stanovuje utilizace železa erytrocyty, což je
procentuální podíl aplikovaného železa 59Fe, které se zabuduje do hemoglobinu cirkulujících
erytrocytů. V ojedinělých indikacích se scintilační sondou
měří aktivita radioželeza nad orgány, které se
účastní ferokinetiky - kostní dřeň, játra, slezina.
Tato pracná a zdlouhavá vyšetření ferokinetiky byla
užitečná jen ve speciálních případech a nyní se snadněji
a přesněji diagnostikují biochemickými metodami.
Vzokové
metody nukleární hematologie jsou již opuštěné, avšak
svůj význam stále mají metody scintigrafie pomocí
radionuklidově značených krevních elementů
(jsou zmíněny výše "Scintigrafie
značených krevních elementů").
Další okrajové metody
Z vyšetření GIT jsou již opuštěny vzorkové metody
vyšetření resorpce látek v organismu (v tenkém střevě),
krvácení do GIT, či ztrát bílkovin střevní stěnou
měřením vzorků stolice :
- Schillingův
test
je vyšetření resorpce vitamínu B12 (cyanocobaltamin, který se vstřebává v ileu vázaný
na glykoprotein) v organismu; je nezbytný
pro erytropoézu a též pro tvorbu leukocytů a trombocytů. Po
perorálním podání cca 40kBq 57
nebo 58Co- značeného vitamínu B12, spolu s 1g
vitamínu neznačeného (pro vysyceni
vazebné kapacity kobaltaminu), se
značený i neznačený B12 začne vylučovat ledvinami. Od aplikace se 24 hodin
sbírá moč, pomocí scintilačního detektoru se změří její
aktivita a vyjádří se v % aktivity aplikované. Dostatečná
resopce B12
by měla být větší než 10%.
V 60.letech se resorpce B12 pokusně
vyšetřovala pomocí jeho retence v těle měřením na celotělovém
detektoru (7.den po aplikaci) - již dávno opuštěná
metoda.
- Průkaz
krvácení do GIT
vzorkovou metodou je opuštěný, je nahrazený scintigrafickou
metodou "Scintigrafická lokalizace krvácení do GIT".
Ze scintigrafických metod můžeme jmenovat některé
následující okrajové (avšak občas prováděné) metody :
- Scintigrafie
scrota
slouží pro posouzení perfúze varlat a skrotálních
tkání, především při podezření na torzi varlete
a při zánětech varlat a nadvarlat. Současně s aplikací 99mTc-technecistanu
sodného se kamerou, nastavenou na oblast scrota (s vhodným
zvětšením ZOOM), nastřádá perfúzní dynamická
scintigrafie cca 60 snímků po 1sec. a pak za cca 5 minut statický
scintigram zachycující rozložení radiofarmaka v tkáni a
v krevním řečišti skrota. Při akutní torzi se pozoruje snížená
perfuze v oblasti postiženého varlete a snížená
akumulace radiofarmaka v tkáňové fázi. Po 24 hod. po vzniku
torze se v tkáňové fázi může pozorovat periferní lem
zvýšené akumulace radiofarmaka v důsledku reaktivní
hyperemie okolních tkání kolem ischemického varlete. Metoda
může mít akutní význam včasné diagnózy torze varlete,
neboť jen brzký zákrok může zachránit varle před
nevratnými nekrotickými změnami.
- Scintigrafie
slinných žláz
se používá při zánětech slinných žláz a při
nedostatečné tvorbě slin - suchosti v ústech (Sjögrenův
syndrom). Scintigrafické zobrazení je založeno na schopnosti
slinných žláz vychytávat anionty. Používá se pertechnetát
99mTcO4-, kterého se i.v. aplikuje cca 300MBq. Spustí se dynamická
scintigrafie, při níž se snímkuje oblast slinných
žláz v přední projekci - cca 60 snímků po 1 minutě. V
polovině vyšetření se příp. do úst aplikuje salivační
podnět - citronová šťáva. Někdy se následně
provádí i statická scintigrafie v přední a boční projekci.
Dynamická scintigrafie se hodnotí z průběhu křivek ze
zájmových oblastí glandula parotis, gl. sublingualis a
submandibulares. Normální křivka má vzestupnou fázi,
dosahuje vrcholu asi ve 20.minutě, s následným pozvolným
poklesem, který se salivačním podnětem výrazně urychlí.
Při akutním zánětu je v důsledku hyperemie zvýšená
akumulace radioindikátoru ve slinných žlázách, čas
dosažení maxima bývá zkrácen a pokles křivky je zpomalen; u
chronického zánětu je křivka celkově plochá. U Sjögrenova
syndromu bývá vzestupná fáze křivky normální, ale
sestupná část je plochá, včetně fáze po salivačním
podnětu.
- Scintigrafie
pankreatu
s radiofarmakem 75Se-selenomethionin se prováděla v 70. a 80.
letech - je stručně popsána v §4.9.3, pasáž "Scintigrafie
pankreatu".
- Diagnostika
malabsorpce žlučových kyselin
pomocí 75Se- kyseliny tauroselcholové, při hodnocení
snížení absorpční funkce terminálního ilea (např. u
Crohnovy choroby, zánětlivého či toxického poškození). Je
zmíněna rovněž v §4.9.3, pasáž "Diagnostika malabsorpce
žlučových kyselin".
- Scintigrafie ......... .?....další.................?.........
--------------------------------------------------------------------------------------------------------------------------------
Autorská poznámka k §4.9 "Klinická scintigrafická diagnostika v
nukleární medicíně"
--------------------------------------------------------------------------------------------------------------------------------
Autor tohoto pojednání je fyzik, kterému v podstatě
nepřísluší vyjadřovat se ke klinickému významu
scintigrafických metod. Avšak již několik desítek let se
zabývám nejen jadernou a radiační fyzikou, ale i jejími
aplikacemi v biologii a medicíně, matematickým modelováním a
počítačovým vyhodnocováním scintigrafických studií.
Účastnil jsem se výzkumu a vývoje řady metod nukleární
medicíny. Během své 40-leté úzké spolupráce s kolegy
lékaři v oblasti nukleární medicíny jsem tak trochu
"načichl" i klinickými aspekty radioisotopových
metod. Není to však má vlastní profesní "parketa"
a tak se omlouvám za jistě řadu zjednodušení při výkladu
jednotlivých scintigrafických vyšetřovacích metod v
klinické nukleární medicíně. My fyzikové to všechno
vidíme příliš "mechanisticky" a zjednodušeně,
zajímáme se především o vnitřní mechanismy a podstatu
studovaných jevů, avšak konkrétní medicínskou stránku
nemusíme postihovat dostatečně komplexně...
Toto pojednání si v §4.9 rozhodně nečiní
nárok "konkurovat" pracem (knihám,
skriptům, článkům v časopisech) jistě
erudovanějších kolegů lékařů z oblasti nukleární
medicíny. Cítil jsem jen jakýsi "dluh" a výzvu se
vyjádřit (byť možná
diskutabilně..?..) ze svého úhlu pohledu
i ke klinickým aspektům tak pěkné a zajímavé metody, jakou
je scintigrafie v nukleární medicíně.
Jedná se zde spíše o doplnění podrobného výkladu
fyzikálních a technických aspektů scintigrafie v
předchozích §4.1-4.7 pojednání "Scintigrafie". §4.9 je
určen spíše fyzikům, technickým pracovníkům a
radiologickým asistentům působícím v oboru nukleární
medicíny i jinde, jakož i studentům fyzikálních,
biomedicínských či lékařských oborů.
§ Uvítám připomínky kolegů §
| Zpět: Jaderná fyzika a fyzika ionizujícího záření | |||
| Jaderná a radiační fyzika | Detekce a spektrometrie záření | Aplikace záření | |
| S c i n t i g r a f i e | Počítačové vyhodnocování scintigrafie | Radiační ochrana | |
| Gravitace, černé díry a fyzika prostoročasu | Antropický princip aneb kosmický Bůh | |||
| AstroNuklFyzika ® Jaderná fyzika - Astrofyzika - Kosmologie - Filosofie | |||